2. 400038 重庆,第三军医大学西南医院:全军普通外科中心,全军临床病理学研究所
2. Institute of Pathology, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)起源于胃肠道间质的Cajar细胞,是消化道最常见的间叶组织肿瘤[1]。GIST的主要发病机制是原癌基因c-kit发生功能获得性突变,赋予了细胞恶性增殖的能力,进而产生肿瘤[2]。GIST的治疗策略主要以手术切除为主,但即使在手术完整切除后,仍有约50%的患者在2年内肿瘤复发[3]。目前对GIST在发生c-kit 基因突变后获得高增殖能力的分子机制仍有待于探索,而这也将对其治愈提供帮助。
SCIN是钙离子依赖性细胞骨架调控蛋白,主要表达于分泌细胞[4]。其主要功能是通过对肌动蛋白的切割、加帽等作用调控细胞骨架,进而调控囊泡运输、胞吐等细胞基本活动[5]。近年来,SCIN在肿瘤中的作用被日益发现并引起重视,SCIN的表达上调同膀胱癌对顺铂的抵抗有关[6],在肺癌[7]和前列腺癌[8]中,SCIN具有促进肿瘤细胞增殖的作用。而在GIST中SCIN对增殖方面的调控作用仍然未知。
本实验中,我们使用慢病毒敲低SCIN以研究GIST细胞在体内和体外环境中增殖能力和克隆形成能力的变化,同时研究了伊马替尼作用于GIST细胞抑制其增殖后SCIN表达的改变,初步探讨了SCIN在GIST细胞中对增殖的调控作用,以期为GIST的治疗提供新的靶点。
1 材料与方法 1.1 实验材料及试剂GIST原代细胞由第三军医大学西南医院普通外科参照文献[9]报道前期构建。DMEM/F12培养基和胎牛血清(FBS)购于Gibco公司,TRIzol、cDNA逆转录试剂盒及qRT-PCR试剂盒购于TaKaRa公司。SCIN干扰慢病毒、SCIN及β-actin引物购于上海立菲生物科技有限公司。小鼠抗人SCIN单克隆抗体购于Santa Cruze公司,小鼠抗人β-actin单克隆抗体和HRP标记 的山羊抗鼠IgG购于碧云天生物技术有限公司,CCK-8 试剂盒购于Sigma公司,青霉素G和链霉素购于Invitrogen公司,Western blot的ECL显影液购于Thermo公司。8只雌性BALB/c裸鼠购于第三军医大学实验动物中心并培养于无病原体环境。甲磺酸伊马替尼购于Sigma公司。
1.2 实验方法 1.2.1 细胞培养GIST细胞培养于含10%FBS的DMEM/F12完全培养液中,放置于37 ℃、5%CO2、95%湿度的细胞培养箱内静置培养,待细胞汇合度达90%时,以1 ∶3传代。根据细胞生长状态,每天换液1次,每2天传代。传代时先去除培养基,使用37 ℃预热的PBS轻轻润洗细胞2次,吸净PBS后,加入胰酶消化液消化细胞,待细胞消化完全后,加入同等体积的含血清完全培养基终止消化。轻轻吹打细胞,将细胞悬液移入离心管,以800 r/min的速度离心5 min。去除上清液,加入完全培养基吹散细胞,将细胞移入新的培养皿中继续培养。
1.2.2 质粒构建及shRNA转染SCIN基因慢病毒载体的构建、鉴定测序、质粒抽提以及慢病毒包装均由上海立菲公司完成。稳定干扰SCIN的shSCIN(shSCIN 1、shSCIN 2)和对照序组(Mock)的序列如下:shSCIN 1 5′-GGAGAAAGGAGCAGAGTATGTAGCA-3′; shSCIN 2 5′-GGAGGTTGATGTTGATGCAAATTCA-3′;Mock 5′-TTACGCGTAGCGTAATACG-3′。转染步骤按说明书进行操作,将干扰SCIN的慢病毒加入汇合度约为50%的GIST细胞培养皿内,孵育8 h后,更换完全培养基,加入3 μg/mL浓度的嘌呤霉素筛选阳性感染细胞。敲低效率由qRT-PCR和Western blot检测,干扰效率达到90%者可用于后续实验。
1.2.3 Western blot 蛋白表达量检测GIST细胞先由PBS润洗,然后由RIPA裂解,裂解后的溶解液于4 ℃,15 000×g离心15 min,收集上清,提取总蛋白。蛋白浓度按BCA法测定。蛋白分离使用10% SDS-PAGE聚丙烯凝胶。分离后,采用半干转30 min转至PVDF膜上,使用5%脱脂奶粉于室温封闭2 h。封闭后孵育小鼠抗人SCIN单克隆抗体(1 ∶1 000)并于4 ℃过夜。二抗于室温孵育2 h,经ECL显影液显色后观察。内参使用β-actin。
1.2.4 总RNA提取及qRT-PCR一定量的GIST细胞经PBS润洗后,加入TRIzol裂解液裂解,并按照说明书要求提取总RNA。测定浓度后,按照说明书使用TaKaRa逆转录试剂盒进行逆转录并进行PCR扩增。SCIN cDNA的上游引物为5′-ATGGCTTCGGGAA-AGTTTATGT-3′,下游引物为5′-CATCCACCATATTGTGCT-GGG-3′,实验以β-actin为内参,其上游引物为5′-TTGCGTTACACCCTTTCTTG-3′,下游引物为5′-CACCTTCACCGTTCCAGTTT-3′。用2-ΔΔCt法计算各基因相对表达量。
1.2.5 细胞增殖检测Mock,shSCIN 1,shSCIN 2组 GIST细胞分别按照1000个/孔接种于96孔板,每孔加入0.1 mL含10%FBS的DMEM/F12培养基,于细胞培养箱中培养。分别于第1、2、3、4、5、6、7天时,将培养液换为0.1 mL含10%FBS的DMEM/F12及0.01 mL CCK-8溶液。在37 ℃继续培养1 h后,于450 nm处测定光密度值[D(450)]。
1.2.6 裸鼠皮下成瘤实验Mock及shSCIN 1组GIST细胞经过消化离心收集,以PBS重悬后进行计数。接种时每种分别计数5×105个接种于裸鼠腹股沟处皮下。接种后每天观察移植瘤生长情况,于3周后处死小鼠,取移植瘤标本并称质量。
1.2.7 平板克隆形成实验将处于对数生长期的GIST细胞计数后按照100/孔接种于6孔板中,每种细胞设置3个复孔,每孔加入含10% FBS的DMEM/F12完全培养基2 mL并置于培养箱中继续培养。每3~4天进行换液,于10 d后去除培养基,使用4 ℃预冷的PBS润洗细胞后,加4%多聚甲醛于室温下固定细胞20 min,然后用结晶紫溶液染色5 min。于光学显微镜下计数大于50个细胞的克隆数,并进行统计分析。
1.2.8 伊马替尼IC50测定将WT组GIST细胞分别按照1 000个/孔接种于96孔板,每孔加入0.1 mL含10%FBS的DMEM/F12培养基,放置于细胞培养箱中培养12 h,待细胞贴壁后,加入不同浓度(0.01~10 μmol/L)的伊马替尼,继续培养72 h。细胞存活率的测定按照CCK-8试剂盒说明书进行。抑制率=[D(450)处理组-D(450)空白组]/[D(450)对照组-D(450)空白组];存活率=1-抑制率;进而计算出药物的IC50。
1.3 统计学方法应用SPSS 17.0统计分析软件,所有数据以x±s表示,移植瘤质量比较和增殖差异比较采用非参数检验,两组比较采用两样本独立t检验。
2 结果 2.1 SCIN慢病毒稳定干扰细胞的建立使用慢病毒敲低GIST细胞中的SCIN后,运用qRT-PCR在RNA水平检测SCIN的敲低效率。 SCIN的RNA表达在对照组(Mock组)和野生型组(wild type,WT组)中SCIN的表达量相似,而shSCIN 1组和shSCIN 2组SCIN的RNA表达量同Mock组相比干扰 效率均高于90%(干扰效率分别为92.94%、91.47%)。 Western blot结果显示,shSCIN 1组和shSCIN 2组shSCIN的干扰效率均较高(图 1)。

|
| 1:WT组;2:Mock组;3:shSCIN 1组;4:shSCIN 2组 图 1 Western blot检测SCIN在各组GIST细胞中的敲低效率 |
2.2 敲低SCIN抑制GIST细胞的增殖能力
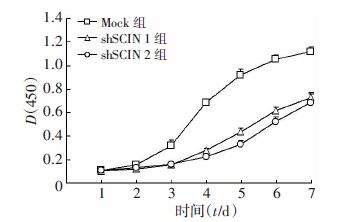
在SCIN稳定敲低后,我们又使用CCK-8方法检测了GIST细胞的增殖能力,结果显示shSCIN 1组和shSCIN 2组细胞增殖均受到明显抑制,抑制效果从第2~7天差异均有统计学意义(P<0.05,表 1,图 2)。以上结果表明,敲低SCIN可以明显抑制GIST细胞的增殖能力。
| 培养时间(d) | Mock组D(450) | shSCIN 1组 | shSCIN 2组 | ||
| D(450) | P | D(450) | P | ||
| 1 | 0.108 3±0.008 2 | 0.107 7±0.008 4 | 0.88 | 0.113 3±0.013 1 | 0.88 |
| 2 | 0.157 9±0.013 5 | 0.121 3±0.012 5 | 0.029 | 0.132 0±0.020 3 | 0.029 |
| 3 | 0.322 4±0.044 0 | 0.159 9±0.008 6 | 0.021 | 0.162 2±0.021 1 | 0.021 |
| 4 | 0.685 5±0.032 7 | 0.281 6±0.013 1 | 0.021 | 0.226 1±0.022 7 | 0.021 |
| 5 | 0.920 9±0.045 1 | 0.439 9±0.025 4 | 0.021 | 0.330 0±0.029 2 | 0.021 |
| 6 | 1.053 8±0.039 6 | 0.619 1±0.029 5 | 0.021 | 0.527 9±0.035 2 | 0.021 |
| 7 | 1.117 1±0.041 4 | 0.731 5±0.026 7 | 0.021 | 0.689 9±0.082 0 | 0.021 |
| P值为shSCIN组的D(450)值与当天Mock组D(450)值相比较的差异 | |||||
|
| 图 2 CK-8法检测敲低SCIN对各组GIST细胞增殖能力的影响 |
2.3 敲低SCIN抑制GIST细胞移植瘤的生长
我们选取了Mock组和shSCIN 1组GIST细胞进行移植瘤实验,每组细胞分别接种于4只裸鼠。观察发现Mock组最早于第7天出现肉眼可见肿瘤,而shSCIN 1 组最早于第12天出现肉眼可见肿瘤。3周后,所有裸鼠均形成肉眼可见肿瘤。观察发现Mock组肿瘤均大于shSCIN 1组,且Mock组移植瘤质量明显重于shSCIN 1组,差异具有统计学意义[Mock 组vs shSCIN 1组=(0.334 1±0.016 5)g vs (0.175 0±0.045 6)g,P<0.01,图 3。以上结果表明敲低SCIN可以抑制GIST细胞移植瘤的生长。

|
| 图 3 敲低SCIN抑制两组GIST细胞移植瘤的生长 |
2.4 敲低SCIN降低GIST细胞的克隆形成能力
我们检测了WT组、Mock组和shSCIN 1组GIST细胞的克隆形成能力,实验结果表明敲低SCIN显著降低GIST细胞的克隆形成能力(图 4)。shSCIN 1组的克隆形成数为(59.67±5.68),显著低于Mock组细胞的克隆形成数[(123.33±2.52),n=3,P<0.01]。

|
| A:WT组;B:Mock组;C:shSCIN 1 组 图 4 敲低SCIN降低各组GIST细胞克隆形成能力 |
2.5 伊马替尼抑制GIST细胞中SCIN的表达
我们首先测定了WT组GIST细胞的IC50值,结果为:IC50=0.57 μmol/L。我们选取了0.57 μmol/L的伊马替尼处理WT组GIST细胞,并分别在第1、3、5天时使用Western blot检测SCIN的表达量(图 5)。结果显示WT组GIST细胞在第1天时仍能够检测到SCIN的表达,第3天时表达明显减弱,第5天时表达更低。以上结果表明伊马替尼处理GIST细胞可以抑制GIST细胞中SCIN的表达。

|
| 1:第1天;2:第3天;3:第5天 图 5 estern blot检测伊马替尼处理WT组不同时间GIST细胞SCIN的表达 |
3 讨论
GIST是人类最常见的肉瘤[10],由于c-kit基因(75%~80%)或PDGFRA基因(<10%)发生功能获 得性突变[11-12],导致其编码的受体酪氨酸激酶(RTKs) 表达增高,这是GIST细胞获得恶性生长增殖能力最关键的改变[13-14]。KIT蛋白作为RTK家族的重要成员,其过表达和活化在GIST中最为常见,其在GIST中的活化包括两种形式,第一种是由于c-kit基因发生功能获得性突变而导致KIT蛋白发生非配体依赖性的自身磷酸化,另一种则是配体依赖性的活化[14]。由于两种形式的KIT活化均可以激活PI3K,因此推测GIST中PI3K/AKT通路是激活的,而文献[15]报道也证实了GIST细胞中KIT活化的两种方式均参与调控肿瘤增殖,且主要通过PI3K/AKT通路。但是在c-kit基因突变后,KIT的过表达在产生并维持其恶性增殖方面的作用非常复杂[16],其中的具体分子机制仍然有待于探索,而掌握调控GIST生长增殖的具体分子机制对GIST的治愈至关重要。
SCIN在调控肿瘤细胞增殖中的作用已日益被发现。在肺癌细胞系A549和H1299中,敲低SCIN可以通过上调Cyclin B1和p21而导致细胞周期停滞于G0/G1期,进而使肺癌细胞的增殖和克隆形成能力降低[7]。而在前列腺癌的PC3细胞系中,敲低SCIN则通过上调p16和p21的表达使细胞周期停滞于G0/G1期,抑制细胞的增殖能力[8]。SCIN在两种肿瘤中均通过p21来调节细胞增殖。据文献[17]报道PI3K/AKT通路的激活会抑制其下游通路中p21的表达,进而使细胞周期由G1期向S期进展,促进细胞的增殖。由此我们推测SCIN在GIST中调控增殖的机制可能与肺癌和前列腺癌类似,敲低SCIN可能通过上调p21的表达,解除GIST细胞中PI3K/AKT通路的活化对p21的抑制作用,使细胞周期停滞,进而抑制细胞的增殖。在我们的实验结果中,敲低SCIN不仅可以抑制GIST细胞的增殖和克隆形成,也能抑制其移植瘤的生长,均与此机制相符,支持这一推论。
RTKs抑制剂伊马替尼能够抑制KIT蛋白的自身磷酸化并高效阻断PI3K/AKT通路,从而抑制GIST细胞的增殖[18-20]。本实验观察到随着伊马替尼作用时间的增加,细胞增殖受到抑制后,SCIN表达在第1、3、5天逐渐降低,这可能是由于SCIN参与PI3K/AKT通路下游关于细胞周期的调控,并可能在细胞周期调控中扮演功能性分子,在伊马替尼抑制GIST细胞的增殖后,其表达也随增殖能力的降低而降低,但是其中具体机制仍有待于探索。
结合我们的实验结果,我们认为SCIN在GIST肿瘤组织中具有调控细胞增殖的作用,其对增殖的调控可能是作为PI3K/AKT下游通路中的功能性分子而参与对细胞周期的调控。值得注意的是,在伊马替尼抑制了GIST细胞的增殖后,SCIN的表达亦随之降低,因而可以认为SCIN不仅参与调控GIST细胞的增殖,也可以反映伊马替尼对GIST细胞增殖的抑制程度,其在GIST细胞中的表达量与其增殖能力具有较强的相关性。而在GIST中,如果针对SCIN作为治疗靶点,或许可以抑制肿瘤细胞的增殖能力,进而抑制肿瘤生长及复发。但是相关研究仍有待于进一步探索。
总之,我们的实验证明了敲低SCIN能够显著抑制GIST细胞的克隆形成能力和在体内及体外的增殖能力,伊马替尼在抑制GIST细胞增殖的同时也可降低SCIN的表达。我们的研究加深了SCIN在GIST中作用的认识,同时也丰富了GIST细胞增殖和伊马替尼对其作用机制的认知。我们认为SCIN或许可以作为伊马替尼对GIST细胞增殖的抑制程度的反映指标或成为GIST的治疗靶点。
| [1] | Kanda T. Criminal or bystander: imatinib and second primary malignancy in GIST patients[J]. Chin J Cancer Res,2013, 25 (5) : 490 –492. DOI:10.3978/j.issn.1000-9604.2013.10.15 |
| [2] | Wang C, Jin M S, Zou Y B, et al. Diagnostic significance of DOG-1 and PKC-theta expression and c-Kit/PDGFRA mutations in gastrointestinal stromal tumours[J]. Scand J Gastroenterol,2013, 48 (9) : 1055 –1065. DOI:10.3109/00365521.2013.816770 |
| [3] | Muhlenberg T, Grunewald S, Treckmann J, et al. Inhibition of KIT-glycosylation by 2-deoxyglucose abrogates KIT-signaling and combination with ABT-263 synergistically induces apoptosis in gastrointestinal stromal tumor[J]. PLoS One,2015, 10 (3) . DOI:10.1371/journal.pone.0120531 |
| [4] | Nag S, Larsson M, Robinson R C, et al. Gelsolin: the tail of a molecular gymnast[J]. Cytoskeleton (Hoboken),2013, 70 (7) : 360 –384. DOI:10.1002/cm.21117 |
| [5] | Marcu M G, Zhang L, Elzagallaai A, et al. Localization by segmental deletion analysis and functional characterization of a third actin-binding site in domain 5 of scinderin[J]. J Biol Chem,1998, 273 (6) : 3661 –3668. |
| [6] | Miura N, Takemori N, Kikugawa T, et al. Adseverin: a novel cisplatin-resistant marker in the human bladder cancer cell line HT1376 identified by quantitative proteomic analysis[J]. Mol Oncol,2012, 6 (3) : 311 –322. DOI:10.1016/j.molonc.2011.12.002 |
| [7] | Liu H, Shi D, Liu T, et al. Lentivirus-mediated silencing of SCIN inhibits proliferation of human lung carcinoma cells[J]. Gene,2015, 554 (1) : 32 –39. DOI:10.1016/j.gene.2014.10.013 |
| [8] | Wang D, Sun S Q, Yu Y H, et al. Suppression of SCIN inhibits human prostate cancer cell proliferation and induces G0/G1 phase arrest[J]. Int J Oncol,2014, 44 (1) : 161 –166. DOI:10.3892/ijo.2013.2170 |
| [9] | Fukuda K, Saikawa Y, Sako H, et al. Establishment and characterization of novel cell lines and xenografts from patients with gastrointestinal stromal tumors[J]. Oncol Rep,2013, 30 (1) : 71 –78. DOI:10.3892/or.2013.2425 |
| [10] | Datar M, Khanna R. Inpatient burden of gastrointestinal stromal tumors in the United States[J]. J Gastrointest Oncol,2012, 3 (4) : 335 –341. DOI:10.3978/j.issn.2078-6891.2012.037 |
| [11] | Hayashi Y, Bardsley M R, Toyomasu Y, et al. Platelet-Derived Growth Factor Receptor-alpha Regulates Proliferation of Gastrointestinal Stromal Tumor Cells With Mutations in KIT by Stabilizing ETV1[J]. Gastroenterology,2015, 149 (2) : 420 –432. DOI:10.1053/j.gastro.2015.04.006 |
| [12] | Xu C W, Lin S, Wang W L, et al. Analysis of mutation of the c-Kit gene and PDGFRA in gastrointestinal stromal tumors[J]. Exp Ther Med,2015, 10 (3) : 1045 –1051. DOI:10.3892/etm.2015.2613 |
| [13] | O’Brien K M, Orlow I, Antonescu C R, et al. Gastrointestinal stromal tumors, somatic mutations and candidate genetic risk variants[J]. PLoS One,2013, 8 (4) . DOI:10.1371/journal.pone.0062119 |
| [14] | Tan C J, Yang J L, Crowe P, et al. Targeted therapy in soft tissue sarcoma-a novel direction in therapeutics[J]. Chin Clin Oncol,2013, 2 (3) : 22 . DOI:10.3978/j.issn.2304-3865.2013.08.01 |
| [15] | Yuzawa S, Opatowsky Y, Zhang Z, et al. Structural basis for activation of the receptor tyrosine kinase KIT by stem cell factor[J]. Cell,2007, 130 (2) : 323 –334. DOI:10.1016/j.cell.2007.05.055 |
| [16] | Wang J, Cai J, Huang Y, et al. Nestin regulates proliferation and invasion of gastrointestinal stromal tumor cells by altering mitochondrial dynamics[J]. Oncogene,2015 . DOI:10.1038/onc.2015.370[Epubaheadofprint] |
| [17] | Lin P, Sun X, Feng T, et al. ADAM17 regulates prostate cancer cell proliferation through mediating cell cycle progression by EGFR/PI3K/AKT pathway[J]. Mol Cell Biochem,2012, 359 (1/2) : 235 –243. DOI:10.1007/s11010-011-1018-8 |
| [18] | Li J, Dang Y, Gao J, et al. PI3K/AKT/mTOR pathway is activated after imatinib secondary resistance in gastrointestinal stromal tumors (GISTs)[J]. Med Oncol,2015, 32 (4) : 111 . DOI:10.1007/s12032-015-0554-6 |
| [19] | Ma Y Y, Yu S, He X J, et al. Involvement of c-KIT mutation in the development of gastrointestinal stromal tumors through proliferation promotion and apoptosis inhibition[J]. Onco Targets Ther,2014, 7 : 637 –643. DOI:10.2147/OTT.S60458 |
| [20] | 李健. 胃肠道间质瘤的分子靶向治疗[J]. 中华消化外科杂志,2013, 12 (4) : 253 –256. DOI:10.3760/cma.j.issn.1673-9752.2013.04.004 |



