2. 400030 重庆,重庆大学计算机学院 ;
3. 402560 重庆 铜梁,解放军77128部队 ;
4. 100080 北京,中国科学院计算技术研究所
2. College of Computer, Chongqing University, Chongqing, 400030 ;
3. No. 77128 Troop of PLA, Tongliang, Chongqing, 402560 ;
4. Institute of Computing Technology, Chinese Academy of Sciences, Beijing, 100080, China
埃博拉病毒病是由埃博拉病毒(Ebola virus,EBOV)感染引起的一种烈性传染病,主要以人和非人类灵长类动物易感,致死率高达25%~90%[1-3]。临床以发热及出血为主要特征,表现为急性起病、发热、肌痛、出血、皮疹和以肝、肾为代表的多器官损伤[4]。EBOV属于丝状病毒科(Filoviridae) 埃博拉病毒属(Ebolavirus),有囊膜,为不分节段单链负股RNA。 EBOV 基因组长约19 kb,含有7个基因,其排列顺序为3′-NP-VP35-VP40-GP/sGP-VP30-VP24-L-5′。EBOV可分为5个亚型:扎伊尔埃博拉病毒(Zaire-EBOV)、苏丹埃博拉病毒(Sudan-EBOV)、本迪布焦埃博拉病毒(Bundibugyo-EBOV)、 塔伊森林埃博拉病毒(Tai Forest-EBOV) 和雷斯顿埃博拉病毒(Reston-EBOV)[5]。其中ZEBOV、SEBOV和BEBOV对人具有致命性,又以ZEBOV 致死率最高[2]。EBOV实验室确诊手段常用的方法有病毒分离培养,但存在盲目性且操作复杂敏感度不高;IgG-捕获ELISA和IgM-捕获ELISA[6-7],但临床存在窗口期,不能在发病早期快速检出EBOV;荧光定量PCR具有快速、敏感、定量的特点,但之前针对EBOV的荧光定量PCR检测方法,大都针对ZEBOV和苏丹型EBOV糖蛋白设计通用探针引物[8-9],无法区分型特异性。因此,本研究通过比对运算求得ZEBOV 型特异性核酸序列,设计引物探针建立了敏感、特异的ZEBOV荧光定量PCR检测方法。
1 材料与方法 1.1 主要仪器与试剂荧光定量PCR仪 ( Rotor-Gene Q,德国QIAGEN公司);荧光定量PCR试剂购自宝生物(大连) 工程有限公司(TaKaRa One Step PrimeScript RT-PCR Kit);样本核酸提取试剂购自德国QIAGEN公司(QIAamp Viral RNA Mini Kit)。
1.2 阳性模板合成从参考序列[10]中截出特异性核酸序列(KJ660348,11331-) 英潍捷基(上海)有限公司合成目标片段,构建质粒作为阳性模板。
1.3 引物与探针的设计、合成通过GenBank数据库,下载2014年从西非患者分离的3株ZEBOV株(KJ660348、KJ660347、KJ)[10] 及1976年从Mayinga分离的ZEBOV株(NC_) 并以此为目标,依托中国科学院计算技术研究所的Lambda-ICT系统,运用MUMmer软件进行匹配,再以匹配上的序列区段为基础,基于Insignia算法“同种求交”、“异种求并”,得到标签核酸序列,最后再通过BLAST与Nt库比较,筛选出最终的特异核酸标签[11]。从中选出一条序列(KJ660348,11331-11514,非编码区)交由英潍捷基(上海)有限公司设计合成TaqMan探针、引物,探针的5′端用荧光基团VIC标记,3′端用淬灭基团TAMRA标记(表 1)。
| 引物和探针 | 序列(5′→3′) | 长度(bp) | GC(%) | Tm 值(℃) |
| 正向引物 | CTTCCTCAAGCTTTTTTCTTAACCTACT | 28 | 36 | 58.4 |
| 反向引物 | TCACTAGAAATCCAATATACGAAATGGT | 28 | 32 | 58.5 |
| ZEBOV 探针 | VIC-TGAAACCTAACACACATGACCTGCGGG-TAMARA | 27 | 52 | 69.2 |
1.4 标准曲线的制备
由英潍公司提取交付的阳性质粒浓度为102.6 ng/μL,根据合成序列的A、T、G、C含量计算出其摩尔质量,乘以阿伏伽德罗常数6.02×1023得到病毒拷贝数,再用DEPC水作10倍系列稀释[12],得5×107、5×106、5×105、5×104、5×103、5×102 、5×101拷贝/μL系列标准模板,采用优化好的条件进行扩增标准模板,得到各自的Ct值。以Ct值为纵坐标,起始模板浓度的对数为横坐标,制作扩增曲线和标准曲线。
1.5 准确性和重复性实验取5×106、5×105、5×104拷贝/μL 3个批次的质粒标准品,同一批次下每个样本作3次重复,再在同一反应条件下做3次重复实验,计算Ct值批内、批间变异系数(CV)。
1.6 特异性检测在相同条件下,以上海生工合成的本迪布焦EBOV、科特迪瓦EBOV、莱斯顿EBOV、苏丹EBOV、马尔堡病毒、西尼罗河热病毒、东方马脑炎病毒、西方马脑炎病毒相应区段非编码基因作对照,并随机选择本院感染科、呼吸科、血液科、普外科等科室19例住院患者的痰液或粪便复杂样本RNA、重庆市公共卫生中心住院患者10例痰涂阳性痰液样本DNA、大学城19例不明原因发热患者咽拭子样本RNA作为阴性对照。
2 结果 2.1 引物与探针浓度优化和扩增反应条件用5×107、5×106拷贝/μL阳性质粒模板,优选引物与探针的最佳浓度。结果表明,用0.2 μm/μL的引物和0.4 μm/μL的探针对阳性质粒检测所获结果最优。优化的荧光定量PCR循环条件为:42 ℃ 5 min;95 ℃ 10 s;95 ℃ 5 s,58 ℃ 30 s ,72 ℃ 30 s,40个循环。
2.2 标准曲线的建立及荧光定量PCR灵敏性10倍系列稀释阳性模板质粒进行扩增,建立扩增曲线及标准曲线,标准品范围选5×107、5×106、5×105、5×104、5×103、5×102、5×101拷贝/μL。结果显示,阳性模板质粒拷贝数与相应Ct值相关系数R2>0.99,该方法的灵敏性达到5×101拷贝(图 1)。
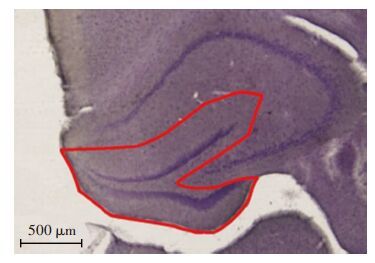
|
| A:扩增曲线;B:标准曲线 图 1 ZEBOV阳性质粒扩增曲线与标准曲线 |
2.3 荧光定量PCR的准确性和重复性
批内重复实验:取5×106、5×105、5×104拷贝/μL 3个批次的标准样品,每份样品做3个重复。批间重复实验:对上述3个批次标准样品,在同一反应条件下进行3次独立的荧光定量PCR检测。根据Ct算术平 均值计算CV,批内CV为0.88%~2.50%,批间CV为1.75%~3.31%。见表 2。
| 样本 | 批内重复实验 | 批间重复实验 | ||||||||||
| Ct 值 | CV(%) | Ct 值 | CV(%) | |||||||||
| 1 | 2 | 3 | x±s | 1 | 2 | 3 | x±s | |||||
| 5×106 | 21.84 | 21.94 | 20.96 | 21.58±0.54 | 2.50 | 21.45 | 21.79 | 21.00 | 21.41±0.40 | 1.85 | ||
| 5×105 | 26.69 | 26.75 | 26.26 | 26.57±0.27 | 1.01 | 25.85 | 25.88 | 24.41 | 25.38±0.84 | 3.31 | ||
| 5×104 | 30.05 | 29.55 | 29.66 | 29.75±0.26 | 0.88 | 30.27 | 30.79 | 29.73 | 30.26±0.53 | 1.75 | ||
2.4 荧光定量PCR的特异性
以合成的本迪布焦EBOV、科特迪瓦EBOV、莱斯顿EBOV、苏丹EBOV、马尔堡病毒、西尼罗河热病毒、东方马脑炎病毒、西方马脑炎病毒相应非编码区段重组质粒,及临床48例标本进行荧光定量PCR检测。以浓度为5×107、5×106拷贝/μL的质粒为阳性对照,再设阴性对照。结果见图 2,除ZEBOV阳性质粒有荧光响应起跳外,其余均无荧光起跳为阴性。
|
| A:8种相似病毒对照;B:粪便、痰液RNA检测对照;C:痰液DNA、咽拭子RNA检测对照 图 2 8种相似病毒及48例临床样本对照特异性扩增曲线 |
3 讨论
以往的EBOV核酸检测,大多针对保守糖蛋白或核蛋白作为靶向目标设计探针引物,且方法多为在GenBank上下载多条序列,进而设计通用引物和探针[13-15]。而本研究通过以2014年从西非患者分离的3株ZEBOV株及1976年从Mayinga分离的ZEBOV株全序列为目标,依托中国科学院计算技术研究所超级计算平台,运用相应软件采用同种求交异种求并的方法,得到特异性标签核酸序列[11]。最后选出一条非编码区序列设计成探针引物进行验证,探求一条创新路径。本研究对阳性质粒7个稀释度样品进行扩增,结果显示,起始浓度与Ct值之间具有良好的线性关系,标准曲线相关系数>0.99,表明阳性样品稀释准确且体系稳定高效。特异性检测中,48份临床标本及合成的8种病毒相关序列,仅阳性质粒样品为阳性,表明该探针特异性好。且本方法检测下限达到5×101拷贝,具有良好的灵敏性。
综上,本研究采用Insignia算法比对出核酸标签序列特异性强,设计TaqMan探针和引物建立的荧光定量PCR方法,灵敏度高、稳定性好,为ZEBOV的快速定性诊断提供了一种新方法,为EBOV病快速临床分子诊断研究提供了一种新的核酸探针区段选择思路。
| [1] | 刘阳, 马志永, 史子学, 等. 埃博拉出血热[J]. 中国人兽共患病学报,2011, 27 (11) : 1028 –1030. DOI:10.3969/j.issn.1002-2694.2011.11.019 |
| [2] | Wamala J F, Lukwago L, Malimbo M, et al. Ebola hemorrhagic fever associated with novel virus strain, Uganda, 2007- 2008[J]. Emerg Infect Dis,2010, 16 (7) : 1087 –1092. DOI:10.3201/eid1607.091525 |
| [3] | Diamond M S, Fremont D H. Ebola images emerge from the cave[J]. Cell Host Microbe,2008, 4 (2) : 87 –89. DOI:10.1016/j.chom.2008.07.011 |
| [4] | Bente D, Gren J, Strong J E, et al. Disease modeling for Ebola and Marburg viruses[J]. Dis Model Mech,2009, 2 (1/2) : 12 –17. DOI:10.1242/dmm.000471 |
| [5] | 饶贤才. 埃博拉病毒病之病原学[J]. 第三军医大学学报,2015, 37 (4) : 282 –286. DOI:10.16016/j.1000-5404.201501182 |
| [6] | Ksiazek T G, West C P, Rollin P E, et al. ELISA for the detection of antibodies to Ebola viruses[J]. J Infect Dis,1999, 179 (Suppl 1) : S192 –S198. |
| [7] | Geisbert T W, Bausch D G, Feldmann H. Prospects for immunisation against Marburg and Ebola viruses[J]. Rev Med Virol,2010, 20 (6) : 344 –357. DOI:10.1002/rmv.661 |
| [8] | 盖微微, 郑学星, 薛向红, 等. 埃博拉病毒检测与分型Real-time PCR方法的建立[J]. 中国病原生物学杂志,2013, 8 (3) : 208 –211. DOI:10.13350/j.cjpb.2013.03.001 |
| [9] | 刘阳, 史子学, 王水明, 等. 一步法MGB荧光定量RT-PCR检测埃博拉扎伊尔亚型和苏丹亚型方法的建立[J]. 中国人兽共患病学报,2012, 28 (4) : 343 –346. DOI:10.3969/j.issn.1002-2694.2012.04.008 |
| [10] | Baize S, Pannetier D, Oestereich L, et al. Emergence of Zaire Ebola virus disease in Guinea[J]. N Engl J Med,2014, 371 (15) : 1418 –1425. DOI:10.1056/NEJMoa1404505 |
| [11] | Phillippy A M, Mason J A, Ayanbule K, et al. Comprehensive DNA signature discovery and validation[J]. PLoS Comput Biol,2007, 3 (5) : e98 . |
| [12] | Kleines M, Schellenberg K, Ritter K. Efficient extraction of viral DNA and viral RNA by the Chemagic viral DNA/RNA kit allows sensitive detection of cytomegalovirus, hepatitis B virus, and hepatitis G virus by PCR[J]. J Clin Microbiol,2003, 41 (11) : 5273 –52741. |
| [13] | Leroy E M, Baize S, Lu C Y, et al. Diagnosis of Ebola haemorrhagic fever by RT-PCR in an epidemic setting[J]. J Med Virol,2000, 60 (4) : 463 –467. |
| [14] | Yang Z Y, Duckers H J, Sullivan N J, et al. Identification of the Ebola virus glycoprotein as the main viral determinant of vascular cell cytotoxicity and injury[J]. Nat Med,2000, 6 (8) : 886 –889. |
| [15] | 贾佳, 康晓平, 李裕昌, 等. 扎伊尔型、苏丹型埃博拉病毒TaqMan探针实时定量PCR核酸检测方法的建立[J]. 国际药学研究杂志,2015, 42 (1) : 80 –84. DOI:10.13220/j.cnki.jipr.2015.01.012 |



