2. 康复科
2. Department of Rehabilitation Medicine, Institute of Surgery Research, Daping Hospital, Third Military Medical University, Chongqing, 400042, China
脓毒症(sepsis)是由异常的系统性炎症反应引起的一种复杂的临床疾病。脓毒症过程凶险,治疗花费高,医疗资源消耗大,对人类健康和社会经济造成巨大威胁[1-4]。虽然脓毒症的治疗近年来有很大进展,但其病死率仍高达47%[5-6]。文献[7-9]对不同地区ICU患者研究统计发现脓毒症例数以每年1.5% ~8.0%的速度增加,每年全球约有500万人死于该病及其并发症。除肺损伤、消化道应激性溃疡等内脏器官损害外,骨骼也是脓毒症作用的重要靶器官。本室赵子瑜等[10]研究表明内毒素血症(endotoxemia)及脓毒症最主要的致病因子脂多糖(lipopolysaccharides,LPS)可使成年期小鼠的成骨细胞形态出现异常、成骨相关基因osteocalcin表达降低,骨细胞塌陷、凋亡,而破骨细胞数量增多、破骨细胞相关基因cathepsin K 的表达增高,出现骨质疏松,而增强成骨细胞功能可能改善脓毒症病程进展。Zhang等[11]研究发现新生儿重症监护病房(neonatal intensive care unit,NICU)的新生儿脓毒症患者血清骨代谢指标异常,且血清骨碱性磷酸酶(bone alkaline phosphatase,BALP)水平与患者罹患感染及疾病严重程度相关,但LPS对胚胎期骨骼的发育及矿化的作用及其机制尚不清楚。本实验借助体外器官培养这种模型,拟通过分离E18.5 d小鼠跖骨、胫骨并用LPS直接处理的方法来研究LPS对骨骼矿化和软骨生长的影响并探讨其初步机制,指导临床在积极对症治疗同时尽早采取干预措施保护新生儿脓毒症患者的骨骼系统功能少受损害。
1 材料与方法 1.1 实验动物SPF级C57BL/6J小鼠购自第三军医大学大坪医院野战外科研究所实验动物中心,体质量25~30 g,动物合格证号:SCXK(军)2012-0013。在12 h明/暗周期(7:00 AM~7:00 PM)下饲养,室温23~25 ℃,相对湿度60%~80%,投喂小鼠专用饮水和饲料条件下自由进食。所有实验动物的取材操作严格按照第三军医大学实验动物管理委员会许可[执行标准SYXK(军2002032)]进行,符合动物实验的伦理要求。
1.2 主要器材紫外线消毒车(上海跃进医用光学器械厂),超净工作台(中国苏净公司),二氧化碳恒温培养箱(德国Thermo公司),体视显微镜及拍摄系统(日本Olympus公司),显微镊(上海医疗器械有限公司手术器械厂),24孔板(德国Eppendorf公司),移液器(德国Eppendorf公司)。
1.3 主要试剂LPS(美国Sigma公司),BGJb培养基(美国Gibco公司),胎牛血清(美国HyClone 公司),DPBS粉末(美 国HyClone公司),青、链霉素(美国HyClone公司),BSA (美国HyClone公司),Vc(美国Sigma 公司),Ⅱ型胶原(collagenⅡ,ColⅡ)、Ⅹ型胶原(collagen Ⅹ,ColⅩ)抗体(美国Chondrex公司),免疫组化试剂盒(北京中杉金桥公司),TUNEL凋亡试剂盒(美国Roche公司)。
1.4 跖骨、胫骨的分离与培养体视显微镜下分离E18.5 d小鼠跖骨、胫骨。用含抗生素的DPBS 漂洗 2次,放入加有培养基的24孔板培养。将跖骨和胫骨分为LPS组和Blank组,LPS组在第1天照相后换含有10 μg/mL LPS的培养液。
1.5 跖骨、胫骨的观察及统计分析体视显微镜放大倍数调至12.5倍分别调明、暗背景拍照。Image Pro Plus软件测量第1、7天跖骨、胫骨全长及矿化带长度。计算TL-rate、CZ-rate、CZ%。增长率=[(体外培养7D的长度-体外培养1D的长度)/体外培养1D的长度]×100%[12]。CZ%=矿化带长度/总长度。胫骨切片染色及肥大带形态计量。
1.6 免疫组化染色检测ColⅡ、ColⅩ标本常规脱蜡、复水、封闭、抗原修复,将一抗 ColⅡ、ColⅩ用抗体稀释液以1 ∶300比例稀释备用。后续步骤参考中杉金桥生物素-链霉卵白素免疫组化检测试剂盒说明书。最后用苏木精复染,中性树胶封片。
1.7 TUNEL检测凋亡标本常规脱蜡、复水、细胞通透,后续步骤参考罗氏TUNEL细胞凋亡检测试剂盒说明书。
1.8 统计学分析实验数据用SPSS 18.0统计软件进行处理,所有数据以x±s表示,两组间差异显著性检验采用独立样本t检验。
2 结果 2.1 LPS抑制胚胎期跖骨和胫骨的生长及矿化跖骨、胫骨培养过程中未见营养不良、污染等情况,形态正常,未见明显弯曲(图 1、2)。Image Pro Plus软件测量培养第1、7天胫骨、跖骨全长及矿化带长度,计算TL-rate、CZ-rate、CZ%(图 3)。结果表明LPS组跖骨、胫骨TL-rate、CZ-rate均显著低于Blank组(跖骨TL-rate P=0.025;跖骨CZ-rate P=0.019;胫骨TL-rate P=0.010;胫骨CZ-rate P=0.024),而跖骨、胫骨的LPS组和Blank组间CZ%差异无统计学意义(跖骨CZ% P=0.255;胫骨CZ% P=0.105)。
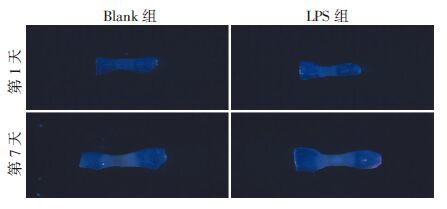
|
| 图 1 体视显微镜观察跖骨培养结果(×12.5) |
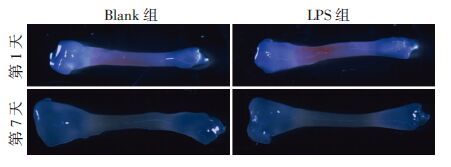
|
| 图 2 体视显微镜观察胫骨培养结果(×12.5) |
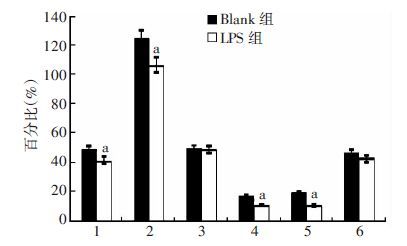
|
| 1:跖骨TL-rate;2:跖骨CZ-rate;3:跖骨CZ%;4:胫骨TL-rate;5:胫骨CZ-rate;6:胫骨CZ%;a:P <0.05,与Blank组比较 图 3 跖骨、胫骨矿化带增长率、全长增长率及矿化带占全长的比例变化 |
2.2 LPS抑制胚胎期胫骨肥大带宽度
培养7 d后胫骨脱水包埋后给予臧红固绿和甲苯胺蓝染色。可见LPS组肥大带较Blank组明显变短(图 4),进一步使用Image Pro Plus软件测量肥大带宽度并进行统计学分析,发现LPS组胫骨的肥大带宽度显著小于Blank组胫骨肥大带宽度[(270.34±15.251)μm vs(417.351±8.078)μm,P <0.01]。

|
| A、C:Blank组;B、D:LPS组;A、B:臧红固绿染色;C、D:甲苯胺蓝染色 图 4 光学显微镜观察胫骨肥大带宽度变化(×40) |
2.3 LPS下调胚胎期胫骨ColⅡ、ColⅩ蛋白表达
免疫组化检测培养7 d后胫骨ColⅡ及ColⅩ表达变化,发现Blank组ColⅡ均匀表达于整个胫骨头,LPS组ColⅡ的表达低于Blank组(图 5)。与此趋势类似,免疫组化结果显示LPS组ColⅩ的表达降低(图 6)。
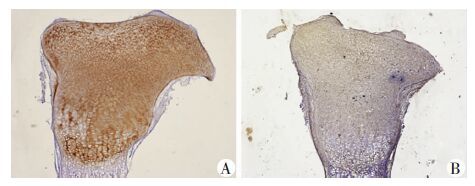
|
| A:Blank组;B:LPS组 图 5 光学显微镜观察胫骨ColⅡ表达情况(×40) |

|
| A:Blank组;B:LPS组 图 6 光学显微镜观察胫骨ColⅩ表达情况(×40) |
2.4 LPS促进胚胎期胫骨肥大带软骨细胞凋亡
TUNEL检测培养7 d后胫骨肥大带软骨细胞凋亡情况(图 7)。TUNEL法的凋亡信号为绿色且定位于细胞核周围呈带状或团块。Blank组凋亡阳性信号细胞数量几乎没有,LPS组凋亡信号明显增加。

|
| A:Blank组;B:LPS组 LPS处理后肥大带区域凋亡信号显著增多,白色箭头示绿色荧光为肥大带区域的凋亡信号,未用箭头指出的绿色荧光为假阳性凋亡信号或不在肥大带区域的凋亡信号 图 7 荧光显微镜观察胫骨肥大带凋亡情况(×100) |
3 讨论
骨骼是人体的重要器官,具有运动、保护内脏器官、贮存矿物质等功能。近年来发现骨骼除了上述功能外,也参与机体的能量代谢,可调节免疫系统、造血系统、生殖及认知系统,在多种病理生理情况下发挥重要作用[13-16]。既往发现LPS可抑制成年期骨形成、促进骨吸收,但对胚胎期骨骼发育的作用尚不明确。本实验利用LPS处理胚胎期骨组织的这种可行性高、适用范围广泛的体外实验方法成功模拟了LPS对于骨骼的作用及不良影响。与细胞实验相比,体外器官培养并干预的模型更能反映器官、组织的整体变化,方便采取不同的干预措施,同时可作为后续动物实验的基础。经过LPS处理后的跖骨和胫骨的全长增长率、矿化带增长率下降,提示LPS对骨骼纵向生长产生了明显的抑制作用。Chua等[17]研究发现LPS刺激孕鼠致子代体质量和顶臀长低于对照组,易出现出生缺陷,而怀孕期间饮食补充锌有利于确保子代生长发育,预防出生缺陷。Xu 等[18]研究发现LPS刺激孕鼠可导致仔鼠骨骼生长迟缓,尾椎和跖骨的骨化中心出现延迟。可见LPS对处于生长发育时期的骨骼系统确实产生了一系列不良影响。
骨骼发育主要包括软骨内成骨和膜内成骨,而长骨生长主要是软骨内成骨,因此接下来我们检测了软骨的增生、分化及凋亡。通过计算TL-rate、CZ-rate、CZ%及统计学分析我们明确了LPS可抑制肥大带增生。ColⅡ是软骨分化标志物,主要在软骨细胞基质中表达,可作为软骨分化功能鉴定的主要指标。ColⅩ是软骨细胞钙化细胞外基质及启动软骨内成骨的关键蛋白。本实验通过免疫组化染色检测ColⅡ、ColⅩ表达情况,结果显示LPS处理后的胫骨标本的ColⅡ、ColⅩ表达明显下调,可能导致软骨内成骨这一过程受到抑制而影响了跖骨和胫骨的纵向生长,与Tan等[19]发现LPS通过TLR4激活固有免疫细胞而产生的促炎细胞因子IL-1β下调软骨细胞ColⅡ表达从而促进软骨损耗的结果一致。凋亡是程序性细胞死亡(programmed cell death,PCD)的一种,是细胞自发的死亡机制,受多种细胞信号通路调控。有研究表明LPS处理软骨细胞能促进基质金属蛋白酶(MMPs)的合成,诱导软骨基质降解,抑制软骨细胞增殖和蛋白聚糖合成,刺激细胞因子的生成,产生大量NO,NF-κB通路被激活、从而促进软骨细胞凋亡[20]。我们用TUNEL检测凋亡,结果表明LPS处理后肥大带软骨细胞的凋亡信号明显增加。Campo等[21]也通过LPS处理软骨细胞得出LPS可引起软骨细胞DNA链断裂、促使细胞凋亡的结论。
综上所述,LPS刺激可对骨组织的纵向生长产生明显抑制作用,其机制可能是LPS诱导的促炎因子通过下调ColⅡ、ColⅩ的表达抑制软骨内成骨这一过程,同时促进肥大带软骨细胞的凋亡使肥大带变短,最终抑制骨骼纵向生长。因此,对于处于发育关键时期的重症感染患者,我们除了对症治疗外还应积极采取措施保障其骨骼的正常生长发育。
| [1] | 周红, 刘鑫, 郑江. 脓毒症治疗——挑战与机遇并存[J]. 第三军医大学学报,2013, 35 (2) : 91 –94. DOI:10.16016/j.1000-5404.2013.02.027 |
| [2] | 吴燕燕, 赵金川, 鲁力. 连续性高容量血液滤过对脓毒症合并重度急性呼吸窘迫综合征的疗效分析[J]. 第三军医大学学报,2015, 37 (17) : 1782 –1786. DOI:10.16016/j.1000-5404.201503161 |
| [3] | 田洪居, 姜燕, 李建英, 等. 动静脉二氧化碳分压差/氧含量差值在重症脓毒症及休克患者复苏中的意义[J]. 第三军医大学学报,2015, 37 (14) : 1482 –1485. DOI:10.16016/j.1000-5404.201410195 |
| [4] | 刘占国, 谭晓莹, 蔡靓, 等. 脓毒症患者危重程度与血清IL-6的相关性分析[J]. 第三军医大学学报,2012, 34 (21) : 2233 . DOI:10.16016/j.1000-5404.2012.21.030 |
| [5] | Majka M, Kijowski J, Lesko E, et al. Evidence that platelet-derived microvesicles may transfer platelet-specific immunoreactive antigens to the surface of endothelial cells and CD34+ hematopoietic stem/progenitor cells--implication for the pathogenesis of immune thrombocytopenias[J]. Folia Histochem Cytobiol,2007, 45 (1) : 27 –32. |
| [6] | Liu L J, Curjuric I, Keidel D, et al. Characterization of source-specific air pollution exposure for a large population-based Swiss cohort (SAPALDIA)[J]. Environ Health Perspect,2007, 115 (11) : 1638 –1645. DOI:10.1289/ehp.10177 |
| [7] | Alberti C, Brun-Buisson C, Burchardi H, et al. Epidemiology of sepsis and infection in ICU patients from an international multicentre cohort study[J]. Intensive Care Med,2002, 28 (2) : 108 –121. DOI:10.1007/s00134-001-1143-z |
| [8] | Skrupky L P, Kerby P W, Hotchkiss R S. Advances in the management of sepsis and the understanding of key immunologic defects[J]. Anesthesiology,2011, 115 (6) : 1349 –1362. DOI:10.1097/ALN.0b013e31823422e8 |
| [9] | Angus D C, Pereira C A, Silva E. Epidemiology of severe sepsis around the world[J]. Endocr Metab Immune Disord Drug Targets,2006, 6 (2) : 207 –212. |
| [10] | 赵子瑜, 杨京, 谢杨丽, 等. 全身应急情况下骨骼的变化及意义[J]. 解放军医学杂志,2008, 33 (7) : 203 –207. |
| [11] | Zhang Y, Su N, Luo F, et al. Deletion of Fgfr1 in osteoblasts enhances mobilization of EPCs into peripheral blood in a mouse endotoxemia model[J]. Int J Biol Sci,2014, 10 (9) : 1064 –1071. DOI:10.7150/ijbs.8415 |
| [12] | Xie Y, Su N, Jin M, et al. Intermittent PTH (1-34) injection rescues the retarded skeletal development and postnatal lethality of mice mimicking human achondroplasia and thanatophoric dysplasia[J]. Hum Mol Genet,2012, 21 (18) : 3941 –3955. |
| [13] | Porter R L, Calvi L M. Communications between bone cells and hematopoietic stem cells[J]. Arch Biochem Biophys,2008, 473 (2) : 193 –200. DOI:10.1016/j.abb.2008.04.001 |
| [14] | Nakashima T, Takayanagi H. The dynamic interplay between osteoclasts and the immune system[J]. Arch Biochem Biophys,2008, 473 (2) : 166 –171. DOI:10.1016/j.abb.2008.04.004 |
| [15] | Caetano-Lopes J, Canhao H, Fonseca J E. Osteoimmunology—the hidden immune regulation of bone[J]. Autoimmun Rev,2009, 8 (3) : 250 –255. DOI:10.1016/j.autrev.2008.07.038 |
| [16] | Lee N K, Sowa H, Hinoi E, et al. Endocrine regulation of energy metabolism by the skeleton[J]. Cell,2007 (3) : 456 –469. DOI:10.1016/j.cell.2007.05.047 |
| [17] | Chua J S, Rofe A M, Coyle P. Dietary zinc supplementation ameliorates LPS-induced teratogenicity in mice[J]. Pediatr Res,2006, 59 (3) : 355 –358. DOI:10.1203/01.pdr.0000199906.37619.9c |
| [18] | Xu D X, Chen Y H, Zhao L, et al. Reactive oxygen species are involved in lipopolysaccharide-induced intrauterine growth restriction and skeletal development retardation in mice[J]. Am J Obstet Gynecol,2006, 195 (6) : 1707 –1714. DOI:10.1016/j.ajog.2006.03.047 |
| [19] | Tan L, Peng H, Osaki M, et al. Egr-1 mediates transcriptional repression of COL2A1 promoter activity by interleukin-1beta[J]. J Biol Chem,2003, 278 (20) : 17688 –17700. DOI:10.1074/jbc.M301676200 |
| [20] | Chang C H, Hsu Y M, Chen Y C, et al. Anti-inflammatory effects of hydrophilic and lipophilic statins with hyaluronic acid against LPS-induced inflammation in porcine articular chondrocytes[J]. J Orthop Res,2014, 32 (4) : 557 –565. DOI:10.1002/jor.22536 |
| [21] | Campo G M, Avenoso A, Campo S, et al. Glycosaminoglycans modulate inflammation and apoptosis in LPS-treated chondrocytes[J]. J Cell Biochem,2009, 106 (1) : 83 –92. DOI:10.1002/jcb.21981 |



