逼尿肌活动低下(detrusor underactive,DU)是临床常见的膀胱功能障碍性疾病,严重影响患者的生活质量,病理生理机制不清楚[1]。Cajal间质细胞(interstitial cells of Cajal, ICCs)是一种首先发现于胃肠道的特殊间质细胞。ICCs细胞的增殖分化及其功能维持与其表面的c-kit受体激活密切相关,c-kit受体激活依赖于其配体干细胞因子(stem cell factor, SCF)[2]。因此,SCF对于ICCs的增殖分化及其功能维持具有重要作用[3-4]。研究表明,ICCs在胃肠道具有起搏作用[5], 且其表达改变可以导致ICCs数改变,进而导致胃肠道动力功能紊乱[6]。在泌尿道,ICCs已经被证实存在于肾盂、输尿管组织中并发挥起搏作用[7-8]。目前,ICCs在膀胱中的存在也已被证实[9-10],其与膀胱功能障碍性疾病的关系研究正逐渐成为研究的热点。膀胱过度活动症是一种常见的膀胱功能障碍性疾病,研究发现其发生与ICCs数增加关系密切[11-12]。逼尿肌活动低下是一种与逼尿肌过度活动症相反的膀胱功能障碍性疾病,但其与ICCs的关系目前研究较少。我们推测,逼尿肌活动低下的发生可能与SCF介导的ICCs表达改变密切相关。为证实此推测,本研究观察DU逼尿肌中ICCs的表达改变,并进一步分析外源性SCF对ICCs表达及逼尿肌收缩力的影响。
1 材料与方法 1.1 实验动物及分组雌性Sprague-Dawley(SD)大鼠50只,2月龄,体质量190~220 g,购自第三军医大学实验动物中心(动物批准号:SYXK-PLA-20120031),清洁级条件下饲养。近端尿道结扎法制作膀胱出口梗阻(bladder outlet obstruction, BOO)大鼠动物模型[13]。8周后行膀胱充盈性测压,筛选出DU动物模型。实验分为3组:对照组、DU组、DU+SCF组,每组18只。给药方法:将SCF以PBS进行稀释,按照0.2 μg/(kg·d)对18只DU大鼠进行腹腔注射,对照组及DU组以等量的PBS进行处理。2周后行膀胱充盈性测压观察膀胱功能改变,然后腹腔内注射3%戊巴比妥钠(100 mg/kg)处死大鼠,收集膀胱标本,检测各组逼尿肌组织中ICCs数、c-kit及SCF的表达,体外肌条实验检测逼尿肌收缩力的改变。
1.2 免疫组织荧光化学法检测逼尿肌组织中ICCs的表达大鼠处死后,经尿道注入4%多聚甲醛至膀胱明显膨胀,快速结扎近端尿道及双侧输尿管后将膨胀的膀胱完整取出置于4%多聚甲醛21 ℃放置约30 min,置于0.1 mol/L PBS中21 ℃过夜。第2天于膀胱侧壁剪取大小约4 mm×4 mm的组织片,剥离黏膜层及浆膜层后置于1% BSA室温放置封闭1 h,置于羊抗大鼠一抗中(1 ∶100)4 ℃孵育24 h,再加入兔抗羊荧光标记二抗室温孵育1 h。以0.01 mol/L PBS漂洗2 h后置于载玻片上用激光共聚焦显微镜观察c-kit阳性细胞表达情况。每个标本取5个随机视野,由观察者在不清楚组别的情况下计数c-kit阳性细胞数。
1.3 ELISA检测血清中SCF表达在大鼠处死前取2 mL血液样本,应用ELISA试剂盒按照说明书检测血清SCF浓度。SCF标准曲线根据已知的SCF浓度制作,每个样本的血清SCF浓度根据标准曲线进行计算得出。
1.4 Western blot检测逼尿肌组织中c-kit以及SCF的表达取大约25 mg逼尿肌组织标本,常规提取总蛋白质并测定浓度。取各组总蛋白50 μg进行SDS-PAGE电泳,电转移至硝酸纤维素膜,以5%脱脂奶粉-PBS室温封闭2 h后加入一抗,包括SCF(1 ∶200)、c-kit(1 ∶100)以及GAPDH(1 ∶500)。室温放置半小时,然后4 ℃过夜,PBST洗涤3次,加入辣根过氧化物酶标记的二抗(1 ∶500),37 ℃孵育1 h,PBST洗涤3次,DAB染色,适时终止,光密度扫描,Quantity One图像分析系统分析显色条带。相关蛋白表达采用目标条带与GAPDH条带的光密度比值表示。
1.5 半定量RT-PCR检测逼尿肌组织中c-kit以及SCF的表达取膀胱侧壁组织约30 mg,常规提取组织总RNA并进行定量,凝胶电泳检测总RNA完整性。取各组总RNA各2 μg作为模板进行逆转录。设计扩增用c-kit正义链:5′-TGCCGGTCGATTCCAAGTTT-3′, 反义链:5′-GCCGACGGAATTGACCCTC-3′,目的片段为269 bp。SCF正义链:5′-CCTGCAATATGAAGCCCCAAGAC-3′, 反义链:5′-GGTGCCCTCCTGCTACTTTTAC-3′,目的片段为166 bp。GAPDH正义链:5′-CCGCCCCTTCCGCTGATG-3′, 反义链:5′-CCGCCTGCTTCACCACCTTCTT-3′,目的片段为432 bp。循环参数:94 ℃ 5 min,94 ℃ 30 s,56 ℃ 1 min,68 ℃ 2 min,共30个循环, 68 ℃ 7 min。反应结束后行2%琼脂糖凝胶电泳, 采用Quantity One图像分析系统分析计算曲线下面积, 以目标条带与GAPDH光密度比值表示相关基因相对表达水平。
1.6 体外肌条实验检测逼尿肌收缩功能快速处死大鼠后于膀胱侧壁取大小约7 mm×2 mm肌条组织,置于通以95% O2和5% CO2 37 ℃内含5 mL Kreb’溶液(pH 7.4)的器官槽中,肌条两端纵向置于两个金属钩之间,上端通过张力传感器与生物实验数据收集系统相连接。肌条在器官槽内平衡约30 min后开始记录等张收缩情况,初始张力为0.3 g。收缩波的幅度为其基底至其波峰的高度,收缩频率取其每5分钟收缩次数的平均值。
1.7 统计学方法采用SPSS 19.0统计软件,计量资料以±s表示,两样本均数比较采用独立样本t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 膀胱充盈性测压检测膀胱收缩功能DU组膀胱排尿收缩幅度[(12.3±1.4)cmH2O]及排尿收缩频率[(0.56±0.04)次/min]较对照组膀胱排尿收缩幅度[(24.8±2.6)cmH2O]及排尿收缩频率[(0.82±0.07)次/min]显著降低(P < 0.05),膀胱活动明显低下。加入外源性SCF后,DU+SCF组膀胱排尿收缩幅度[(21.6±1.9)cmH2O]及排尿收缩频率[(0.73±0.06)次/min]较DU组显著增强(P < 0.05,图 1),提示外源性SCF可以显著改善活动低下逼尿肌的收缩功能。
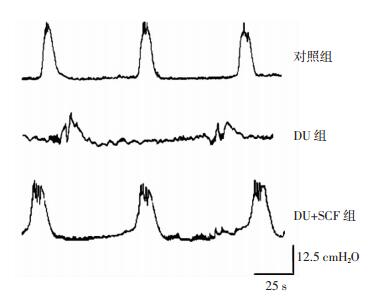
|
| 图 1 膀胱充盈性测压检测膀胱收缩功能 |
2.2 ELISA检测血清中SCF水平
DU组大鼠血清SCF水平为(206.1±14.1)ng/L,较对照组[(390.8±19.8)ng/L]降低(P < 0.05)。加入外源性SCF后,DU+SCF组大鼠血清SCF水平[(387.5±17.9)ng/L]显著提升(P < 0.05),提示外源性SCF可以显著恢复DU大鼠血清SCF水平。
2.3 免疫组织荧光化学法检测ICCs数典型的梭形ICCs细胞广泛分布于膀胱黏膜下层以及肌层。DU组大鼠膀胱黏膜下层ICCs数(4.1±0.3)较对照组(12.3±1.1)显著减少(P < 0.05),肌层ICCs数(3.7±0.2)较对照组(10.93±0.9)亦显著减少(P < 0.05)。加入外源性SCF后,DU+SCF组黏膜下层(6.8±0.5)及肌层(5.9±0.4)ICCs数较DU组显著提升(P < 0.05, 图 2),提示外源性SCF可以显著恢复活动低下逼尿肌组织中的ICCs数。
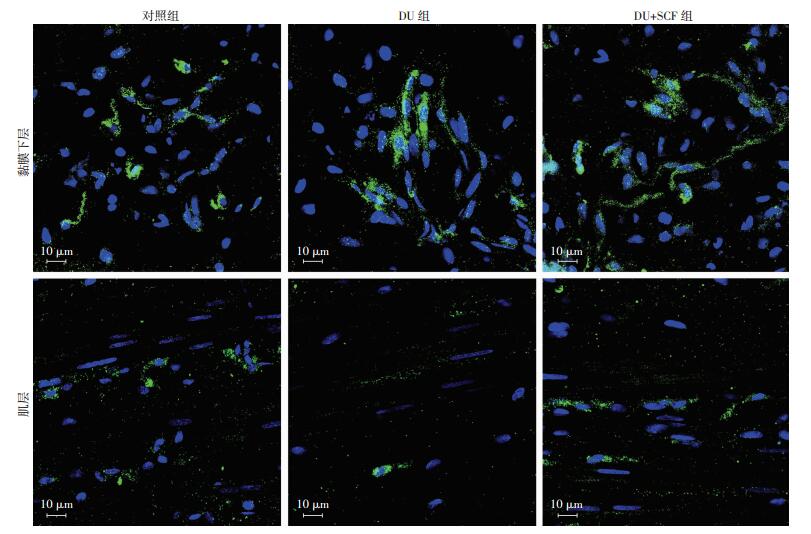
|
| 蓝色为细胞核,绿色为ICCs 图 2 ICCs激光共聚焦成像观察 |
2.4 Western blot检测SCF及c-kit蛋白水平
DU组SCF蛋白水平(0.43±0.03)较对照组(0.88±0.07)显著降低(P < 0.05);c-kit蛋白水平(0.37±0.03)亦较对照组(0.90±0.08)显著降低(P < 0.05)。加入外源性SCF后,DU+SCF组SCF(0.79±0.07)及c-kit(0.81±0.07)蛋白水平较DU组均显著提高(P < 0.05),提示外源性SCF可以显著恢复DU膀胱中SCF以及c-kit蛋白水平(图 3)。

|
| 1:对照组;2:DU组;3:DU+SCF组 图 3 Western blot检测SCF及c-kit蛋白表达 |
2.5 半定量RT-PCR检测SCF及c-kit基因表达
DU组SCF mRNA (0.21±0.01)较对照组(0.91±0.07)显著降低(P < 0.05); DU组c-kit mRNA (0.34±0.02)较对照组(0.92±0.08)亦显著降低(P < 0.05)。加入外源性SCF后,DU+SCF组SCF mRNA(0.52±0.04)及c-kit mRNA(0.73±0.05)较DU组均显著提高(P < 0.05),提示外源性SCF可以显著恢复DU膀胱中SCF及c-kit基因表达水平(图 4)。

|
| M:标准;1:DU+SCF组;2:DU组;3:对照组 图 4 RT-PCR检测SCF(A)及c-kit(B) mRNA表达水平 |
2.6 体外肌条收缩实验检测逼尿肌收缩能力
DU组大鼠逼尿肌收缩幅度[(0.09±0.01)g]较对照组[(0.22±0.02)g]显著降低(P < 0.05);收缩频率[(1.61±0.01)次/min]较对照组[(2.92±0.02)次/min]亦显著降低(P < 0.05);加入外源性SCF后,DU+SCF组逼尿肌条收缩幅度[(0.18±0.01)g]及频率[(2.78±0.02)次/min]较DU组均显著提高(P < 0.05),提示外源性SCF可以显著恢复活动低下逼尿肌的收缩能力(图 5)。

|
| 图 5 肌条实验检测逼尿肌收缩能力 |
3 讨论
大鼠膀胱出口梗阻动物模型为研究膀胱功能障碍的发生机制提供了良好的平台。既往研究发现膀胱出口部分梗阻可以导致膀胱过度活动[14-15]。本研究发现,膀胱出口部分梗阻较长时间后膀胱逼尿肌出现收缩幅度及频率的显著降低,提示出现DU。既往研究多集中于膀胱过度活动,对DU关注较少。近年DU发病率逐渐升高,引起人们的重视,其病理生理机制研究逐渐成为新的热点领域。
ICCs是一种广泛存在于多种平滑肌器官的间质细胞,与多种器官功能障碍性疾病的发生密切相关。我们前期研究发现,梗阻6周后膀胱逼尿肌功能活动明显增强,逼尿肌ICCs数显著增加[13],与Kim等[16]的研究结果一致,提示ICCs与逼尿肌功能活动改变密切相关,为研究DU提供了新的切入点,即DU的发生可能与逼尿肌组织内ICCs的改变有关。
本研究表明,活动低下逼尿肌组织中黏膜下层及肌肉层ICCs数均显著降低,但导致ICCs数改变的病理生理机制不清楚。c-kit是存在于ICCs表面的一种酪氨酸激酶受体,其天然配体是SCF[17]。ICCs的分化和增殖有赖于c-kit和SCF的结合[4-5]。研究表明,ICCs细胞数的减少并不是由于细胞死亡造成的,而是由于ICCs细胞表型再分化导致[3],而这可能与SCF有密切关系。Lin等[6]研究发现,糖尿病小鼠结肠中ICCs细胞减少与SCF减少关系密切。本研究结果显示,DU膀胱中SCF及c-kit表达均显著减少,伴随逼尿肌收缩功能减弱,提示SCF可能影响ICCs的增殖分化,进而导致逼尿肌出现动力功能障碍。
虽有很多研究提示ICCs数减少可以导致脏器功能受损,但对于如何逆转或修复这种损伤目前尚不清楚。Nakahara等[18]进行体外细胞实验证实ICCs表现出对于SCF剂量依赖及时间限制的增殖应答反应。研究证实,外源性SCF可以通过SCF/c-kit途径促进ICCs细胞数及功能恢复,且高浓度的SCF作用更强[19]。本研究亦证实,外源性SCF可以一定程度上提高受损逼尿肌中c-kit的表达,增加ICCs数,进而部分恢复受损逼尿肌的收缩能力。这些结果提示,ICCs数及功能改变可以通过外源性SCF/c-kit途径对其加以调控,通过局部应用外源性SCF可以改善由于ICCs改变导致的脏器功能受损状况,为给包括DU在内的器官功能障碍性疾病研究提供方向。
| [1] | Aggarwal H, Zimmern P E. Underactive Bladder[J]. Curr Urol Rep,2016, 17 (3) : 17 . DOI:10.1007/s11934-016-0582-6 |
| [2] | Lorincz A, Redelman D, Horvath V J, et al. Progenitors of interstitial cells of cajal in the postnatal murine stomach[J]. Gastroenterology,2008, 134 (4) : 1083 –1093. DOI:10.1053/j.gastro.2008.01.036 |
| [3] | Torihashi S, Nishi K, Tokutomi Y, et al. Blockade of kit signaling induces transdifferentiation of interstitial cells of cajal to a smooth muscle phenotype[J]. Gastroenterology,1999, 117 (1) : 140 –148. DOI:10.1016/S0016-5085(99)70560-3 |
| [4] | Wu J J, Rothman T P, Gershon M D. Development of the interstitial cell of Cajal: origin, kit dependence and neuronal and nonneuronal sources of kit ligand[J]. J Neurosci Res,2000, 59 (3) : 384 –401. DOI:10.1002/(SICI)1097-4547(20000201) |
| [5] | Thomsen L, Robinson T L, Lee J C, et al. Interstitial cells of Cajal generate a rhythmic pacemaker current[J]. Nat Med,1998, 4 (7) : 848 –851. DOI:10.1038/nm0798-848 |
| [6] | Lin L, Xu L M, Zhang W, et al. Roles of stem cell factor on the depletion of interstitial cells of Cajal in the colon of diabetic mice[J]. Am J Physiol Gastrointest Liver Physiol,2010, 298 (2) : G241 –G247. DOI:10.1152/ajpgi.90706.2008 |
| [7] | Pezzone M A, Watkins S C, Alber S M, et al. Identification of c-kit-positive cells in the mouse ureter: the interstitial cells of Cajal of the urinary tract[J]. Am J Physiol Renal Physiol,2003, 284 (5) : F925 –F929. DOI:10.1152/ajprenal.00138.2002 |
| [8] | Yang X, Zhang Y, Hu J. The expression of Cajal cells at the obstruction site of congenital pelviureteric junction obstruction and quantitative image analysis[J]. J Pediatr Surg,2009, 44 (12) : 2339 –2342. DOI:10.1016/j.jpedsurg.2009.07.061 |
| [9] | Gevaert T, Vanstreels E, Daelemans D, et al. Identification of different phenotypes of interstitial cells in the upper and deep lamina propria of the human bladder dome[J]. J Urol,2014, 192 (5) : 1555 –1563. DOI:10.1016/j.juro.2014.05.096 |
| [10] | Davidson R A, McCloskey K D. Morphology and localization of interstitial cells in the guinea-pig bladder: structural relationships with smooth muslce and neurons[J]. J Urol,2005, 173 (4) : 1385 –1390. DOI:10.1097/01.ju.0000146272.80848.37 |
| [11] | Kim S O, Song S H, Ahn K Y, et al. Distribution of interstitial cells of cajal in menopausal rat urinary bladder showing detrusor overactivity[J]. Int Neurourol J,2010, 14 (1) : 48 –53. DOI:10.5213/inj.2010.14.1.48 |
| [12] | Kubota Y, Kojima Y, Shibata Y, et al. Role of KIT-Positive Interstitial Cells of Cajal in the Urinary Bladder and Possible Therapeutic Target for Overactive Bladder[J]. Adv Urol,2011, 2011 : 816342 . DOI:10.1155/2011/816342 |
| [13] | Wang Y, Fang Q, Lu Y, et al. Effects of mechanical stretch on interstitial cells of Cajal in guinea pig bladder[J]. J Surg Res,2010, 164 (1) : e213 –e219. DOI:10.1016/j.jss.2010.04.040 |
| [14] | 封建立, 孙道冬, 蒙明森, 等. 膀胱出口梗阻对逼尿肌收缩力的影响及其与神经支配的关系[J]. 第三军医大学学报,2014, 36 (13) : 1433 –1436. DOI:10.16016/j.1000-5404.2014.13.021 |
| [15] | 封建立, 李龙坤, 杨景, 等. 不稳定逼尿肌中ICCs细胞与逼尿肌收缩的关系[J]. 第三军医大学学报,2008, 30 (10) : 894 –896. DOI:10.16016/j.1000-5404.2008.10.017 |
| [16] | Kim S O, Oh B S, Chang I Y, et al. Distribution of interstitial cells of Cajal and expression of nitric oxide synthase after experimental bladder outlet obstruction in a rat model of bladder overactivity[J]. Neurourol Urodyn,2011, 30 (8) : 1639 –1645. DOI:10.1002/nau.21144 |
| [17] | Nishimura M, Koda K, Oda K, et al. Mesenteric transection decreases expression of interstitial cells of Cajal in an experimental model[J]. Br J Surg,2007, 94 (4) : 483 –490. DOI:10.1002/bjs.5529 |
| [18] | Nakahara M, Isozaki K, Vanderwinden J M, et al. Dose-dependent and time-limited proliferation of cultured murine interstitial cells of Cajal in response to stem cell factor[J]. Life Sci,2002, 70 (20) : 2367 –2376. DOI:10.1016/S0024-3205(02)01517-5 |
| [19] | Tong W, Jia H, Zhang L, et al. Exogenous stem cell factor improves interstitial cells of Cajal restoration after blockade of c-kit signaling pathway[J]. Scand J Gastroenterol,2010, 45 (7/8) : 844 –851. DOI:10.3109/00365521003782371 |



