2. 400038 重庆,第三军医大学西南医院医学检验系临床微生物及免疫学教研室
2. Department of Clinical Microbiology and Immunology, Faculty of Medical Laboratory Sciences, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
鼻疽伯克霍尔德菌(Burkholderia mallei)和类鼻疽伯克霍尔德菌(Burkholderia pseudomallei)都是公认的经典生物战剂[1-2],分别引起人和动物的鼻疽病(glanders)和类鼻疽(melioidosis)。虽然鼻疽和类鼻疽流行病学不同,但是它们引起的病理变化相似,临床上需要进行鉴别诊断。细菌分离培养是诊断鼻疽和类鼻疽的“金标准”,但是需要一定的培养和鉴定时间,容易错过最佳治疗时机,且准确率还有待提高[3]。免疫学方法常用的ELISA检测类鼻疽伯克霍尔德菌特异性抗体,在疾病流行区域往往没有太大的诊断意义,因为疫区人群中的抗体阳性率很高,但并没有保护作用[4],而且在类鼻疽急性病程的早期往往检测不到血液中的抗体[5]。同时类鼻疽伯克霍尔德菌抗原与鼻疽伯克霍尔德菌和其他假单胞菌存在共同抗原,抗体的特异性较差。采用常规PCR检测类鼻疽伯克霍尔德菌,存在操作步骤多、易污染,目前还不能直接检测临床标本等缺点[6]。
《伯杰细菌鉴定手册》第9版将鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌均归属于假单胞菌属的RNA Ⅱ群(pseudomonas RNA group Ⅱ)。1993年,根据16S rRNA序列分析、DNA同源性、细胞类脂及脂肪酸组成等特征的研究结果,将假单胞菌属的RNA Ⅱ群归为伯克霍尔德菌属(Burkholderia)[7]。鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌之间的遗传结构和免疫学特征有着惊人的相似性,在已知的一些相应基因或DNA区段内,DNA序列高度同源,甚至完全相同。在免疫学诊断上,这两者间有着极其高的交叉反应,这在同属不同种的病原细菌中是极为罕见的。因此,对这两种细菌的区别鉴定一直是个难点。我们期望通过对细菌DNA及其编码蛋白的比较,发现细菌种间特异性DNA和特征性蛋白,建立更有效的具有临床和分子生物学研究价值的细菌检测方法。
研究发现,尽管鼻疽菌是无鞭毛、不能运动的,但其却具有完整的fliP基因。将鼻疽菌和类鼻疽菌的fliP基因进行比对分析,发现鼻疽菌fliP基因的第235位发生基因重组,导致一个60 kb的DNA序列被插入fliP基因的编码区。经证实,fliP基因发生的这个基因重组在鼻疽菌中是高度保守的,并具有特异性,而在类鼻疽菌中并不能检测到这个基因重组的插入片段[8]。Ⅲ型分泌系统(type three secretion system,TTS)是类鼻疽菌感染诊断和预防的重要靶标,其基因是类鼻疽菌的高度保守序列[5]。类鼻疽菌基因组中含有两套TTS系统,其中第一套TTS基因簇(TTS1)的出现与阿拉伯糖同化阴性表型以及强致病性有关,是类鼻疽菌特异的基因标记。
本研究分别采用基于全细胞蛋白指纹图谱的基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)技术,针对鼻疽伯克霍尔德菌fliP基因和类鼻疽伯克霍尔德菌TTS1基因的TaqMan探针的双重荧光定量PCR 方法,以及基于通用引物的16S rRNA序列分析方法对鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌进行了比较鉴定,并对3种方法的鉴定效果进行比较分析。
1 材料与方法 1.1 菌株和试剂 1.1.1 菌株5株鼻疽伯克霍尔德菌和5株类鼻疽伯克霍尔德菌为病原微生物生物安全国家重点实验室保存菌种。
1.1.2 培养基胰酶大豆血琼脂(tryptic soy agar,TSA)购自英国Oxoid,高压灭菌后待温度降至50 ℃以下加入5%脱纤维无菌羊血,置于4 ℃冰箱保存待用。脱纤维羊血购自北京京顺秀山动物养殖中心。
1.1.3 主要试剂甲酸、乙腈(AN)、三氟乙酸(TFA)和α-氰基-4-羟基-肉桂酸(CHCA)均为色谱级试剂,购自德国Fluka。终浓度50% AN和2.5% TFA以纯水配置成基础组织溶剂(basic organic solvent,OS)。将14 mg CHCA溶解于1 mL OS即制成饱和基质溶液,现用现配。
细菌基因组DNA提取试剂盒,购自天根生物科技。16S rDNA细菌鉴定试剂盒、DNA分子量标准、Premix Ex TaqTM(Perfect Real Time)和 Easy Dilution均为TaKaRa产品。引物和TaqMan探针合成由上海生工公司完成。
1.1.4 实验仪器T personal PCR扩增仪(德国Biometra公司);SmartCycler荧光定量PCR仪(美国Cepheid公司);Autoflex飞行时间质谱仪(德国Bruker Daltonics 公司)。
1.2 方法 1.2.1 鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌的培养和质谱前样品处理将5株鼻疽伯克霍尔德菌和5株类鼻疽伯克霍尔德菌接种于TSA,在37 ℃培养48 h。取一接种环(5~10 mg)过夜培养产物置于 Eppendorf管中,用50 μL 80%TFA充分悬浮反应30 min,可灭活高致病性病原体及其芽胞[9]。先后加入150 μL 纯水和200 μL AN,充分混匀后以12 000×g离心2 min,取上清1 μL加至样品靶,晾干后覆盖2 μL饱和基质CHCA。冷冻保存的菌种在实验室连续传代3次以上再进行质谱检测。
1.2.2 鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌的质谱鉴定德国Bruker Daltonics公司飞行时间质谱仪Autoflex,配备50 Hz氮激光源,参数设置为ion source 1 (IS1):20 kV;IS2:18.5 kV;Lens:8.5 kV;Detector gain:2 650 V。在正线性模式下以最大激光频率获取相对分子质量范围2 000 ~20 000质谱图。以标准混合肽Protein calibration standard Ⅰ校准仪器。选择LP_bacteria.par方法进行分析,激光点击数50 shots,累加至200~300 shots保存为一张质谱图。所得质谱图用BioTyper软件与自建病原菌蛋白指纹图谱数据库进行检索比对,从而对样品做出鉴定。当log(score)≥2.0时鉴定为种水平;1.7≤log(score)<2.0时鉴定为属水平; log(score)<1.7时表示未能得到可靠鉴定。每个待检样品点3个靶点作为复孔,以3个复孔中最终分数值最高者对应的菌株为鉴定结果。
1.2.3 鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌16S rRNA基因鉴定取鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌的新鲜培养产物提取基因组DNA,具体操作按照试剂盒说明书进行。以该2种菌的基因组 DNA为模板,用TaKaRa的16S rDNA细菌鉴定试剂盒扩增16S rRNA基因部分序列。引物由试剂盒中自带,不提供序列。扩增的目的片段大小在500 bp左右。
反应体系:模板DNA 1 μL,PCR Premix 25 μL,Forward Primer 0.5 μL,Reverse Primer 0.5 μL,16S-free H2O 23 μL,Total Volume 50 μL。
反应条件:预变性94 ℃,5 min;变性94 ℃,30 s;退火50 ℃,30 s;延伸72 ℃,30 s;循环30次。延伸72 ℃,5 min。
阴性对照以16S-free H2O替代模板DNA。扩增产物经1%琼脂糖凝胶电泳确认后,送Invitrogen公司测序。测序结果经NCBI BLAST检索比对,得出鉴定结果。以16S rRNA基因部分序列相似性在99%以上鉴定为同种,在97%以上鉴定为同属。
1.2.4 鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌双重荧光定量PCR(fluorescence quantitative PCR,FQ-PCR)鉴定以鼻疽伯克霍尔德菌fliP基因和类鼻疽伯克霍尔德菌TTS1基因为靶基因,用软件Primer 5.0设计并优化用于荧光定量PCR的引物和TaqMan探针(表 1)。
| 引物或探针 | 序列(5′→3′) | 扩增产物 |
| flip | 上游:CCCATTGGCCCTATCGAAG | 121 bp |
| 下游:GCCCGACGAGCACCTGATT | ||
| 探针:JOE-CAGGTCAACGAGCTTCACGCGGAT-TAMRA | ||
| TTS1 | 上游:ATCGCCAAATGCCGGGTTTC | 110 bp |
| 下游:CAAATGGCCATCGTGATGTTC | ||
| 探针:FAM-TCGGCGAACGCGATTTGATCGTTC-BHQ1 |
以1.2.3中提取的5株鼻疽伯克霍尔德菌和5株类鼻疽伯克霍尔德菌基因组DNA为模板进行双重FQ-PCR鉴定。
反应体系:2×Premix Ex TaqTM 12.5 μL,fliP-S 0.625 μL,fliP-AS 0.625 μL,fliP-P 0.5 μL,TTS1-S 0.875 μL,TTS1-AS 0.875 μL,TTS1-P 0.375 μL,模板1 μL,dH2O 7.625 μL,Total Volume 50 μL。
反应条件:95 ℃ 60 s,95 ℃ 15 s,60 ℃ 30 s(45个循环)。
若Ct值(cycle threshold)大于35即判断为阴性。
1.2.5 鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌的综合鉴定比较质谱鉴定用所得质谱图用BioTyper软件与自建病原菌蛋白指纹图谱数据库进行检索比对,按照1.2.2所述以得分最高的条目作为鉴定结果。16S rRNA基因部分序列相似性在99%以上可鉴定为同种,在97%以上可鉴定为同属。双重FQ-PCR以Ct值大于35判断为阴性。根据3种方法的鉴定结果对5株鼻疽伯克霍尔德菌和5株类鼻疽伯克霍尔德菌进行综合判定。
2 结果 2.1 鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌的MALDI-TOF-MS鉴定结果5株鼻疽伯克霍尔德菌和5株类鼻疽伯克霍尔德菌的MALDI-TOF-MS图谱用BioTyper软件与自建病原菌蛋白指纹图谱数据库进行检索比对。结果显示:其中2株Burkholderia mallei和4株Burkholderia pseudomallei的鉴定结果与菌种库记录一致;Burkholderia mallei PBS 89-3鉴定为Burkholderia pseudomallei(log score=2.1),而Burkholderia mallei PBS 350013 (log score=1.1)、Burkholderia mallei PBS 350015(log score=1.1) 和Burkholderia pseudomallei PBS 350117(log score=1.3) 未能检索出与之相匹配的菌株。
2.2 鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌16S rRNA基因鉴定结果5株鼻疽伯克霍尔德菌和5株类鼻疽伯克霍尔德菌的16S rRNA部分基因测序后与NCBI BLAST比对鉴定,其中Burkholderia mallei PBS 350018、Burkholderia pseudomallei PBS 350102、Burkholderia pseudomallei PBS 350117和Burkholderia pseudomallei PBS 340104的鉴定结果与菌种库记录一致。其他菌株中,1株细菌被鉴定为假单胞菌属(Pseudomonas sp.),鉴定只至属水平;1株细菌被鉴定为洋葱伯克霍尔德菌(Burkholderia cepacia),该菌和类鼻疽伯克霍尔德菌高度相似;1株细菌被鉴定为土壤短芽孢杆菌(Brevibacillus agri),本实验室并没有操作这种菌株,鉴定出这个结果推测可能是测序过程的失误;3株细菌被鉴定为大肠杆菌(Escherichia coli),这应该是在基因组提取和16S rRNA基因扩增过程中出现了大肠杆菌的污染。具体鉴定结果参见表 2。
| 菌株编号 | MALDI-TOF-MS | 双重FQ-PCR | 16S rRNA基因部分测序 | 综合判断 | 菌种库记录 |
| 350018 | B.mallei | B.mallei | B.mallei | B.mallei | B.mallei |
| 350019 | B.mallei | B.mallei | Escherichia coli | B.mallei | B.mallei |
| 350015 | No match | Not identified | Pseudomonas sp. | Not identified | B.mallei |
| 350013 | No match | Not identified | Brevibacillus agri | Not identified | B.mallei |
| 89-3 | B.pseudomallei | B.pseudomallei | Escherichia coli | B.pseudomallei | B.mallei |
| 350102 | B.pseudomallei | B.pseudomallei | B.pseudomallei | B.pseudomallei | B.pseudomallei |
| 350104 | B.pseudomallei | B.pseudomallei | B.cepacia | B.pseudomallei | B.pseudomallei |
| 350180 | B.pseudomallei | B.pseudomallei | Escherichia coli | B.pseudomallei | B.pseudomallei |
| 350117 | No match | B.pseudomallei | B.pseudomallei | B.pseudomallei | B.pseudomallei |
| 340104 | B.mallei | B.pseudomallei | B.pseudomallei | B.pseudomallei | B.pseudomallei |
2.3 鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌双重FQ-PCR鉴定结果
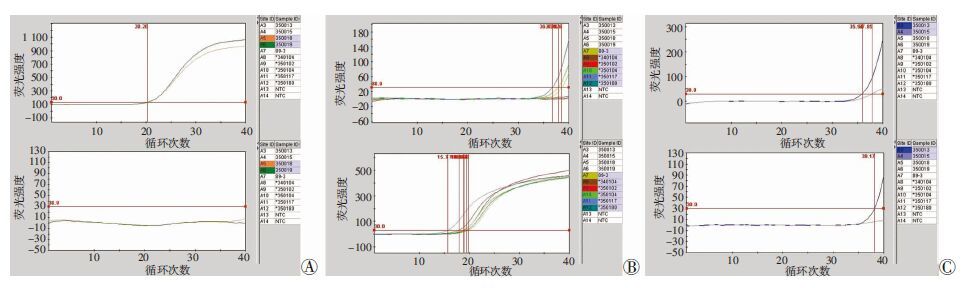
用荧光定量PCR引物和TaqMan探针扩增鼻疽伯克霍尔德菌fliP基因和类鼻疽伯克霍尔德菌TTS1基因,从而对5株鼻疽伯克霍尔德菌和5株类鼻疽伯克霍尔德菌进行鉴定。Cy3通道检测JOE荧光信号,即鼻疽伯克霍尔德菌fliP基因;FAM通道检测FAM荧光信号,即类鼻疽伯克霍尔德菌TTS1基因。当Ct值大于35即判断为阴性。经检测,Burkholderia mallei PBS 350018和Burkholderia mallei PBS 350019均检测出fliP基因,而没有检测出TTS1基因,鉴定为Burkholderia mallei;Burkholderia mallei PBS 89-3、Burkholderia pseudomallei PBS 340104、Burkholderia pseudomallei PBS 350102、Burkholderia pseudomallei PBS 350104、Burkholderia pseudomallei PBS 350117和Burkholderia pseudomallei PBS 350180均检测出TTS1基因,而没有检测 出fliP基因,鉴定为Burkholderia pseudomallei;Burkholderia mallei PBS 350013和Burkholderia mallei PBS 350015没有检测出fliP基因和TTS1基因,因此鉴定既非Burkholderia mallei也非Burkholderia pseudomallei(图 1)。
|
|
A:350018、350019;B:89-3、340104、350102、350104、350117、350180;C:350013、350015 上为Cy3通道(鼻疽伯克霍尔德菌fliP基因);下为FAM通道(类鼻疽伯克霍尔德菌TTS1基因) 图 1 双重FQ-PCR鉴定Burkholderia mallei和Burkholderia mallei结果 |
2.4 鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌的综合鉴定结果
MALDI-TOF-MS方法、双重FQ-PCR方法和16S rRNA基因测序方法对菌种库中部分菌株鉴定结果(表 2)显示,菌种库中记录为Burkholderia mallei PBS 350013、Burkholderia mallei PBS 350015和Burkholderia mallei PBS 89-3的3株菌,其实际鉴定结果与记录不符。其中Burkholderia mallei PBS 89-3经鉴定为Burkholderia pseudomallei,Burkholderia mallei PBS 350013、Burkholderia mallei PBS 350015未能确认是哪种细菌,但Burkholderia mallei的可能性可以排除。而Burkholderia pseudomallei PBS 350117在数据库中未能找到相匹配的菌株,Burkholderia pseudomallei PBS 340104鉴定为Burkholderia mallei,原因可能是这两个菌株与库中的菌株亲缘关系较远,导致图谱差异较大,这样的菌株图谱收入库中更具有扩充库容的意义。
3 讨论随着对细菌鉴定方法研究的不断深入与分类学的发展,分类依据从形态特征发展至生理特征与分子特征,分类所依据的特征由少至多,逐渐呈现多相分类的发展趋势。于是出现了将多种方法如将表型分析、基因型分析和以分类学为目的的系统发育特征分析结合在一起的方法,这样的方法被看作是“多相分类方法”(polyphasic taxonomy)[10]。多相分类概念最早由Colwell于1970年提出,是指从微生物的表型、遗传型和 系统发育等方面获取数据和信息,用多种方法综合比较、相互验证、互为补充,进而更为合理地确定微生物的分类地位和系统发育关系,并较全面地反映微生物多样性的方法[11]。根据多相分类法的精神,细菌的鉴定,尤其是某些生理生化或基因特性高度相似的细菌,其检测和鉴定应经过两种以上的方法确认,综合分析不同方法的鉴定结果,才能得出最终结论。
本研究所用菌株为我重点实验室所保存,并经过常规方法及与其他相似菌株如假单胞菌、洋葱伯克霍尔德菌和唐菖蒲伯克霍尔德菌等比较鉴定后收入库中。本研究结果显示,由于鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌具有较高的基因同源性和相似的理化性质,传统的形态学和生理生化鉴定方法对该两种菌的区分能力非常有限。MALDI-TOF-MS技术具有快速、灵敏和高通量等特点,被广泛应用于生命科学各领域。随着该技术的日渐成熟与发展,近年来其越来越多地被国外的临床和实验室作为日常微生物检测的重要手段。基于MALDI-TOF-MS的细菌全细胞蛋白指纹图谱技术是在对细菌蛋白质表达组分析的基础上进行细菌鉴定的,不依赖于细菌的形态学和细菌生理生化指标[12],对于鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌这两种高度同源的细菌具有很好的区分鉴定能力。相较现有比较常见的针对鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌的血清学诊断方法,荧光定量PCR具有良好的敏感性,我们应用的双重FQ-PCR检测方法所选择的靶基因是鼻疽伯克霍尔德菌鞭毛fliP基因中高度保守的一个基因重组插入片段[8],和类鼻疽伯克霍尔德菌特异的基因标志TTS1[13],具有良好的特异性,鼻疽菌和类鼻疽菌之间不会发生交叉反应。16S rRNA基因测序方法是比较常用的未知微生物鉴定方法,它的优点是无需进行预判就可以直接进行操作,但是在本实验中的鉴定结果不太理想。除了该方法本身鉴定能力有限,多数也只能鉴定至属水平,通用引物在扩增过程中容易污染其他基因组也是一个常见的问题。最重要的是鼻疽菌和类鼻疽菌发育关系十分密切,两者有几乎完全相同的16S rRNA序列(同源性为99%),染色体DNA同源性也大于70%[14],因此16S rRNA基因测序方法不适合对该两种菌进行鉴定。
总而言之,MALDI-TOF-MS的蛋白指纹图谱方法和双重荧光定量PCR方法对鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌具有很好的鉴定能力,16S rRNA基因序列分析方法不适合用于这两种细菌的鉴定分析。
| [1] | 杜新安, 曹务春. 生物恐怖的应对与处置. 北京: 人民军医出版社[M]. 2005 : 212 -214. |
| [2] | 杨瑞馥, 王松俊. 生物威胁与核查. 北京: 军事医学科学出版社[M]. 2001 : 1 -44. |
| [3] | 傅琼瑶, 陈春羽, 邬娇, 等. 一种快速定量检测类鼻疽伯克霍尔德菌的方法建立及评价[J]. 第三军医大学学报,2015, 37 (17) : 1734 –1738. DOI:10.16016/j.1000-5404.201412143 |
| [4] | Wiersinga W J, van-der-Poll T, White N J, et al. Melioidosis: insights into the pathogenicity of Burkholderia pseudomallei[J]. Nat Rev Microbiol,2006, 4 (4) : 272 –282. DOI:10.1038/nrmicro1385 |
| [5] | 方静, 方瑶. 类鼻疽的研究进展及诊疗现状[J]. 微生物与感染,2013, 8 (2) : 115 –118. |
| [6] | 杨小敏, 方瑶, 顾江, 等. 特异引物PCR鉴定类鼻疽伯克霍尔德菌方法的建立和优化[J]. 第三军医大学学报,2011, 33 (14) : 1427 –1431. DOI:10.16016/j.1000-5404.2011.14.001 |
| [7] | 金宁一, 胡仲明, 冯书章. 新编人兽共患病学. 北京: 科学出版社[M]. 2007 : 513 -538. |
| [8] | Tomaso H, Scholz H C, Al-Dahouk S, et al. Development of a 5′-nuclease real-time PCR assay targeting fliP for the rapid identification of Burkholderia mallei in clinical samples[J]. Clin Chem,2006, 52 (2) : 307 –310. DOI:10.1373/clinchem.2005.059196 |
| [9] | Lasch P, Nattermann H, Erhard M, et al. MALDI-TOF mass spectrometry compatible inactivation method for highly pathogenic microbial cells and spores[J]. Anal Chem,2008, 80 (6) : 2026 –2034. DOI:10.1021/ac701822j |
| [10] | Pontes D S, Lima-Bittencourt C I, Chartone-Souza E, et al. Molecular approaches: advantages and artifacts in assessing bacterial diversity[J]. J Ind Microbiol Biotechnol,2007, 34 (7) : 463 –473. DOI:10.1007/s10295-007-0219-3 |
| [11] | Colwell R R. Polyphasic taxonomy of the genus vibrio: numerical taxonomy of Vibrio cholerae, Vibrio parahaemolyticus, and related Vibrio species[J]. J Bacteriol,1970, 104 (1) : 410 –433. |
| [12] | Hettick J M, Kashon M L, Simpson J P, et al. Proteomic profiling of intact mycobacteria by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry[J]. Anal Chem,2004, 76 (19) : 5769 –5776. DOI:10.1021/ac049410m |
| [13] | Novak R T, Glass M B, Gee J E, et al. Development and evaluation of a real-time PCR assay targeting the type III secretion system of Burkholderia pseudomallei[J]. J Clin Microbiol,2006, 44 (1) : 85 –90. DOI:10.1128/jcm.44.1.85-90.2006 |
| [14] | 许化溪, 王卉放, 李那, 等. 鼻疽假单胞菌与类鼻疽假单胞菌的基因分类[J]. 江苏大学学报: 医学版,2002, 12 (1) : 1 –3. DOI:10.3969/j.issn.1671-7783.2002.01.001 |



