类鼻疽伯克霍尔德菌(Burkholderia pseudomallei,BP)简称类鼻疽菌,是一种革兰阴性球杆菌,两端钝圆、两极浓染、无芽孢、有鞭毛和菌毛,运动活跃[1],该菌可通过直接接触或吸入气溶胶等方式经破损的皮肤黏膜、呼吸道和消化道引起人或动物感染,造成类鼻疽[2]。类鼻疽虽然最常累及肺部,但几乎可侵犯宿主每一器官[3]。有糖尿病、肾病等基础疾病患者更易患类鼻疽。类鼻疽在流行地区死亡率高,泰国东北部高达50%,尤其急性败血症病死率高达90%以上;且具有较高的复发率(约20%),需要长期使用抗生素防止复发[4]。目前类鼻疽菌的一些毒力因子相关基因已经得到确认,包括荚膜多糖、菌毛、脂多糖、Ⅲ型分泌系统、Ⅵ型分泌系统,如自转运蛋白BimA、bacA、bacB[5-6],Cif同源蛋白CHBP[7]等,其中研究人员发现BPSL1549编码的类鼻疽伯克霍尔德菌致死因子(Burkholderia lethal factor 1,BLF1)能抑制宿主细胞翻译起始因子eIF4A的解旋酶活性,抑制蛋白质合成从而直接杀伤宿主细胞[8]。本研究采用自杀性载体同源重组的方法构建类鼻疽菌BPSL1549基因敲除株[BP(△BPSL1549)],建立类鼻疽菌基因敲除平台,同时为进一步研究BLF1及其他毒力因子在致病机制中的功能奠定相关技术基础。
1 材料与方法 1.1 材料 1.1.1 主要菌种和试剂类鼻疽伯克霍尔德菌BPC006[9],自杀性质粒pK18mobSacB(本实验室保存),大肠杆菌S17-1λpir(第三军医大学基础医学部微生物学教研室惠赠),小鼠巨噬细胞RAW264.7(ATCC:TIB-71),细菌基因组DNA提取试剂盒,质粒小量提取试剂盒,凝胶回收试剂盒,DMEM培养基(GBI-CO公司),胎牛血清(Gibco公司),卡那霉素(Kanamycin,北京天根),限制性内切酶、T4连接酶、Primer star® Taq酶、DNA marker(TaKaRa公司),庆大霉素(Gentamicin,上海生工),0.45 μm滤膜(Merck Millipore)。
1.1.2 实验动物健康雌性BALB/c小鼠[第三军医大学实验动物中心提供,实验动物生产许可证号: SCXK(军)2012-0011;实验动物使用许可证号:SYXK(军)2012-0035]16只,6周龄,SPF级,体质量20~25 g。
1.2 BPSL1549基因敲除株的构建 1.2.1 重组自杀性载体pK18mobSacB::△BPSL1549的构建根据NCBI数据库中类鼻疽菌BPC006全 基因组序列中BPSL1549基因及其两侧序列,设计3对 引物分别扩增BPSL1549基因及其两端的同源臂(表 1),送上海生工生物工程公司合成,用于后续载体的构建及验证。
| 扩增片段 | 引物名称 | 序列 | 产物长度(bp) |
| BPSL1549 | p1 | 5′-AGGCCGTTCGATCGGATACGTT-3′ | 600 |
| p2 | 5′-CGAACCGGATCATCGAAGTGTC-3′ | ||
| bpsl549 左侧翼序列(L-BPSL1549) | pL1 | 5′-CGGAATTCGATTTGCCGCCCAGTTCGAG-3′(EcoRⅠ) | 1100 |
| pL2 | 5′-GCTCTAGAGGCCTGGCGAATCTGAGCT-3′(XbaⅠ) | ||
| bpsl549 右侧翼序列(R-BPSL1549) | pR1 | 5′-GCTCTAGAGCGGCAGCGGCTCGCCTTCG-3′(XbaⅠ) | 1100 |
| pR2 | 5′-CCCAAGCTTCAACTACGACGACTACATGCTC-3′(HindⅢ) | ||
| 划线部分为设计的酶切位点 | |||
将BP接种到LB液体培养基中,37℃振荡培养过夜,收集细菌,提取基因组。利用设计的引物pL1/pL2和pR1/pR2以BP基因组为模板分别进行PCR扩增。PCR反应总体系为20 μL,反应条件为95 ℃预变性5 min;94 ℃变性1 min,57 ℃退火1 min,72 ℃延伸1.5 min,共35个循环;72 ℃终延伸7 min。反应结束取10 μL扩增产物1%琼脂糖凝胶电泳鉴定PCR产物。将PCR扩增的L-BPSL1549和R-BPSL1549片段切胶回收保存。把pK18mobSacB质粒和L-BPSL1549片段分别用EcoRⅠ和XbaⅠ双酶切后使用T4 DNA连接酶16 ℃连接12 h,连接产物转化入TOP10感受态细胞,涂布于含卡那霉素(250 μg/mL)的LB平板,37 ℃ 培养过夜,挑取单菌落振荡培养并提取质粒双酶切鉴定。得到的阳性重组质粒与R-BPSL1549片段使用XbaⅠ和HindⅢ双酶切,然后用T4 DNA连接酶连 接,连接产物转入TOP10感受态细胞,在卡那霉素抗性LB平板上进行筛选,提取质粒酶切鉴定,将构建的阳性重组自杀性质粒命名为pK18mobSacB::△BPSL1549。
1.2.2 重组自杀性载体的转导用CaCl2转化法制备S17-1λpir感受态细胞,将pK18mobSacB::△BPSL1549质粒转化至S17-1λpir感受态细胞,筛选鉴定含有重组自杀质粒的S17-1λpir细菌。将受体菌BP(GmR)和供体菌S17-1λpir(pK18mobSacB::△BPSL1549) 分别接种10 mL LB(Gm 100 μg/mL)和LB (Km 250 μg/mL)液体培养基中,37 ℃振荡过夜培养,按1 ∶100进行活化,D(600)值达到0.4~0.5时,按照1 ∶4比例把受体菌和供体菌混匀,0.45 μm孔径滤膜过滤,将滤膜置于无抗性的LB平板37 ℃培养过夜(注意不要倒置平板),收集滤膜上的细菌,用LB液体倍比稀释后涂布于LB(Gm 100 μg/mL,Km 250 μg/mL)双抗平板上。重组自杀性质粒通过接合方式从供体菌转移到受体菌,与细菌基因组DNA发生第1次同源重组(图 1A、B),通过抗生素筛选和PCR鉴定BPSL1549基因二倍体菌株BP(pK18mobSacB::△BPSL1549);然后利用SacB基因的蔗糖筛选压力使部分二倍体上的重组载体丢失发生第2次同源重组(图 1C),最终获得目的基因敲除株。
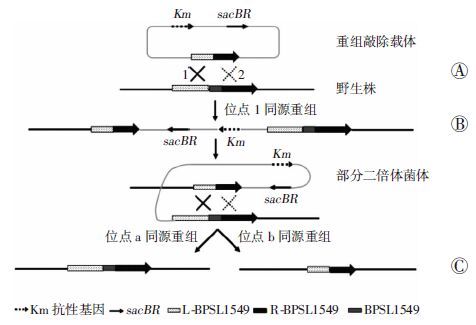
|
| A:自杀性载体的构建;B:第1次同源重组;2:第2次同源重组 图 1 自杀性载体pK18mobSacB::△BPSL1549同源重组示意图 |
1.2.2 BPSL1549基因敲除株的筛选与鉴定
将BP(pK18mobSacB::△BPSL1549)二倍体接种到LB(Gm 100 μg/mL)培养基中37 ℃振荡培养12 h。对过夜培养物稀释数倍后涂布于LB(Gm 100 μg/mL,蔗糖 10%,无NaCl)蔗糖琼脂平板,24 ℃静置培养48 h。用接种环挑取蔗糖平板上长出的单个菌落分别接种到LB(Gm 100 μg/mL)和LB(Km 250 μg/mL)琼脂平板,对GmR、KmS菌株进行PCR扩增,序列测定。鉴定BPSL1549基因敲除株,即BP(△BPSL1549)。
1.2.4 BPSL1549基因敲除株的Western blot检测用本实验室制备的兔抗BPSL1549纯化蛋白为一抗(稀释倍数1 ∶2 000),HRP标记的山羊抗兔IgG为二抗(稀释倍数为1 ∶5 000,中杉金桥),对野生型和突变型BP全菌蛋白进行Western blot检测分析,具体操作方法见参考文献[8]。
1.2.5 BPSL1549基因敲除株的毒力检测试验将BP(△BPSL1549)和野生株BP接种于10 mL LB液体培养基中,37 ℃振荡过夜培养,第2天以1 ∶100活化,当D(600)达到1时,用倍比稀释法进行细菌计数;把16只6周龄雌性BALB/c小鼠分成2组,每组8只,以滴鼻方式接种细菌,每只小鼠接种1.0×105CFU活菌;每天观察小鼠临床表现、记录发病和死亡情况,连续观察30 d。
1.3 统计学方法数据采用GraphPad Prism 5统计学软件进行处理。
2 结果 2.1 重组自杀性载体pK18mobSacB::△BPSL1549的鉴定BP基因组为模板,分别以pL1/pL2和pR1/pR2为引物对,PCR扩增L-BPSL1549和R-BPSL1549目的基因片段均约为1 100 bp(图 2A)。以重组质粒pK18mobSacB::△BPSL1549为模板,用引物pL1/pL2和pR1/pR2可以分别扩增出约1 100 bp片段,再分别用 EcoRⅠ和XbaⅠ ,XbaⅠ和HindⅢ双酶切后,琼脂糖凝胶电泳鉴定获得符合预期的1 100 bp条带(图 2B、C)。
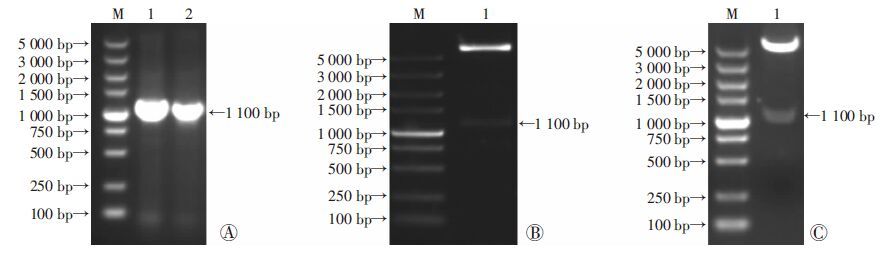
|
| A:BPSL1549两端同源臂扩增片段 M:标准(DL5000);1:L-BPSL1549目的片段;2:R-BPSL1549目的片段;B:L-BPSL1549酶切鉴定 M:标准(DL5000);1:pK18mobSacB::△BPSL1549/(EcoRⅠ+XbaⅠ);C:R-BPSL1549酶切鉴定 M:标准(DL5000);1:pK18mobSacB::△BPSL1549/(XbaⅠ+HindⅢ) 图 2 重组自杀性载体pK18mobSacB::△BPSL1549的鉴定 |
2.2 BPSL1549基因敲除株的筛选与鉴定
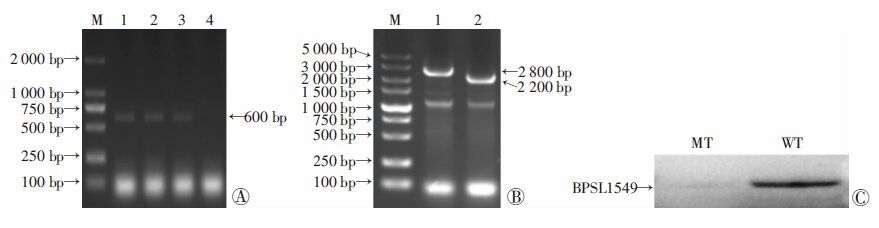
用蔗糖平板筛选出GmR、KmS菌落,说明该菌落已经丢失重组自杀性载体pK18mobSacB::△BPSL1549,发生了同源重组交换。分别将长出的菌落接种到LB(Gm 100 μg/mL)液体培养基中37 ℃培养过夜,提取细菌基因组,用引物p1/p2进行PCR鉴定。在挑取的菌落中只有1个菌落扩增不出约600 bp的BPSL1549基因片段(图 3A),该菌落可能是敲除成功菌株,用引物pL1/pR2分别扩增该菌株和野生株的BPSL1549基因两侧同源臂片段(L-BPSL1549-R)获得约2 200 bp和2 800 bp条带(图 3B),将两片段的测序结果进行比对分析,结果显示该菌株比野生株缺失了BPSL1549 基因片段,与实验预期一致。同时BP全菌蛋白Western blot检测分析进一步证明该菌株因缺失BPSL1549基因无法表达其蛋白(图 3C)。
|
| A:筛选克隆BPSL1549片段扩增 M:标准( DL2000);1~3:阴性克隆;4:阳性克隆;B:阳性克隆鉴定 M:标准 DL5000;1:野生株(L-BPSL1549-R);2:敲除株(L-BPSL1549-R);C:Western blot检测敲除株和野生株BPSL1549蛋白表达 MT: 敲除株;WT: 野生株 图 3 BPSL1549基因敲除株的筛选与鉴定 |
2.3 BPSL1549基因敲除株的毒力检测
对分别滴鼻接种BP(△BPSL1549)和野生株的小鼠进行观察,接种野生株的小鼠4 d后开始出现毛发蓬乱、精神萎靡、闭眼蜷缩、食欲减退等表现,5 d即开始出现死亡,解剖后发现小鼠脾脏后端、肝脏右叶出现脓肿,12 d内8只小鼠死亡7只。而接种BP(△BPSL1549)菌株小鼠在10 d后才开始出现相似症状,发病较慢,死亡率低,30 d内8只小鼠仅死亡4只。生存曲线见图 4。同时,观察到野生株组小鼠产生神经损伤现象如转圈、打滚等,而BP(△BPSL1549)菌株组小鼠未见明显的神经损伤症状。表明BP(△BPSL1549)菌株的毒力与野生株相比明显降低。

|
| a:P<0.05,与野生株比较 图 4 BPSL1549基因敲除株和野生株感染小鼠的生存曲线 |
3 讨论
类鼻疽菌具有高致病性、强抵抗力和气溶胶传播的特性,可作为潜在的生物武器,被WHO列为B类生物恐怖剂[10],对公共卫生安全造成巨大潜在威胁。类鼻疽菌基因组全长7.14 Mb,编码多种毒力因子和抗原结构,主要包括荚膜多糖、鞭毛、菌毛、群体感应分子、Ⅲ型分泌系统及Ⅵ型分泌系统等[11],不同类鼻疽菌株之间还存在多种基因组岛。对这些毒力因子基因和基因岛进行缺失突变对于类鼻疽的毒力研究、疫苗开发以及发现新的诊断靶标都具有重要的理论指导意义。因此,急需建立一种高效同时不引入其他选择标记的基因敲除或突变的技术。
本研究根据同源DNA片段可发生同源重组的原理,采用pK18mobSacB自杀性质粒系统构建基因缺失 突变株,该质粒含有缺陷的 R6K复制子,必须在pir基因 编码的π蛋白作用下才能发挥作用,因此pK18mobSacB 只能在表达π蛋白的特定宿主菌(如大肠杆菌S17-1λpir)内才能复制,而在其他非特定细菌中会逐渐丢失[12]。同时,pK18mobSacB含有枯草杆菌的果聚糖蔗糖酶基因(SacB基因),能编码果聚糖蔗糖酶,催化蔗糖水解为对多数革兰阴性菌有毒性作用的果聚糖。因此,在含有蔗糖的培养基中,含有该质粒的菌株将不能生长。尽管类鼻疽菌全基因组能够编码SacB基因,但实际上类鼻疽菌对蔗糖并不敏感,可能是由于携带SacB基因的不同宿主菌对蔗糖的敏感性不同,其次培养温度也会影响SacB基因的表达,因此需要选择合适的蔗糖浓度及温度才能使SacB基因发挥作用。
2007年,对类鼻疽菌和泰国伯克霍尔德菌的蛋白质组学分析发现了14个功能未知的预测蛋白[13]。Cruz-Migoni等[8]采用X射线晶体衍射技术对其中的BPSL1549蛋白结构进行解析,确定该蛋白是类鼻疽菌的首个能直接杀伤宿主细胞的毒力因子。因此,BPSL1549蛋白又称为类鼻疽伯克霍尔德致死因子1(BLF1)。BLF1由BPSL1549基因编码,含有211个氨基酸,相对分子质量为23×103[14]。BLF1可作用于真核细胞起始翻译因子eIF4A的Gln339使其脱酰胺变为Glu339,抑制RNA解旋酶活性,使细胞蛋白质合成受到广泛抑制从而导致宿主疾病。BPSL1549基因作为类鼻疽菌的重要毒力因子,构建BPSL1549基因敲除株,有助于类鼻疽发病机制的研究及其减毒活疫苗的开发。同时以该方法为例建立了便捷高效的类鼻疽菌基因敲除平台,为类鼻疽菌其他相关毒力因子的进一步研究奠定基础。
| [1] | Cheng A C, Currie B J. Melioidosis: epidemiology, pathophysiology, and management[J]. Clin Microbiol Rev,2005, 18 (2) : 383 –416. DOI:10.1128/CMR.18.2.383-416.2005 |
| [2] | Leelarasamee A. Recent development in melioidosis[J]. Curr Opin Infect Dis,2004, 17 (2) : 131 –136. |
| [3] | Currie B J, Fisher D A, Anstey N M, et al. Melioidosis: acute and chronic disease, relapse and re-activation[J]. Trans R Soc Trop Med Hyg,2000, 94 (3) : 301 –304. |
| [4] | Stevens M P, Haque A, Atkins T, et al. Attenuated virulence and protective efficacy of a Burkholderia pseudomallei bsa type Ⅲ secretion mutant in murine models of melioidosis[J]. Microbiology,2004, 150 : 2669 –2676. DOI:10.1099/mic.0.27146-0 |
| [5] | Campos C G, Borst L, Cotter P A. Characterization of BcaA, a putative classical autotransporter protein in Burkholderia pseudomallei[J]. Infect Immun,2013, 81 (4) : 1121 –1128. DOI:10.1128/IAI.01453-12 |
| [6] | Lazar Adler N R, Stevens J M, Stevens M P, et al. Autotransporters and Their Role in the Virulence of Burkholderia pseudomallei and Burkholderia mallei[J]. Front Microbiol,2011, 2 : 151 . DOI:10.3389/fmicb.2011.00151 |
| [7] | Pumirat P, Broek C V, Juntawieng N, et al. Analysis of the prevalence, secretion and function of a cell cycle-inhibiting factor in the melioidosis pathogen Burkholderia pseudomallei[J]. PLoS ONE,2014, 9 (5) : e96298 . DOI:10.1371/journal.pone.0096298 |
| [8] | Cruz-Migoni A, Hautbergue G M, Artymiuk P J, et al. A Burkholderia pseudomallei toxin inhibits helicase activity of translation factor eIF4A[J]. Science,2011, 334 (6057) : 821 –824. DOI:10.1126/science.1211915 |
| [9] | Fang Y, Huang Y, Li Q, et al. First genome sequence of a Burkholderia pseudomallei Isolate in China, strain BPC006, obtained from a melioidosis patient in Hainan[J]. J Bacteriol,2012, 194 (23) : 6604 –6605. DOI:10.1128/JB.01577-12 |
| [10] | 毛旭虎. 加强类鼻疽的研究[J]. 第三军医大学学报,2011, 33 (13) : 1315 –1317. DOI:10.16016/j.1000-5404.2011.13.013 |
| [11] | D’Cruze T, Gong L, Treerat P, et al. Role for the Burkholderia pseudomallei type three secretion system cluster 1 bpscN gene in virulence[J]. Infect Immun,2011, 79 (9) : 3659 –3664. |
| [12] | Schäfer A, Tauch A, Jäger W, et al. Small mobilizable multi-purpose cloning vectors derived from the Escherichia coli plasmids pK18 and pK19: selection of defined deletions in the chromosome of Corynebacterium glutamicum[J]. Gene,1994, 145 (1) : 69 –73. |
| [13] | Wongtrakoongate P, Mongkoldhumrongkul N, Chaijan S, et al. Comparative proteomic profiles and the potential markers between Burkholderia pseudomallei and Burkholderia thailandensis[J]. Mol Cell Probes,2007, 21 (2) : 81 –91. DOI:10.1016/j.mcp.2006.08.006 |
| [14] | 任春艳, 李倩. 类鼻疽伯克霍尔德致死因子[J]. 微生物学免疫学进展,2015, 43 (3) : 47 –50. DOI:10.13309/j.cnki.pmi.2015.03.011 |



