DNA聚合酶、RNA聚合酶、转录因子、DNA损伤修复蛋白等与基因组DNA非共价结合的相互作用,在细胞增殖和维持遗传基因的完整性等方面发挥了重要作用。然而,药/毒物暴露下形成的共价结合的交联型DNA-蛋白复合体(DNA-protein crosslinking complex,DPC),由于阻碍了DNA的复制和转录,是一种严重的DNA损伤方式[1-3]。甲醛、辐射、氮芥、顺铂等都可以引起DPC生成,并引起细胞增殖旺盛的组织,如骨髓、肿瘤等的药物敏感性增加[3-5]。双功能烷化剂氮芥类药物在临床上被用于抗肿瘤,而其本身又是糜烂性毒剂的一种,能引起DNA烷化损伤和形成DPC。O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)是一种烷基转移酶, 能够移除O6-G上的加合物,使损伤的鸟嘌呤复原。在氮芥损伤时,MGMT蛋白被募集到损伤的DNA位点,就使得MGMT可能成为氮芥靶点,形成MGMT-DNA交联体。
虽然自20世纪70年代,人们就发现DPC存在于多种染毒组织、细胞中,但由于相关技术复杂难以在普通实验室开展,能够形成DPC的药物通常伴有大量的非DPC损伤,欲获得较高纯度的DPC样品通常需要使用超速离心和同位素标记等复杂手段。
我们参考了近几年的DPC制备检测新方法,整合了细胞核抽提/裂解/Tris饱和酚回收法提取及纯化M-DPC、SYBR GreenⅠ法定量M-DPC中双链DNA(dsDNA)、全能核酸酶消化增强DPC中抗原在ELISA板上的包被能力等样品处理方法和技术。该系列方法可以富集并纯化样品中的M-DPC,保留抗原活性,进而通过dsDNA的定量校正上样量以检测比较各个样品中的M-DPC含量差异。
1 材料与方法 1.1 细胞培养及染毒模型建立人支气管上皮细胞HBE常规培养于含青-链霉素双抗,10%胎牛血清(康源科技)的MEM培养基(HyClone)培养液,37 ℃ CO2培养箱培养。染毒前1 d传代,培养24 h后,细胞达到70%~80%融合度。 电子天平准确称取氮芥盐酸盐粉末(笛博化学科技公司),用完全培养基稀释至工作浓度(10、20、50、100 μmol/L),并迅速加入培养板中。细胞染毒3 h后去除染毒液,换相应的新鲜培养基继续培养。
1.2 DPC的提取纯化胰酶消化收集氮芥盐酸盐染毒前后细胞,PBS洗涤2次后以适量的PBS重悬细胞。加入等量的2×细胞裂解液[20 mmol/L Tris-HCl/10 mmol/L MgCl2 /2%(体积分数)Triton X-100/0.65 mol/L蔗糖],冰上放置5 min后2 000×g 4 ℃离心10 min。沉淀加入生理盐水-EDTA溶液[75 mmol/L NaCl/24 mmol/L EDTA/1%(质量体积分数)SDS,pH 8.0],包含RNase A (10 μg/mL)以及蛋白酶抑制剂 (1 mmol/L PMSF; 1 μg/mL pepstatin;0.5 μg/mL leupeptin; 1.5 μg/mL aprotinin),在37 ℃下摇床轻微震荡2 h。加入2倍体积的Tris饱和酚溶液,10 000×g 4 ℃离心10 min。吸取上清,加入2倍体积的Tris饱和酚 ∶氯仿(1 ∶1) 溶液,10 000×g 4 ℃离心10 min后,吸取上清。加入10%体积的3 mol/L醋酸钠,再加入2倍体积的无水乙醇,颠倒混匀后-70 ℃放置15 min。4 000×g 4 ℃离心5 min,弃上清,加入适量的70%的乙醇,4 000×g 4 ℃离心5 min,弃上清。晾干10~20 s,加入8 mmol/L NaOH溶液溶解DPC产物。
1.3 DPC中核酸浓度检测采用凝胶染色用的SYBR GreenⅠ(瑞楚生物),使用时1 ∶10 000倍稀释。吸取50 μL待测DNA(使用TE缓冲液调整浓度至1 ng/μL左右)至96孔板内,加入等份的SYBR GreenⅠ工作液,混匀后置暗处室温孵育10 min,酶标仪上检测,Ex:470 nm,Em:520 nm。该检测结果为后续相同的上样量提供依据。标准曲线制作按照初始孔内小牛胸腺DNA(Sigma)含量为1 500 ng,其后按照3的倍数等比稀释直至2 ng,对各孔进行荧光值检测。为比较dsDNA的含量与DPC提取细胞数量关系,收集正常的HBE细胞并控制细胞数量分别在0.5×107、1×107、2×107, 采用前述的DPC提取及dsDNA检测方法。
1.4 Slot-blot检测DPC的方案采用GE Healthcare 公司的48孔狭缝印迹仪,并配上1台真空泵。滤纸,NC膜预先浸泡于TBS中,按照先滤纸,后NC膜的顺序放置于印迹台上,用加样槽轻轻盖上,并用四周的螺栓固定。对NC膜未能覆盖的孔给予3%的明胶溶液封闭,以增强印迹仪内密封性。往加样孔加入500 μL的TBS溶液,并预抽滤1次。其后加入500 μL M-DPC样品溶液(不足 500 μL使用TBS稀释),真空抽滤后,TBS再抽滤2次以充分洗涤,即可取出。后面的方法同常规的蛋白印迹。
1.5 ELISA检测DPC的方案将含M-DPC的样品中MgCl2浓度调整到2 mmol/L,然后用12.5 U的全能核酸酶37 ℃消化处理30 min,以便消化DNA和RNA。全能核酸酶处理的样品用0.05 mol/L碳酸盐缓冲液(pH9.6) 包被,按每孔50~100 μL加样到96孔ELISA板,并在室温下孵育1~2 h 或4 ℃过夜。后续DPC孵育和清洗均在室温进行。PBST (含0.1% Tween-20的PBS)洗涤酶联孔板3次或4次,并使用封闭液(含10% BSA的PBS)封闭1 h。特异性一抗孵育2~3 h,洗涤4次,再用HRP偶联的相应二抗孵育30~45 min,洗涤4次。加入100 μL TMB高灵敏度底物溶液,将板在暗处孵育20 min,并通过加入50 μL反应停止液终止反应。在450 nm下读取光密度值,并通过去除570 nm处酶联板的本底值进行校正。样品一式两份或一式三份运行。
1.6 ELISA检测M-DPC的线性范围使用200 μmol/L氮芥染毒细胞DPC样品。DPC上样量分别为20、50、100、200、300、400 ng,并以DPC溶剂(8 mmol/L NaOH)上样作为阴性对照。将不同DPC含量下检测得到的光密度值进行计算,得出ELISA检测方法的线性范围。
1.7 ELISA方法检测氮芥染毒细胞M-DPC的变化倍率为比较不同剂量氮芥对于M-DPC的影响,分别设置10、30、100 μmol/L的染毒剂量,于染毒后3 h消化收集细胞样本并提取DPC。为比较染毒后时间对于M-DPC含量的影响,分别在30 μmol/L 氮芥染毒后3、7、12、24 h消化收集细胞样本并提取DPC。DPC样本经过核酸浓度测定后校正上样量以达到各组间相同的dsDNA 含量,随后进行ELISA方法下的M-DPC检测。
1.8 统计学处理数据结果以x ±s表示,多个样品均数比较采用SPSS 13.0统计软件进行单因素方差分析。P<0.05为差异有统计学意义。
2 结果 2.1 DPC中dsDNA含量测定SYBR GreenⅠ可以和dsDNA结合,发出强烈的绿色荧光,用于dsDNA的定量。本方法藉此对提取的DPC中DNA进行定量。首先,通过制作DNA浓度-荧光标准曲线,获得回归曲线;然后,提取不同细胞数量的DPC,用SYBR GreenⅠ 定量,同时可检验提取方法的可靠性。结果显示,SYBR GreenⅠ可以在 2 ng至1.5 μg 区间内对标准dsDNA进行准确的定量(图 1A)。 采用细胞核抽提/裂解/Tris饱和酚回收法抽提包括DPC的dsDNA,其产量可以从标准曲线中计算得到,而且DNA总量与细胞的数量呈很好的线性关系(图 1B)。
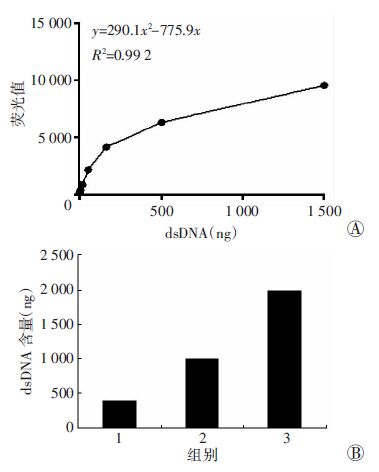
|
| A:采用小牛胸腺DNA制作的dsDNA含量-荧光值的标准曲线;B:采用细胞核抽提/裂解/Tris饱和酚回收法比较不同细胞数提取的dsDNA含量 1: 0.5×107; 2: 1×107; 3: 2×107 图 1 SYBR GreenⅠ检测dsDNA含量 |
2.2 ELISA与狭缝印迹方法的线性关系及灵敏度比较
经典的狭缝印迹先将DPC样本转移到印迹膜上,然后通过免疫印迹检测某种蛋白的DPC含量(图 2A);而ELISA是用提取的DPC样本包被酶联板,然后通过抗原抗体免疫反应和抗体偶联酶的底物显色反映某种蛋白的DPC含量(图 2B)。通过比较20~100 ng上样量,ELISA检测结果显示,随着抗原用量的增加,显色愈加深,说明DPC上样量在一定范围内时,ELISA可对M-DPC中抗原含量进行精确的定量。ELISA和Slot-blot对于M-DPC的检测线性关系一致(图 2C)。
2.3 氮芥染毒细胞M-DPC含量变化对照组有低水平的M-DPC检出,可能是MGMT可与DNA有正常的、短暂交联。氮芥染毒后的M-DPC有显著增加,且对氮芥剂量有依赖关系(图 3A)。30 μmol/L氮芥染毒3 h后,M-DPC水平显著升高,至24 h仍维持在该水平上(图 3B)。
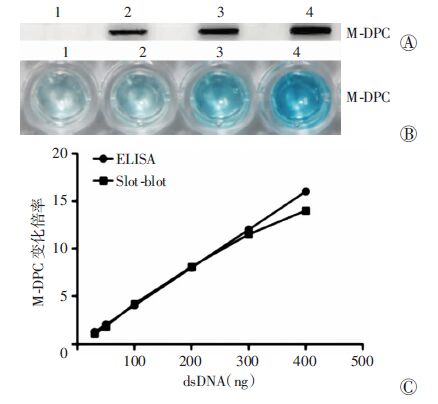
|
| A:Slot-blot检测不同上样量下的M-DPC含量;B:ELISA检测不同上样量下M-DPC含量 1:空白孔;2: 50 ng dsDNA; 3: 100 ng dsDNA; 4: 300 ng dsDNA;C:M-DPC检测的线性关系及灵敏度比较 图 2 ELISA与狭缝印迹方法检测100 μmol/L氮芥染毒的 M-DPC样本 |

|
| A:不同剂量的氮芥染毒HBE 3 h后M-DPC含量变化 1:对照组;2: 10 μmol/L氮芥染毒组;3: 30 μmol/L氮芥染毒组; 4: 100 μmol/L氮芥染毒组;B: 30 μmol/L氮芥染毒后不同时间点M-DPC含量变化 1:氮芥染毒后3 h; 2: 氮芥染毒后7 h; 3: 氮芥染毒后12 h; 4: 氮芥染毒后24 h; a:P<0.01,与对照组比较 图 3 ELISA检测氮芥染毒HBE后M-DPC含量的变化 |
3 讨论
MGMT作为一种具有特殊功能的DNA修复酶,主要修复DNA的烷化损伤,是临床抗肿瘤烷化剂耐药的主要机制。但是,在氮芥类药物的作用下,募集到DNA烷化位点的MGMT可以成为烷化剂的底物,使MGMT与DNA形成交联体,形成的M-DPC无疑具有重要的毒理学意义[6]。文献[7]报道,M-DPC的形成可能与MGMT的活性氨基酸残基位点,如cys145、Tyr114、Arg128、Pro140和Tyr158等有关。M-DPC被证实具有致DNA复制损伤和突变的多重作用。在一些MGMT丰富的组织或细胞中,双功能烷化剂引起的M-DPC的增加被认为是动物/细胞毒性反应的重要原因[8-9]。因此,检测细胞或组织样品中M-DPC水平有重要意义。
氯化铯密度梯度超速离心法是标准的DPC制备方法,该法制备的DPC纯度高,交联蛋白活性保存好,缺点是步骤烦琐,需应用到超速离心机(>100 000×g) 等昂贵设备,一般实验室无法开展。核抽提/裂解/Tris饱和酚回收法是Michaelson-Richie等[5]于2011年报道的一种M-DPC的制备方法,并可以通过Slot-blot检出。我们采用了该方法,并进行了部分改动,结果显示M-DPC的制备稳定,重复性好。一些更为简单的方法近年来也有报道,如Kiianitsa等[10]报道使用利用商品化的DNA提取试剂(如DNAzol等)处理得到DPC样品,可以对喜树碱诱导的TOP1交联蛋白进行检测,作者称之为DNA加合物快速回收法(RADAR,rapid approach to DNA adduct recovery),由于有异硫氰酸胍等强变性剂存在,可能会对部分交联蛋白的抗原活性有影响,因此我们推测并不能适用于所有的交联蛋白。我们也采用了一种DNAzol的同类试剂(DNAiso,TaKaRa)可以提取并检测出M-DPC。值得注意的是,该法所提取的M-DPC的含量与核抽提/裂解/Tris饱和酚回收法虽然相似,但dsDNA回收得率数倍高于后者,可能是DNAiso添加的试剂裂解性更强,DNA更加完整等所致。
狭缝印迹是一种常用的DPC检测方法,主要采用将DPC样品通过抽真空的方式使其吸附在NC膜上,之后通过常规免疫印迹的方法对DPC检测,该过程需要应用到一些特殊的设备。2014年Kiianitsa等[11]开发了基于ELISA检测DPC,在采用了多种类型的ELISA来检验DNA拓扑异构酶TOP1/TOP2a-DNA交联体,发现都不能很好地检出,原因在于DPC中的DNA成分影响了交联蛋白与ELISA板上包被抗体的结合能力。采用核酸酶消化DPC中DNA后,再进行DPC的检测,信号大大提高。因此,在ELISA检测DPC的过程中,控制DPC中核酸含量是一个关键性的技术指标。ELISA是一种基于免疫反应的方法,具有快速、敏感、高通量等优点,在临床检验或者科研实验中有广泛应用。我们采用ELISA检出M-DPC在染毒3 h后显著增加,且与染毒剂量有相关性。M-DPC一旦形成,则稳定存在。
DPC检测技术向着简便化、快速化发展,基于ELISA检测DPC是重要的方向。我们结合新近报道的DPC的制备及其检测方法,建立了基于细胞核抽提/裂解/Tris饱和酚回收的DPC制备检测方法,可以快速、经济、准确地检测M-DPC,为科研或临床相关工作开展提供便利。同时,该方法可能也广泛适用于MGMT以外的其他交联蛋白。
| [1] | Nakano T, Morishita S, Katafuchi A, et al. Nucleotide excision repair and homologous recombination systems commit differentially to the repair of DNA-protein crosslinks[J]. Mol Cell,2007, 28 (1) : 147 –158. DOI:10.1016/j.molcel.2007.07.029 |
| [2] | Nakano T, Katafuchi A, Matsubara M, et al. Homologous recombination but not nucleotide excision repair plays a pivotal role in tolerance of DNA-protein cross-links in mammalian cells[J]. J Biol Chem,2009, 284 (40) : 27065 –27076. DOI:10.1074/jbc.M109.019174 |
| [3] | Ide H, Shoulkamy M I, Nakano T, et al. Repair and biochemical effects of DNA-protein crosslinks[J]. Mutat Res,2011, 711 (1/2) : 113 –122. DOI:10.1016/j.mrfmmm.2010.12.007 |
| [4] | Wong V C, Cash H L, Morse J L, et al. S-phase sensing of DNA-protein crosslinks triggers TopBP1-independent ATR activation and p53-mediated cell death by formaldehyde[J]. Cell Cycle,2012, 11 (13) : 2526 –2537. DOI:10.4161/cc.20905 |
| [5] | Michaelson-Richie E D, Ming X, Codreanu S G, et al. Mechlorethamine-induced DNA-protein cross-linking in human fibrosarcoma (HT1080) cells[J]. J Proteome Res,2011, 10 (6) : 2785 –2796. DOI:10.1021/pr200042u |
| [6] | Pegg A E. Multifaceted roles of alkyltransferase and related proteins in DNA repair, DNA damage, resistance to chemotherapy, and research tools[J]. Chem Res Toxicol,2011, 24 (5) : 618 –639. DOI:10.1021/tx200031q |
| [7] | Loeber R, Rajesh M, Fang Q, et al. Cross-linking of the human DNA repair protein O6-alkylguanine DNA alkyltransferase to DNA in the presence of 1, 2, 3, 4-diepoxybutane[J]. Chem Res Toxicol,2006, 19 (5) : 645 –654. DOI:10.1021/tx0600088 |
| [8] | Kalapila A G, Pegg A E. Alkyltransferase-mediated toxicity of bis-electrophiles in mammalian cells[J]. Mutat Res,2010, 684 (1/2) : 35 –42. DOI:10.1016/j.mrfmmm.2009.11.006 |
| [9] | Kisby G E, Olivas A, Park T, et al. DNA repair modulates the vulnerability of the developing brain to alkylating agents[J]. DNA Repair (Amst),2009, 8 (3) : 400 –412. DOI:10.1016/j.dnarep.2008.12.002 |
| [10] | Kiianitsa K, Maizels N. A rapid and sensitive assay for DNA-protein covalent complexes in living cells[J]. Nucleic Acids Res,2013, 41 (9) : e104 . DOI:10.1093/nar/gkt171 |
| [11] | Kiianitsa K, Maizels N. Ultrasensitive isolation, identific-ation and quantification of DNA-protein adducts by ELISA-based RADAR assay[J]. Nucleic Acids Res,2014, 42 (13) : e108 . DOI:10.1093/nar/gku490gku490 |



