2. 400038 重庆,第三军医大学西南医院 胸心外科实验室
2. 2. Laboratory of Cardiothoracic Surgery, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
哮喘是一种严重的、影响到全球所有年龄组的疾病[1]。过去20年中,全球针对哮喘恶化及控制每日症状的费用增加了30%[2]。最新调查研究显示:中国儿童哮喘患病率近20年来以每10年50%以上增幅上升[3],因此如何更好地防控哮喘具有重要意义。哮喘的治疗目前主要采取吸入激素治疗,但吸入激素不能治愈哮喘,只能控制哮喘。WHO及欧洲变态反应与临床免疫学会推荐的变应原特异性免疫治疗(allergen-specific immunotherapy,SIT)是目前唯一针对病因有效的预防治疗[4],研究发现免疫耐受是SIT中的重要环节,其中调节性T细胞(Treg,regulatory T cells)起着关键作用,但其机制尚未完全阐述清楚[5-6]。因此建立标准哮喘免疫耐受模型,研究其确切机制对于防控哮喘有重要意义。目前国内外验证诱导免疫耐受成功与否的指标主要包括:检测外周免疫器官内T、B淋巴细胞再次接触抗原时的增殖情况;Treg的检测及免疫耐受相关的抑制性细胞因子IL-10、TGF-β的检测。目前国内外哮喘免疫耐受模型鲜有报道,我们采取大剂量卵白蛋白连续皮下注射的方式建立小鼠哮喘免疫耐受模型,通过验证免疫耐受相关指标表明建模成功,并对哮喘免疫耐受机制进行了初步探讨,现报告如下。
1 材料与方法 1.1 材料 1.1.1 实验动物清洁级BALB/c小鼠18只,雌性,6~8周龄,体质量16~20 g,北京华阜康生物科技股份有限公司提供,用随机数字表法分成3组:哮喘免疫耐受模型组、哮喘对照组、正常对照组。每组6只。
1.1.2 主要试剂及设备鸡卵白蛋白(美国Sigma公司),氢氧化铝[Al(OH)3]、Mouse Th2 Cell Multi-Color Flow Cytometry Kit(美国R&D公司Catalog Number: FMC012)、FlowXTM Mouse Regulatory T Cell Multi-Color Flow Cytometry Kit(美国R&D公司 Catalog Number: FMC022),雾化器购自德国百瑞Pari-Master,雾化颗粒直径0.5~ 0.5 μm。标准酶标仪购自美国宝特公司,自动平衡离心机(德林诊断产品有限公司),日本Olympus公司光学显微镜;美国Becton Dickinson公司流式细胞仪。
1.2 方法 1.2.1 哮喘免疫耐受模型的建立实验动物分3组,每组6只。①哮喘免疫耐受模型组:0、7 d予OVA 10 μg+ Al(OH)3 2.25 mg溶于100 μL无菌生理盐水混合液小鼠腹腔注射致敏,21~25 d持续5 d予 大剂量OVA(V级)皮下注射[含1 mg OVA+ Al(OH)3 2 mg 的生理盐水200 μL];35、36、37 d予1% OVA(Ⅱ级)雾化激发。预实验中我们分别采取OVA 10、100 μg及1 mg给予皮下注射,发现小鼠对1 mg OVA可完全耐受,未发现致死性过敏反应,故采取1 mg OVA给予皮下免疫治疗。 ②哮喘对照组:于第0、7天予OVA(Ⅴ级)10 μg+ Al(OH)3 2.25 mg溶于100 μL无菌生理盐水混合 液小鼠腹腔注射致敏,35、36、37 d予1% OVA雾化激发,激发后小鼠出现烦躁不安、打喷嚏、呼吸急促、抓耳等表现。③正常对照组:小鼠予等量生理盐水及生理盐水雾化激发。
1.2.2 气道反应性检测各组小鼠在末次激发后24 h内进行气道反应性检测,小鼠清醒状态下通过体积描述法检测小鼠自主呼吸,待检测的小鼠首先倍增质量浓度(3.125、12.5、50 ng/mL)的乙酰胆碱(Ach)雾化3 min,休息2 min,然后连续记录读数5 min并取其平均值,气道高反应性曲线均以Ach相应浓度激发下的增强呼吸间歇(enhanced pause,Penh)值来反映,Penh=PEP/PIP×pause。
1.2.3 标本采集及处理各组小鼠末次激发后24 h后,腹腔注射1.5%戊巴比妥钠麻醉,摘除眼球放血并收集血清,-80 ℃保存待检。颈椎脱位处死,暴露颈部,分离气管并插入静脉留置针,将1 mL PBS注入灌洗区,反复灌洗5次并抽吸支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)注入离心管中计 量(回吸率在80%合格),4 ℃、1 500 r/min离心10 min,收集上清液-80 ℃保存备用。细胞沉淀重悬后用细胞计数板计数。剩余涂片,行HE染色,光学显微镜下行细胞分类计数。开胸取肺组织放入盛有4%多聚甲醛的瓶中固定,酒精脱水,石蜡包埋、切片,HE染色,显微镜下观察肺组织支气管及细支气管周围炎症、血管周围炎症、肺泡周围炎症的病理特点。
1.2.4 ELISA检测血清OVA特异性IgE;检测 BALF中IL-4、IFN-γ、IL-10(检测参照试剂盒说明书进行)。
1.2.5 流式细胞仪检测外周血CD4+CD25+Foxp3+Treg 占CD4+细胞的百分率取PBMC 1×106个,用2 mL Flow Cytometry Staining Buffe 洗涤细胞1次,加入blocking IgG 避光4 ℃孵育10 min以阻断细胞,各管加入10 μL CD4-FITC及10 μL CD25-APC antibodies或对应的同型对照避光4 ℃孵育30 min。用预冷的1× PBS洗细胞2次,用1× FoxP3 Fixation Buffer重悬细胞4 ℃孵育30 min。用预冷的1× FoxP3 Permeabilization and Wash Buffer洗细胞2次,各管加入10 μL FoxP3 antibody或rabbit IgG-PE isotype 4 ℃孵育30 min。用预冷的1×FoxP3 Permeabilization and Wash Buffe洗细胞2次,上流式细胞仪检测。
1.3 统计学分析计量资料以x±s表示,采用SPSS 13.0 统计分析软件进行分析。多组间样本采用单因素方差分析,两组间样本均数比较采用t检验。
2 结果 2.1 大剂量OVA免疫治疗致敏小鼠致气道反应性降低37 d末次激发后24 h内行气道反应性检测,各组小鼠先于清醒状态测定基础Penh值,然后用Ach不同浓度激发,分别记录3.125、12.5、50 ng/mL时对应的Penh值,雾化3 min,休息2 min,记录5 min,所得数值取平均值。结果:各组小鼠随着吸入Ach的浓度增加,其气道反应性也逐渐增加,但是增加的幅度不相同,如图所示:Ach的质量浓度从3.125 ng/mL开始至50 ng/mL,哮喘免疫耐受模型组的气道反应性较哮喘对照组明显减低(P<0.05,图 1)。
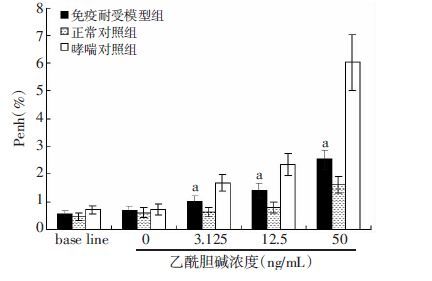
|
| a:P<0.05,与哮喘对照组比较 图 1 各组小鼠在不同浓度乙酰胆碱吸入时气道 反应性的变化 (n=6) |
2.2 大剂量OVA免疫治疗致致敏小鼠BLAF中嗜酸性细胞比率降低
42 d收集各组小鼠BLAF,离心,细胞重悬,取计数板计数细胞总数及行HE染色计数细胞分类计数。结果:哮喘对照组与正常对照组比较,细胞总数及嗜酸性粒细胞计数比率明显增高,差异有统计学意义(P<0.05);哮喘免疫耐受模型组BALF中细胞总数及嗜酸性粒细胞总数比率明显低于哮喘对照组,差异有统计学意义(P<0.05,表 1)。 表 1 各组小鼠BALF中细胞计数情况 (n=6,x±s)
| 组别 | 细胞总数(×106/L) | 嗜酸性粒细胞(×106/L) | 嗜酸性粒细胞百分比(%) |
| 哮喘免疫耐受模型组 | 64.46±4.27ab | 6.78±0.38ab | 10.32±0.26ab |
| 哮喘对照组 | 198.25±12.34b | 52.82±1.24b | 28.24±3.35b |
| 正常对照组 | 10.23±0.68 | 0.54±0.01 | 0.52±0.02 |
| a: P<0.05,与哮喘对照组比较;b: P<0.05,与正常对照组比较 | |||
2.3 大剂量OVA免疫治疗致致敏小鼠肺组织炎症反应减轻
42 d处死小鼠,取各组小鼠肺组织标本,4%多聚甲醛固定,酒精脱水,石蜡包埋,HE染色后观察各组小鼠肺组织病理改变。结果显示:正常对照组肺组织支气管、肺泡、肺血管结构清晰,基本未见炎症改变(图 2A);哮喘对照组见肺组织支气管下,血管周围明显炎症改变,肺间质及肺泡管腔内见嗜酸性粒细胞,支气管管腔内可见黏液栓,见炎性细胞浸润,血管壁充血水肿改变,上皮细胞坏死脱落(图 2B);哮喘免疫耐受模型组炎症反应较哮喘组明显减轻(图 2C)。

|
| A:正常对照组;B:哮喘对照组;C:哮喘免疫耐受模型组 图 2 各组小鼠肺组织病理变化 (HE×200) |
2.4 大剂量OVA免疫治疗致致敏小鼠BLAF中IL-4 及外周血中IgE降低,BLAF抑制性细胞因子IL-10增高
42 d处死小鼠,取各组小鼠外周血及BLAF标本,按试剂盒说明进行BALF中IL-4、IL-10、IFN-γ及血清OVA特异性IgE浓度检测。结果显示:哮喘对照组与正常对照组相比较,BALF中IL-10浓度降低,而IL-4浓度增高,血清OVA特异性IgE浓度增高,差异有统计学意义(P<0.05);哮喘免疫耐受模型组与哮喘对照组比较:BALF中IL-10浓度增高,而IL-4及血清OVA特异性IgE浓度均降低,差异有统计学意义(P<0.05)。INF-γ哮喘免疫耐受模型组与哮喘对照组比较差异无统计学意义(表 2)。
| 组别 | IL-4(ng/L) | INF-γ(pg/mL) | IL-10(pg/mL) | IgE(×103 U/L) |
| 哮喘免疫耐受模型组 | 36.52±3.25ab | 160.82±40.53 | 222.64±20.56ab | 22.26±1.95a |
| 哮喘对照组 | 75.22±4.63b | 146.76±29.87b | 132.80±9.14 | 44.43±2.28b |
| 正常对照组 | 22.14±1.24 | 248.53±32.52 | 140.64±6.21 | 18.12±2.21 |
| a: P<0.05,与哮喘对照组比较;b: P<0.05,与正常对照组比较 | ||||
2.5 大剂量OVA免疫治疗致致敏小鼠外周血中CD4+CD25+Foxp3+ T细胞百分率增加
42 d处死小鼠,取各组小鼠外周血标本行流式细胞仪检测各组小鼠外周血Treg占CD4+细胞的百分率。流式细胞仪检测结果显示哮喘免疫耐受模型组外周血中淋巴细胞亚群CD4+CD25+Foxp3+细胞百分率明显高于哮喘对照组(P<0.05,图 3)。
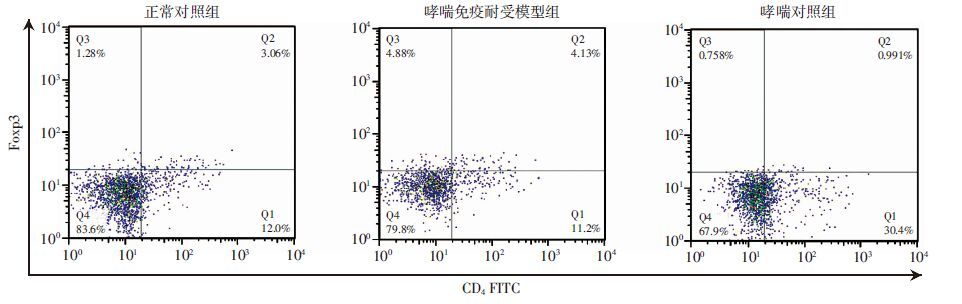
|
| 图 3 流式细胞仪检测各组小鼠CD4+CD25+Foxp3+细胞百分率变化 |
3 讨论
动物种类、品系的选择,合理的造模方法是建立动物模型成功与否的关键环节。BALB/c小鼠由于免疫遗传背景清楚,品系纯,价廉易得,可复制产生与人类哮喘相似的临床症状及病理学改变,故是目前常用的哮喘建模实验动物。目前临床上按给药方式不同哮喘变应原特异性免疫治疗常用的有皮下特异性免疫疗法(subcutaneous immunotherapy,SCIT)和舌下特异性免疫疗法(sublingual immunotherapy,SLIT)两种,其关键环节均是诱导致敏原特异性免疫耐受。SCIT是目前临床上应用最广泛、最主要的免疫疗法[7-8],虽然目前国内外有使用OVA鼻腔滴入或口服诱导哮喘小鼠免疫耐受的报道,但与目前临床上常用SCIT给药方式不同,不能真实反映临床上常用的SCIT诱导的免疫耐受过程。Liao等[9]的Meta分析也认为SLIT治疗虽然简便易行,并可减轻哮喘症状及降低IgE水平,但目前推荐用于治疗儿童哮喘临床证据不足。因此我们选用BALB/c小鼠作为建模对象,并采取皮下注射的方式来构建哮喘免疫动物模型。目前国内外文献报道:低浓度的OVA(10 μg)致敏小鼠并给予激发可产生过敏性哮喘病理改变,而高浓度的OVA连续给予可诱导小鼠发生免疫耐受,但皮下注射OVA免疫治疗的剂量、时间、疗程均报道不一[10-13]。目前国内外尚无统一标准的哮喘免疫耐受模型建立方法,因此我们在参考国外相关文献[14-15]基础上,依照临床上尘螨免疫治疗标准方案[16-17]设计了本实验:予低浓度的OVA致敏小鼠,然后连续大剂量OVA皮下注射,结果发现小鼠气道反应性、BALF中嗜酸性细胞数及血清OVA特异性IgE水平明显降低,同时肺组织炎症反应较哮喘组明显减轻;Th2细胞因子IL-4百分比明显低于哮喘组。表明连续大剂量皮下注射OVA可诱导免疫耐受形成,减轻气道炎症反应及哮喘症状。这也证明我们构建小鼠哮喘免疫耐受模型成功。
免疫耐受是机体免疫系统在接触抗原性物质后产生特异性免疫无应答或低应答状态。临床中SIT治疗并不是对所有患者均有效,可能会出现程度不等的副作用,因此建立哮喘免疫耐受模型对深入研究其机制有重要意义。SIT的临床应用虽然已有一个世纪,然而它的作用机制仍未完全阐明。过去研究认为SIT治疗机制可能与增加体内IgG4,封闭肥大细胞、嗜碱性粒细胞脱颗粒,纠正Th1/Th2细胞失衡有关,而目前研究认为,IgG4产生可能是一种旁观效应结果[18-19]。对于纠正Th1/Th2细胞失衡的作用,许多报道不一致,特别是SIT治疗对Th1类细胞的影响报道不一[20],因此纠正Th1/ Th2细胞失衡来实现SIT的治疗作用已经逐渐失去地位。本研究也发现免疫耐受形成时IFN-γ在哮喘组与免疫耐受组无明显变化,同时近年研究发现用Th1/Th2细胞失衡也不能完全解释哮喘发病,代之的是Treg的作用受到关注。健康人气道在反复吸入过敏原后,CD4+T淋巴细胞对过敏原的刺激分化成nTreg而发生耐受,不会导致T淋巴细胞分化成效应性T细胞始动发病过程,因此认为Treg在气道免疫耐受中有重要地位[5, 21],Treg可以通过多种机制参与免疫耐受。目前证实在SIT治疗中树突状细胞(dendritic cells,DC)捕获并呈递抗原给Th0细胞可诱导Th0细胞向Treg分化增加,而向效应性T细胞分化减少。本研究用大剂量OVA免疫治疗小鼠,发现其血液中Treg明显增高,也证实了Treg参与了大剂量OVA免疫治疗诱导的免疫耐受。免疫耐受组中Treg所占CD4+细胞的百分率明显增高,也证明Treg在免疫耐受中的作用。Treg可分为自然发生的Treg(nTreg)及可诱导发生的Treg(iTreg);Foxp3+是Treg主要的调控基因,iTreg可通过分泌细胞因子TGF-β、IL-10发挥免疫调节功能,使机体产生免疫耐受[22]。IL-10具有巨大潜在的抗变应性的性质,几乎可以抑制所有促炎因子的合成,可以抑制嗜酸性粒细胞(EOS)在炎症部位聚集,并阻止过敏反应的发生和诱导免疫无反应性[14]。本实验研究发现,大剂量OVA免疫治疗后BALF中IL-10明显增高,说明IL-10参与了哮喘的免疫耐受,这也和Akbari等[23]研究相一致。但由于部分Th2类细胞及CD4-T细胞也可分泌IL-10,本实验中IL-10的产生是否由Treg产生还需要进一步研究。同时TGF-β是否参与了大剂量OVA的免疫治疗也尚需要进一步研究。
综上所述,我们用皮下OVA大剂量注射诱导免疫耐受成功建立了小鼠哮喘免疫耐受模型,同时初步的研究发现Treg及IL-10参与了哮喘小鼠哮喘免疫耐受的形成。但是目前的哮喘免疫耐受模型特征尚不能完全反映人类哮喘SIT治疗的过程及本质,这需要更多临床及实验室研究去探讨,制备出更接近更能反映人类哮喘免疫耐受的动物模型,并研究其确切机制,使更多哮喘患者受益。
| [1] | Global Strategy for Asthma Management and Prevention, Global Initiative for Asthma.[DB/OL]. (2015-04). |
| [2] | Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010[J]. Lancet,2012, 380 (9859) : 2095 –2128. DOI:10.1016/S0140-6736(12)61728-0 |
| [3] | 全国儿科哮喘协作组, 中国疾病预防控制中心环境与健康相关产品安全所. 第三次中国城市儿童哮喘流行病学调查[J]. 中华儿科杂志,2013, 51 (10) : 729 –735. DOI:10.3760/cma.j.issn.0578-1310.2013.10.003 |
| [4] | Papadopoulos N G, Arakawa H, Carlsen K H, et al. International consensus on (ICON) pediatric asthma[J]. Allergy,2012, 67 (8) : 976 –997. DOI:10.1111/j.1398-9995.2012.02865.x |
| [5] | Boudousquie C, Pellaton C, Barbier N, et al. CD4+CD25+ T cell depletion impairs tolerance induction in a murine model of asthma[J]. Clin Exp Allergy,2009, 39 (9) : 1415 –1426. DOI:10.1111/j.1365-2222.2009.03314.x |
| [6] | Akdis C A, Akdis M. Mechanisms of allergen-specific immunotherapy and immune tolerance to allergens[J]. World Allergy Organ J,2015, 8 (1) : 17 . DOI:10.1186/s40413-015-0063-2 |
| [7] | Chelladurai Y, Suarez-Cuervo C, Erekosima N, et al. Effectiveness of subcutaneous versus sublingual immunotherapy for the treatment of allergic rhinoconjunctivitis and asthma: a systematic review[J]. J Allergy Clin Immunol Pract,2013, 1 (4) : 361 –369. DOI:10.1016/j.jaip.2013.04.005 |
| [8] | Ring J, Gutermuth J. 100 years of hyposensitization: history of allergen-specific immunotherapy (ASIT)[J]. Allergy,2011, 66 (6) : 713 –724. DOI:10.1111/j.1398-9995.2010.02541.x |
| [9] | Liao W, Hu Q, Shen L L, et al. Sublingual Immunotherapy for Asthmatic Children Sensitized to House Dust Mite: A Meta-Analysis[J]. Medicine (Baltimore),2015, 94 (24) : e701 . DOI:10.1097/MD.0000000000000701 |
| [10] | Yukselen A, Kendirli S G. Role of immunotherapy in the treatment of allergic asthma[J]. World J Clin Cases,2014, 2 (12) : 859 –865. DOI:10.12998/wjcc.v2.i12.859 |
| [11] | Noviello-Mde L, Batista N V, Dourado L P, et al. Prolonged antigen ingestion by sensitized mice ameliorates airway inflammation[J]. ISRN Allergy,2011, 2011 : 818239 . DOI:10.5402/2011/818239 |
| [12] | 湛孝东, 姜玉新, 李良怿, 等. 不同浓度卵蛋白变应原对小鼠哮喘模型建立的影响[J]. 中国实验动物学报,2012, 20 (4) : 16 –20. DOI:10.3969/j.issn.1005-4847.2012.04.003 |
| [13] | Zosky G R, von-Garnier C, Stumbles P A, et al. The pattern of methacholine responsiveness in mice is dependent on antigen challenge dose[J]. Respir Res,2004, 5 : 15 . DOI:10.1186/1465-9921-5-15 |
| [14] | Vissers J L, van-Esch B C, Hofman G A, et al. Allergen immunotherapy induces a suppressive memory response mediated by IL-10 in a mouse asthma model[J]. J Allergy Clin Immunol,2004, 113 (6) : 1204 –1210. DOI:10.1016/j.jaci.2004.02.041 |
| [15] | Taher Y A, Piavaux B J, Gras R, et al. Indoleamine 2, 3-dioxygenase-dependent tryptophan metabolites contribute to tolerance induction during allergen immunotherapy in a mouse model[J]. J Allergy Clin Immunol,2008, 121 (4) : 983 –991. DOI:10.1016/j.jaci.2007.11.021 |
| [16] | 宋薇薇, 林小平, 柴若楠. 标准化屋尘螨变应原特异性免疫治疗变应性鼻炎的疗效评估[J]. 临床耳鼻咽喉头颈外科杂志,2014, 28 (5) : 300 –302. DOI:10.13201/j.issn.1001-1781.2014.05.006 |
| [17] | 王红玉, 林小平, 郝创利, 等. 标准化屋尘螨疫苗免疫治疗对变应性支气管哮喘的疗效[J]. 中华结核和呼吸杂志,2006, 29 (10) : 679 –687. DOI:10.3760/j:issn:1001-0939.2006.10.009 |
| [18] | Taher Y A, Henricks P A, van-Oosterhout A J. Allergen-specific subcutaneous immunotherapy in allergic asthma: immunologic mechanisms and improvement[J]. Libyan J Med,2010, 5 : 5303 . DOI:10.3402/ljm.v5i0.5303 |
| [19] | Shirinbak S, Taher Y A, Maazi H, et al. Suppression of Th2-driven airway inflammation by allergen immunotherapy is independent of B cell and Ig responses in mice[J]. J Immunol,2010, 185 (7) : 3857 –3865. DOI:10.4049/jimmunol.0903909 |
| [20] | Kowalski M L, Jutel M. Mechanisms of specific immunotherapy of allergic diseases[J]. Allergy,1998, 53 (5) : 485 –492. |
| [21] | Martin H, Taube C. Regulatory T cells and regulation of allergic airway disease[J]. Am J Clin Exp Immunol,2012, 1 (2) : 166 –178. |
| [22] | Robinson D S. Regulatory T cells and asthma[J]. Clin Exp Allergy,2009, 39 (9) : 1314 –1323. DOI:10.1111/j.1365-2222.2009.03301.x |
| [23] | Akbari O, DeKruyff R H, Umetsu D T. Pulmonary dendritic cells producing IL-10 mediate tolerance induced by respiratory exposure to antigen[J]. Nat Immunol,2001, 2 (8) : 725 –731. DOI:10.1038/90667 |



