2. 400014 重庆,重庆医科大学附属儿童医院:儿童发育疾病研究省部共建教育部重点实验室
2. Key Laboratory of Developmental Disease in Childhood of Ministry of Education, Children’s Hospital of Chongqing Medical University, Chongqing, 400014, China
心脏发育是一个极其复杂的过程,整个过程依赖一系列心脏发育核心转录因子如GATA4、MEF2C、Nkx2.5、Tbx5等的精确调控[1-2]。GATA4在心脏发育早期便开始表达,其缺失、突变、表达异常均将导致先天性心脏病的发生。
CBP/P300作为组蛋白乙酰化酶的两个亚型,广泛表达于多种组织,并介导组蛋白的乙酰化修饰,参与基因表达调控。CBP/P300可在心肌祖细胞中表达,且其活性受到抑制后可导致多种心脏发育核心转录因子表达的降低[3-4],提示CBP/P300可能通过介导组蛋白乙酰化修饰参与调控GATA4的表达。为验证这一科学假说,本研究利用小鼠胚胎心脏组织研究正常胚胎心脏发育过程中GATA4的时序表达及其基因启动子区组蛋白H3K9乙酰化修饰水平的变化规律,并利用CBP/P300的特异性抑制剂CBP30干预心肌祖细胞,证实CBP/P300介导的组蛋白H3K9乙酰化修饰可调控GATA4的表达,通过探讨其具体作用机制,为进一步阐明胚胎心脏发育过程中GATA4的表观遗传调控网络奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验动物成年健康SPF级昆明小鼠,由重庆医科大学实验动物中心提供。实验细胞:心肌祖细胞,由美国芝加哥大学分子肿瘤实验惠赠[5]。
1.1.2 主要试剂高纯度总RNA提取试剂盒(百泰克,北京),Real-time PCR逆转录试剂盒(TaKaRa, 日本),SYBR Green试剂盒(KAPA,美国),CHIP试剂盒(Abcam,英国),核染色质提取试剂盒(Abcam,英国),CBP30(Selleck,美国),CHIP级抗H3K9ac抗体、抗CBP抗体(Abcam,英国),CHIP级抗P300抗体(Millipore,英国),胎牛血清和DMEM-F12培养基(HyClone,美国),胰蛋白酶(Gibco,澳大利亚),荧光定量PCR仪(Bio-Rad,美国),超声仪(Diagenode, 美国)。
1.2 方法 1.2.1 胎鼠心脏标本提取下午5:00按雌 ∶雄=2 ∶1 合笼,次日早上检查阴栓,以观察到阴栓者计为胎龄0.5 d(E0.5) 。用二氧化碳处死孕鼠,取E11.5到新生0.5 d胎鼠心脏,并冻存于-80 ℃冰箱中。
细胞培养及干预:复苏心肌祖细胞,所用培养基为含10%胎牛血清和1%青霉素的DMEM/F12培养基,在CO2浓度为5%的37 ℃恒温培养箱中培养。在6孔板和直径100 mm培养皿中干预心肌祖细胞,分为空白对照组(正常对照组),阴性对照组(DMSO组)和处理组(CBP30组),其中处理组又分为不同浓度组(0.5、1、2 μmol/L和4 μmol/L)和不同时间组(6、12、24 h和36 h)。
1.2.2 总RNA提取及cDNA合成取E11.5到新生0.5 d胎鼠心脏组织50 mg于1.5 mL EP管中,加入1 mL组织裂解液,放入组织匀浆器中匀浆5 min,按照RNA提取试剂盒说明书操作,提取心脏组织总RNA。CBP30干预心肌祖细胞后,向6孔板中加入1 mL 组织裂解液,按照RNA提取试剂盒说明书操作,提取细胞总RNA。经核酸蛋白测定仪测定D(260) /D(280) 比值确定总RNA浓度,取800 ng RNA按照TaKaRa逆转录试剂盒操作说明将RNA逆转录为cDNA,反应体系为20 μL,反应条件为:42 ℃ 30 min,85 ℃ 5 s,4 ℃保存,所得cDNA冻存于-20 ℃备用。
1.2.3 染色质免疫共沉淀(CHIP)分别取E11.5、 E14.5、E17.5胎鼠心脏组织50~70 mg,1%甲醛交联;对培养在100 mm培养皿中的心肌祖细胞进行CBP30干预后(2 μmol/L,6 h),1%甲醛对细胞进行交联。用超声破碎仪切割DNA,通过琼脂糖凝胶电泳检测,使切割的DNA片段长度在200~1 000 bp之间。分别用CHIP级抗H3K9ac、P300、CBP抗体进行染色质免疫共沉淀,得到的纯化DNA冻存于-20 ℃备用。
1.2.4 实时荧光定量PCR(Q-PCR)分别以RNA逆转录产物cDNA和CHIP产物纯化DNA为模板进行Q-PCR反应,按SYBR Green说明书进行操作。Q-PCR反应体系为10 μL(2×SYBR qPCR Master Mix solution:5 μL,正向引物:0.1 μL,反向引物:0.1 μL,DNA模版:1 μL,ddH2O:3.8 μL)。引物均由Primer Premier 5软件设计,由上海生工生物工程股份有限公司合成。GATA4基因引物序列为:上游 5′-CCCTCCCGCAC-GATTTCT-3′,下游 5′-AGAGGCCCAACTCGCTCAA-3′;β-actin基因引物序列为:上游 5′-CACACCCGCCACCAGTTCG-3′,下游 5′-GTCCTTCTGACCCATTCCCACC-3′;GATA4基因启动子区引物序列为:上游 5′-CACTGACGCCGACTCCAAACTAA-3′,下游 5′-CGACTGGG-GTCCAATCAAAAGG-3′。Q-PCR反应条件为:预变性95℃ 2 min,变性95 ℃ 10 s,退火60 ℃ 10 s,延伸72 ℃ 15 s,45个循环,每个样品均重复3次。所得数据由实时荧光定量PCR仪自带基于pfaffl原理的相对定量数据分析软件分析。
1.3 统计学分析采用SPSS 17.0统计软件,所有数据以x ±s表示,采用单因素方差分析进行组间比较,P<0.05为差异具有统计学意义。
2 结果 2.1 心脏发育核心转录因子GATA4在小鼠胚胎心脏发育过程中的动态表达水平GATA4在胚胎心脏发育过程中呈由低到高的动态表达,GATA4 mRNA表达水平,E14.5组高于E11.5组,两两比较差异具有统计学意义(P<0.05,图 1)。
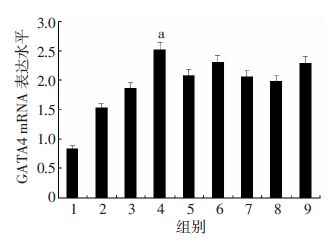
|
| 1:E11.5组;2:E12.5组;3:E13.5组;4:E14.5组;5:E15.5组;6:E16.5组;7:E17.5组;8:E18.5组;9:新生0.5 d组 a:P<0.05,与E11.5组比较 图 1 RT-PCR检测小鼠胚胎心脏发育过程中GATA4 mRNA时序表达水平 |
2.2 胚胎心脏发育过程中GATA4启动子区组蛋白H3K9ac水平及与CBP/P300结合水平
CHIP-QPCR结果显示,E14.5组(1.168 0±0.073 4) GATA4启动子区抗H3K9ac抗体的CHIP沉淀DNA量明显高于E11.5组[(0.813 6±0.018 9) ,P<0.05]。E14.5组抗P300(1.822 2±0.304 7) 和抗CBP抗体(1.382 2±0.124 3) 的CHIP沉淀DNA量明显高于E11.5组[分别为(0.978 7±0.036 9) 、(0.879 4± 0.171 6) ,P<0.05]。
2.3 CBP30干预心肌祖细胞对GATA4表达的影响经RT-PCR检测,不同浓度(0.5、1、2、4 μmol/L)CBP30分别使心肌祖细胞GATA4表达量较正常对照组降低,且以2 μmol/L降低最明显(P<0.05,图 2A)。2 μmol/L CBP30干预心肌祖细胞6、12、24、36 h后,GATA4表达量较正常对照组降低,且以6 h降低最明显(P<0.05,图 2B)。
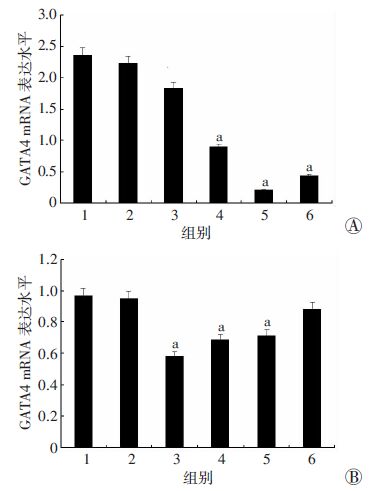
|
| A:RT-PCR检测不同浓度CBP30处理心肌祖细胞后GATA4 表达水平 1:DMSO组;2:正常对照组;3:0.5 μmol/L CBP30组;4:1 μmol/L CBP30组;5:2 μmol/L CBP30组;6:4 μmol/L CBP30组;B:RT-PCR检测不同时间CBP30处理心肌祖细胞后GATA4表达水平 1:DMSO组;2:正常对照组;3:6 h组;4:12 h组;5:24 h组;6:36 h组 a:P<0.05,与正常对照组比较 图 2 RT-PCR检测CBP30处理心肌祖细胞后GATA4表达情况 |
2.4 CBP30干预心肌祖细胞后GATA4启动子区组蛋白H3K9ac水平及与CBP/P300结合水平
CHIP-QPCR结果显示,CBP30组GATA4启动子区抗H3K9ac抗体的CHIP沉淀DNA量明显低于正常对照组(P<0.05,图 3)。CBP30组抗P300和抗CBP抗体的CHIP沉淀DNA量明显低于正常对照组(P<0.05,图 4)。
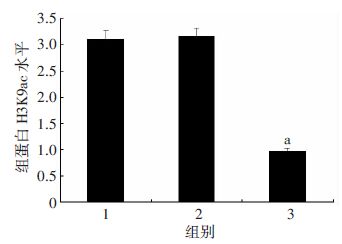
|
| 1:DMSO组;2:正常对照组;3:CBP30组 a:P<0.05,与正常对照组比较 图 3 CHIP-QPCR检测心肌祖细胞中GATA4启动子区组蛋白H3K9ac水平 |
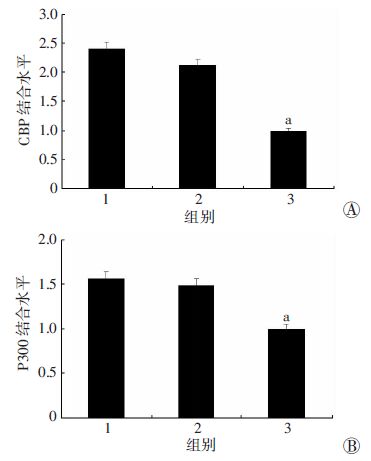
|
| 1:DMSO组;2:正常对照组;3:CBP30组 A:CHIP-QPCR检测GATA4启动子区与CBP结合水平;B:CHIP-QPCR检测GATA4启动子区与P300结合水平 a:P<0.05,与正常对照组比较 图 4 CHIP-QPCR检测心肌祖细胞中GATA4启动子区与CBP/P300结合水平 |
3 讨论
先天性心脏病是人类最常见的出生缺陷性疾病,报道显示,全球每1 000个新生儿中,有10~12个患有先天性心脏病[6]。在众多的先天性心脏病患儿中,发生基因突变或染色体变异的仅占20%,其余80%患儿的基因与染色质无异常,提示表观遗传修饰在很大程度上影响着心脏发育[7]。研究表明,胚胎期间GATA4 的缺失或突变均可引起心脏发育异常[8-9],而胚胎后期或生后GATA4失活,则可引起严重心功能缺陷,导致心衰发生[10]。本研究发现,GATA4表达量在胚胎心脏发育早期和中期随着心脏发育成熟而增加,在E14.5天达到峰值,文献[11]报道此时心脏正处于腔室特化和生长期,表明GATA4与心脏发育成熟密切相关。本研究还发现,随着GATA4在胎鼠心脏中表达量增加,GATA4启动子区组蛋白H3K9ac水平及与CBP/P300结合水平也随之升高,提示GATA4在胎鼠心脏中表达可能受到组蛋白H3K9和CBP/P300的调控。GATA4的正确时序表达及正常活性是心脏结构发育及功能维持的基础。表观遗传是调控基因时序表达的主要机制[12],但针对GATA4的具体表观遗传调控方式尚不清楚。
组蛋白乙酰化修饰由组蛋白乙酰化酶催化,可使染色质的空间结构变得疏松, 利于基因表达。CBP/P300属于组蛋白乙酰化酶的两个亚型,广泛参与各种组蛋白的乙酰化修饰。如抑制P300的乙酰化酶活性可降低组蛋白H3乙酰化水平[13]。本课题组前期研究发现,用酒精干预孕鼠可提高胎鼠心肌细胞中组蛋白H3K9的整体乙酰化水平,促进GATA4表达,表明组蛋白H3K9的乙酰化修饰对GATA4的表达有调控作用,但其具体调控机制不清。本研究从介导组蛋白乙酰化修饰的CBP/P300入手,通过使用CBP/P300特异性抑制剂CBP30干预心肌祖细胞。CBP30可竞争性与CBP/P300的布罗莫结构域结合[14],阻碍CBP/P300与其辅助因子CREB结合形成转录复合物,从而抑制CBP/P300与基因启动子区结合。本研究发现,在CBP30干预组,伴随心肌祖细胞GATA4表达量的下降,GATA4启动子区的CBP/P300结合水平明显降低,表明CBP/P300在GATA4启动子区受到了抑制,而此时GATA4启动子区组蛋白H3K9乙酰化水平也有显著降低。上述结果表明CBP/P300可通过介导启动子区组蛋白H3K9乙酰化调控GATA4的表达。
本研究明确了GATA4在小鼠胚胎心脏发育过程中的时序表达趋势,从表观遗传学组蛋白乙酰化修饰的角度探讨了GATA4的调控机制,为GATA4异常表达导致的心脏发育障碍提供了新的治疗靶点。
| [1] | Kodo K, Yamagishi H. A decade of advances in the molecular embryology and genetics underlying congenital heart defects[J]. Circ J,2011, 75 (10) : 2296 –2304. DOI:10.1253/circj.cj-11-0636 |
| [2] | Nemer M. Genetic insights into normal and abnormal heart development[J]. Cardiovasc Pathol,2008, 17 (1) : 48 –54. DOI:10.1016/j.carpath.2007.06.005 |
| [3] | Pan B, Zhu J, Lv T, et al. Alcohol consumption during gestation causes histone3 lysine9 hyperacetylation and an alternation of expression of heart development-related genes in mice[J]. Alcohol Clin Exp Res,2014, 38 (9) : 2396 –2402. DOI:10.1111/acer.12518 |
| [4] | Sun H, Yang X, Zhu J, et al. Inhibition of p300-HAT results in a reduced histone acetylation and down-regulation of gene expression in cardiac myocytes[J]. Life Sci,2010, 87 (23/26) : 707 –714. DOI:10.1016/j.lfs.2010.10.009 |
| [5] | Zhu G H, Huang J, Bi Y, et al. Activation of RXR and RAR signaling promotes myogenic differentiation of myoblastic C2C12 cells[J]. Differentiation,2009, 78 (4) : 195 –204. DOI:10.1016/j.diff.2009.06.001 |
| [6] | Miranovic V. The incidence of congenital heart disease: previous findings and perspectives[J]. Srp Arh Celok Lek,2014, 142 (3/4) : 243 –248. DOI:10.2298/sarh1404243m |
| [7] | Blue G M, Kirk E P, Sholler G F, et al. Congenital heart disease: current knowledge about causes and inheritance[J]. Med J Aust,2012, 197 (3) : 155 –159. DOI:10.5694/mja12.10811 |
| [8] | Jay P Y, Bielinska M, Erlich J M, et al. Impaired mesenchymal cell function in Gata4 mutant mice leads to diaphragmatic hernias and primary lung defects[J]. Dev Biol,2007, 301 (2) : 602 –614. DOI:10.1016/j.ydbio.2006.09.050 |
| [9] | Watt A J, Battle M A, Li J, et al. GATA4 is essential for formation of the proepicardium and regulates cardiogenesis[J]. Proc Natl Acad Sci U S A,2004, 101 (34) : 12573 –12578. DOI:10.1073/pnas.0400752101 |
| [10] | Oka T, Maillet M, Watt A J, et al. Cardiac-specific deletion of Gata4 reveals its requirement for hypertrophy, compensation, and myocyte viability[J]. Circ Res,2006, 98 (6) : 837 –845. DOI:10.1161/01.RES.0000215985.18538.c4 |
| [11] | Olson E N, Schneider M D. Sizing up the heart: development redux in disease[J]. Genes Dev,2003, 17 (16) : 1937 –1956. DOI:10.1101/gad.1110103 |
| [12] | Zhou Y, Kim J, Yuan X, et al. Epigenetic modifications of stem cells: a paradigm for the control of cardiac progenitor cells[J]. Circ Res,2011, 109 (9) : 1067 –1081. DOI:10.1161/CIRCRESAHA.111.243709 |
| [13] | 孙慧超, 朱静, 吕铁伟, 等. 姜黄素对小鼠心脏发育相关基因表达的影响及其表观遗传调控机制[J]. 基础医学与临床,2011, 31 (9) : 959 –964. |
| [14] | Hammitzsch A, Tallant C, Fedorov O, et al. CBP30, a selective CBP/p300 bromodomain inhibitor, suppresses human Th17 responses[J]. Proc Natl Acad Sci U S A,2015, 112 (34) : 10768 –10773. DOI:10.1073/pnas.1501956112 |



