缺血性心脏病严重危害人类健康,及时、有效地恢复心脏的血液供应是治疗缺血性心脏病最为有效的方法。通过再灌注来恢复心脏血流的过程中,心肌功能并未得到有效的恢复,并且由于活性氧自由基的大量积累,甚至会造成更为严重的损伤,产生缺血/再灌注(ischemia/reperfusion,I/R)损伤[1]。心肌I/R损伤是一个复杂的病理过程,涉及氧化应激、炎症反应和细胞凋亡等多种机制[2]。因此,探讨心肌I/R损伤相关信号传导通路,寻找新的治疗靶点,对于阻止和预防心肌I/R损伤有着非常重要的临床意义。
目前,吸入麻醉药预处理在心肌I/R损伤方面的研究已受到关注[3]。异氟烷是临床常用的一种吸入性全身性麻醉药,其预处理对心肌的保护作用已被报道[4-5]。Nrf2被认为是细胞氧化应激反应中的关键调控因子,可有效保护心肌组织[6]。然而,异氟烷能否通过Nrf2-ARE通路来保护与氧化应激密切相关的心肌免受I/R损伤,尚鲜见报道。本实验通过H9c2细胞缺氧-复氧模拟制作心肌I/R损伤模型,以Nrf2为靶点,探讨Nrf2-ARE信号通路在异氟烷保护H9c2细胞中的作用。
1 材料与方法 1.1 主要试剂大鼠胚胎H9c2心肌细胞系购自中国科学院上海细胞库;DMEM培养基购自美国Hyclone公司;胎牛血清FBS购于美国Gibco公司;细胞凋亡检测试剂盒、MDA水平测定试剂盒、GSH水平测定试剂盒,均购自南京建成生物工程研究所;兔抗大鼠Nrf2抗体(货号:sc-722)、兔抗大鼠HO-1抗体(货号:sc-7696)、兔抗大鼠NQO1抗体(货号:sc-16464)、兔抗大鼠GAPDH抗体(货号:sc-20357),以及HRP标记的山羊抗兔二抗(货号:sc-2028)均购自Santa Cruz生物科技公司;TRIzol试剂盒、转染试剂LipofetamineTM 2000转染试剂与逆转录试剂盒均为美国Invitrogen公司提供;Nrf2 siRNA(货号:sc-37049)和非特异性siRNA(货号:sc-37007)均由Santa Cruz生物科技公司提供。
1.2 分组将细胞分为空白对照组、缺氧-复氧组、异氟烷预处理组、转染Nrf2 siRNA组、转染非特异性siRNA组(Scramble组)、异氟烷预处理的Scramble组和异氟烷预处理的siRNA组。空白对照组细胞在含5% CO2和95%空气的培养箱中,于37 ℃培养;缺氧-复氧组细胞在100% N2培养8 h后,恢复正常的氧气浓度培养24 h;异氟烷处理组细胞分别用1%、1.5%、2%的异氟烷(溶解在DMEM培养液中)预处理3 h,随后进行上述缺氧-复氧实验;Nrf2 siRNA组转染Nrf2 siRNA进行缺氧-复氧实验,不经异氟烷预处理;Scramble组转染非特异性siRNA进行缺氧-复氧实验,不经异氟烷预处理;异氟烷预处理的Scramble组用2%异氟烷预处理3 h 后将转染非特异性siRNA的细胞进行细胞缺氧-复氧处理;异氟烷预处理的siRNA组用2%异氟烷预处理3 h后将转染Nrf2 siRNA的细胞进行细胞缺氧-复氧处理。
1.3 心肌细胞模拟I/R损伤模型的建立模型制备参照文献[7]中所描述的方法进行。细胞在模拟缺血环境的培养液中培养。培养液 (mmol/L)含HEPES 5,2-deoxy-D-glucose 10,NaCl 139,KCl 12,MgCl2 0.5,CaCl2 1.3,乳酸 20,pH=6.2,37 ℃下通入100% N2(O2 <1%),培养8 h。随后更换为含10% FBS的DMEM/M199培养液在正常含氧量下培养,模拟再灌注状态。
1.4 siRNA转染于6孔板中培养的H9c2细胞长满约80%时,更换无血清培养基,按照转染试剂的操作要求,采用LipofetamineTM 2000分别将Nrf2 siRNA或非特异性siRNA(Scramble)转染细胞。
1.5 MTT检测细胞存活率取对数期生长的H9c2细胞接种于96孔板,每孔200 μL,含2×104个细胞。细胞贴壁后,用无血清培养液代替旧培养基培养24 h。取出培养板,每孔加入MTT溶液(5 g/L)20 μL,于培养箱继续培养4 h后弃去上清,加入DMSO 150 μL,低速振荡10 min充分溶解结晶物。用酶联免疫吸附仪检测490 nm下的光密度值。细胞存活率=各组D(490)值/空白对照组D (490) 值×100%。
1.6 TUNEL染色检测细胞凋亡按照细胞凋亡检测试剂盒操作,具体参考Liu等[8]实验方法。用4%多聚甲醛于室温下固定各组细胞15 min,用PBS洗去多余的多聚甲醛,然后加新配制的破膜液处理5 min,每个样本加入混合好的TUNEL反应液,封闭液封闭,在37 ℃避光孵育1 h。显微镜下观察并统计凋亡细胞数量。
1.7 细胞氧化应激指标测定收集细胞培养液,按照MDA试剂盒操作要求测定MDA水平。按比例将试剂一、试剂二、试剂三、细胞培养液及MDA标准品涡旋混匀,在95 ℃下水浴40 min,取出冷却后4 000 r/min离心10 min,吸取上清液,在532 nm处测定光密度值,根据D(532)值计算MDA浓度。
GSH水平参照GSH试剂盒说明书进行。将试剂一、试剂二、试剂三、细胞培养液及GSH标准品混匀,室温静止5 min后在412 nm处测定光密度值,并计算GSH浓度。
1.8 qRT-PCR检测Nrf2、HO-1和NQO1基因的mRNA表达用TRIzol提取试剂盒提取H9c2细胞总RNA后,进行RNA浓度和纯度检测,接着逆转录合成cDNA。大鼠Nrf2上游引物序列:5′-GACCTAAAGCACAG-CCAACACAT-3′,下游引物序列:5′-CTCAATCGGCTT-GAATGTTTGTC-3′,产物大小:181 bp;HO-1上游引物序列:5′-AAGAG-GCCAAGACTGCGTTC-3′,下游引物序列:5′-GGTG-TCATGGGTCAGCAGC-3′,产物大小:435 bp;NQO1上游引物序列:5′-GGATTGGACCGAGC-TGGAA-3′,下游引物序列:5′-AATTGCAGTGAA-GATGAAGGCAAC-3′,产物大小:1 495 bp;GAPDH 为内参,上游引物序列:5′-GCACCGTCAAGGCTGA-GAAC-3′,下游引物序列:5′-ATGGTGGTGAAGACG-CCAGT-3′,产物大小:138 bp。Real-Time PCR反应体系20 μL(SYBR Premix Ex TaqTM 10 μL;上、下游引物各0.5 μL;2 μL cDNA;ddH2O 7 μL)。采用相对定量2-ΔΔCt法分析数据。
1.9 Western blot检测Nrf2、HO-1和NQO1的蛋白表达抽提细胞总蛋白,并用BCA法定量。取20 μg上样进行12%的SDS-PAGE凝胶电泳,电泳后转膜,用封闭液(含5%脱脂奶粉、2% BSA、0.2% Tween-20的PBS液)于室温下封闭2 h,加入一抗4 ℃孵育过夜,包括兔抗大鼠Nrf2(1 ∶500),兔抗大鼠HO-1(1 ∶1 000)和兔抗大鼠NQO1(1 ∶500),洗膜后加入二抗(1 ∶4 000) 孵育1 h,用ECL系统进行发光和观察。
1.10 统计学分析采用SPSS 19.0统计软件,两组间比较采用t检验,多组间比较采用单因素方差分析,方差齐者采用LSD检验,方差不齐者用Dunnett’s T3检验,结果表示为x ±s。
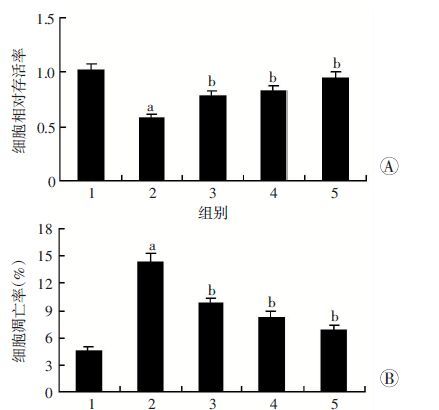
2 结果 2.1 异氟烷能够逆转缺氧-复氧处理对H9c2细胞存活率和凋亡的影响缺氧-复氧处理后,H9c2细胞存活率显著低于空白对照组(P<0.01),与缺氧-复氧组比较,1%、1.5%、2%异氟烷处理可使H9c2细胞的存活率逐渐升高(P<0.05,图 1A)。
|
| 1:空白对照组;2:缺氧-复氧组;3:1%异氟烷预处理组;4:1.5% 异氟烷预处理组;5:2%异氟烷预处理组;a:P<0.01,与空白对照组比较;b:P<0.05,c:P<0.01,与缺氧-复氧组比较 图 1 MTT法和TUNNEL染色分别检测不同浓度异氟烷对缺氧-复氧损伤H9c2细胞相对存活率(A)和凋亡率(B)的影响 |
与空白对照组比较,缺氧-复氧损伤可显著增加细胞凋亡(P<0.01),与缺氧-复氧组比较,1%、1.5%、2%的异氟烷预处理可使细胞凋亡率逐渐下降(P<0.05,图 1B)。
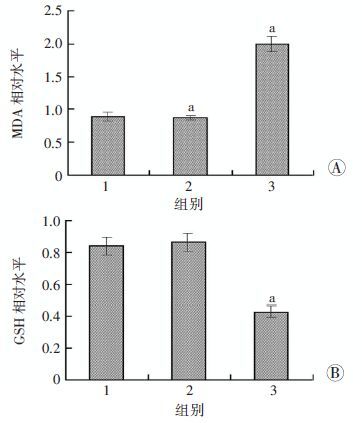
2.2 异氟烷能够减弱缺氧-复氧引起的氧化损伤缺氧-复氧组MDA水平与空白对照组比较显著升高(P<0.01),然而,与缺氧-复氧组比较,1%、1.5%和2%的异氟烷处理可显著降低MDA水平(P<0.05,图 2A)。此外,缺氧-复氧组GSH水平和空白对照组比较显著降低(P<0.01),GSH水平的增加也呈现出对于异氟烷的浓度依赖性(P<0.05,图 2B)。

|
| 1:空白对照组;2:缺氧-复氧组;3:1%异氟烷预处理组;4:1.5%异氟烷预处理组;5:2%异氟烷预处理组;a:P<0.01,与空白对照组比较;b:P<0.05,c:P<0.01,与缺氧-复氧组比较 图 2 不同浓度异氟烷对缺氧-复氧损伤H9c2细胞MDA(A)和GSH(B)相对水平的影响 |
2.3 异氟烷可激活Nrf2-ARE通路
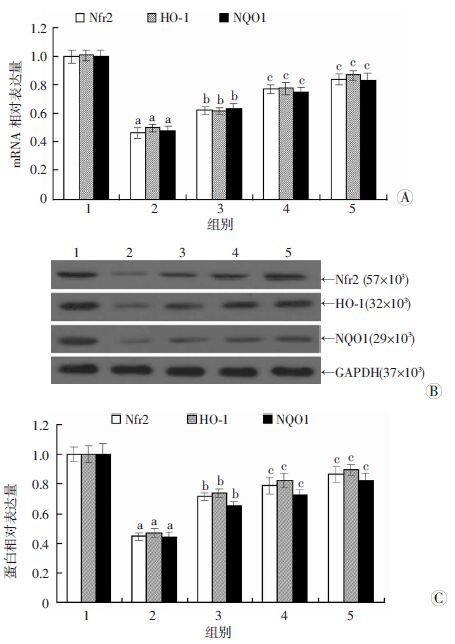
为探讨异氟烷预处理对Nrf2-ARE通路的影响,检测了不同浓度异氟烷的作用下Nrf2及Nrf2-ARE通路下游的抗氧化蛋白和Ⅱ相解毒酶HO-1及NQO1的表达。qRT-PCR检测结果(图 3A)和Western blot结果(图 3B、C)示:缺氧-复氧组中Nrf2、HO-1和NQO1的mRNA和蛋白表达水平均显著低于空白对照组(P<0.01),而与缺氧-复氧组比较,异氟烷预处理可上调缺氧-复氧损伤H9c2细胞中Nrf2、HO-1和NQO1的表达(P<0.05)。
|
| 1:空白对照组;2:缺氧-复氧组;3:1%异氟烷预处理组;4:1.5% 异氟烷预处理组;5:2%异氟烷预处理组;a:P<0.01,与空白对照组比较;b:P<0.05,c:P<0.01,与缺氧-复氧组比较 图 3 qRT-PCR 和Western blot检测不同浓度异氟烷对缺氧-复氧损伤H9c2细胞Nrf2、HO-1和NQO1的mRNA(A)和蛋白(B、C)表达的影响 |
2.4 Nrf2 siRNA转染成功地降低了H9c2细胞中Nrf2的表达
上述实验结果表明:H9c2细胞对于异氟烷的反应呈现浓度依赖性。因此,在后续的实验中选取2%浓度的异氟烷进行预处理。
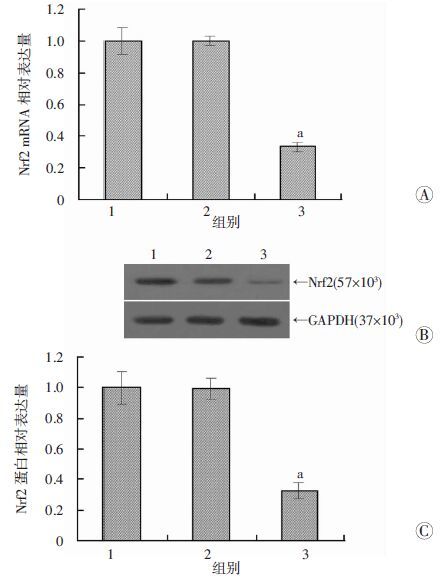
转染Nrf2 siRNA后Nrf2的表达如图 4所示,siRNA转染组Nrf2的mRNA和蛋白表达水平与缺 氧-复氧组和Scramble组比较均显著降低(P<0.01),表明Nrf2 siRNA成功地敲除了H9c2细胞中Nrf2的表达。
|
| 1:缺氧-复氧组;2:Scramble组;3:Nrf2 siRNA组;a:P<0.01与缺氧-复氧组比较 图 4 qRT-PCR 和Western blot检测siRNA转染后缺氧-复氧损伤H9c2细胞中Nrf2 mRNA(A)和蛋白(B、C)的表达 |
2.5 Nrf2 siRNA转染后剥夺了异氟烷对H9c2细胞缺氧-复氧损伤的保护作用
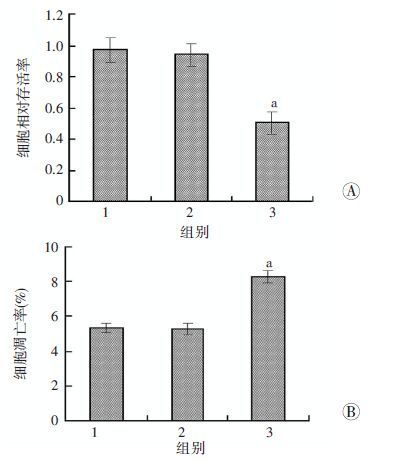
敲除Nrf2的表达后对细胞存活率和凋亡的影响如图 5所示:2%异氟烷预处理组和2%异氟烷预处理的Scramble组H9c2细胞存活率和凋亡率差异无统计学意义(P>0.05),而异氟烷预处理的siRNA组细胞存活率显著低于2%异氟烷预处理组和2%异氟烷预处理的Scramble组(P<0.05),细胞凋亡率更是显著高于其他2组(P<0.05)。
|
| 1:2%异氟烷预处理组;2:2%异氟烷预处理的Scramble组;3:2%异氟烷预处理的siRNA组;a:P<0.05,与2%异氟烷预处理组比较 图 5 异氟烷对Nrf2 siRNA转染后缺氧-复氧H9c2细胞存活率(A)和凋亡率(B)的影响 |
2.6 Nrf2 siRNA转染后降低了异氟烷对H9c2细胞氧化损伤的抑制作用
转染Nrf2 siRNA后,MDA和GSH的水平见图 6,2%异氟烷预处理组和2%异氟烷预处理的Scramble组MDA和GSH水平 差异无统计学意义(P>0.05),而2%异氟烷预处理的siRNA组MDA水平显著高于其他2组(P<0.05),GSH水平显著低于其他2组(P<0.05)。
|
| 1:2%异氟烷预处理组;2:2%异氟烷预处理的Scramble组;3:2%异氟烷预处理的siRNA组;a:P<0.05,与2%异氟烷预处理组比较 图 6 异氟烷对Nrf2 siRNA转染后缺氧-复氧H9c2细胞MDA(A)和GSH(B)相对水平的影响 |
3 讨论
心肌I/R损伤是心肌梗塞等缺血性心脏病手术后的主要病理变化,严重损伤机体健康,采取有效措施降低心肌I/R损伤具有十分重要的意义。
缺氧-复氧过程中会产生大量的活性氧自由基,造成细胞损伤,同时氧自由基引起脂质过氧化反应。具有较强的细胞毒性的MDA是脂质过氧化反应的终产物,因此其含量可反映机体脂质过氧化程度,以及机体受自由基损伤程度[9]。而正常情况下,体内GSH等物质可有效清除自由基,GSH还可通过维持还原态维生素E的含量来防止脂质过氧化损伤[10],故而GSH可反映机体抗氧化能力。本试验用缺氧-复氧对细胞进行处理模拟器官I/R损伤,通过对H9c2细胞进行异氟烷预处理,检测异氟烷对H9c2细胞的保护作用,发现异氟烷可显著抑制缺氧-复氧导致的H9c2细胞GSH下降及MDA水平升高,暗示异氟烷的预处理可显著减轻活性氧自由基对细胞造成的损害。
Nrf2-ARE信号通路是被公认的最重要的一条内源性抗氧化应激通路[11],其激活可诱导机体产生抗氧化酶和Ⅱ相药物代谢酶[12],对于维持细胞内氧化还原状态,降低氧化损伤,保护细胞功能等均发挥着重要作用[13]。研究发现,Nrf2-ARE信号通路与改善心肌I/R损伤密切相关[14]。Nrf2是细胞降低活性氧的重要转录因子。正常情况下,无活性的Nrf2与胞浆中Keapl紧密结合;在氧自由基等信号攻击下,Nrf2被泛素化降解[15],与Keapl迅速解离,转入细胞核,再与核内Maf等物质结合成异二聚体,进而识别抗氧化反应元件ARE并促进其介导的Ⅱ相解毒酶下游基因NQO1和HO-1等的表达[16-17]。HO-1和NQO1均为抗氧化保护基因,研究发现:HO-1和NQO1的表达上调可抵抗氧化应激,从而减轻自由基损伤,维持内环境稳定[18-19]。HO-1被认为是治疗I/R损伤的新靶点[20]。为研究异氟烷对心肌细胞的保护作用是否与Nrf2-ARE信号通路有关,我们检测了缺氧-复氧损伤后H9c2细胞中Nrf2、HO-1和NQO1的表达。结果发现异氟烷预处理能够逆转缺氧-复氧损伤后Nrf2、HO-1和NQO1表达的下调,表明异氟烷对H9c2细胞的保护作用与激活Nrf2-ARE信号通路有关。为进一步确定Nrf2在异氟烷保护缺氧-复氧心肌细胞中的作用,我们用Nrf2 siRNA沉默其表达,发现在Nrf2被抑制后,异氟烷对缺氧-复氧损伤心肌细胞的保护作用显著减弱甚至消失,表明Nrf2的活化在异氟烷对心肌细胞保护中具有十分重要的作用。
综上所述,本实验结果表明:异氟烷预处理可抑制缺氧-复氧损伤导致的细胞活力下降、细胞凋亡率增加、MDA含量升高和GSH含量的降低,减轻缺氧-复氧对心肌细胞的损伤,同时上调Nrf2、HO-1、SOD1和NQO1的表达,提示Nrf2-ARE信号通路在异氟烷对H9c2细胞缺氧-复氧损伤的保护中发挥着非常重要的作用。然而本研究仅以缺氧-复氧心肌细胞作为I/R损伤心肌的体外模型,异氟烷对心肌细胞缺氧复氧损伤和Nrf2-ARE信号通路的影响的具体机制以及体内相关作用还有待深入研究。
| [1] | Wang J, Yang L, Rezaie A R, et al. Activated protein C protects against myocardial ischemic/reperfusion injury through AMP-activated protein kinase signaling[J]. J Thromb Haemost,2011, 9 (7) : 1308 –1317. DOI:10.1111/j.1538-7836.2011.04331.x |
| [2] | Silambarasan T, Manivannan J, Priya M K, et al. Sinapic acid protects heart against ischemia/reperfusion injury and H9c2 cardiomyoblast cells against oxidative stress[J]. Biochem Biophys Res Commun,2015, 456 (4) : 853 –859. DOI:10.1016/j.bbrc.2014.12.022 |
| [3] | Pratt P F Jr, Wang C, Weihrauch D, et al. Cardioprotection by volatile anesthetics: new applications for old drugs?[J]. Curr Opin Anaesthesiol,2006, 19 (4) : 397 –403. DOI:10.1097/01.aco.0000236139.31099.b5 |
| [4] | Wu W, Zhou X, Liu P, et al. Isoflurane reduces hypoxia/reoxygenation-induced apoptosis and mitochondrial permeability transition in rat primary cultured cardiocytes[J]. BMC Anesthesiol,2014, 14 : 17 . DOI:10.1186/1471-2253-14-17 |
| [5] | Liu X, Guo Q L, Zhang Z, et al. Effect of emulsified isoflurane on apoptosis of anoxia-reoxygenation neonatal rat cardiomyocytes[J]. Asian Pac J Trop Med,2013, 6 (12) : 977 –981. DOI:10.1016/S1995-7645(13)60175-3 |
| [6] | Wang Y, Li C, Cheng K, et al. Activation of liver X receptor improves viability of adipose-derived mesenchymal stem cells to attenuate myocardial ischemia injury through TLR4/NF-κB and Keap-1/Nrf-2 signaling pathways[J]. Antioxid Redox Signal,2014, 21 (18) : 2543 –2557. DOI:10.1089/ars.2013.5683 |
| [7] | Diaz A, Humeres C, Gonzalez V, et al. Insulin/NFκB protects against ischemia-induced necrotic cardiomyocyte death[J]. Biochem Biophys Res Commun,2015, 467 (2) : 451 –457. DOI:10.1016/j.bbrc.2015.09.171 |
| [8] | Liu D, Zhang H, Gu W, et al. Neuroprotective effects of ginsenoside Rb1 on high glucose-induced neurotoxicity in primary cultured rat hippocampal neurons[J]. PLoS One,2013, 8 (11) : e79399 . DOI:10.1371/journal.pone.0079399 |
| [9] | Malinska D, Kulawiak B, Kudin A P, et al. Complex Ⅲ-dependent superoxide production of brain mitochondria contributes to seizure-related ROS formation[J]. Biochim Biophys Acta,2010, 1797 (6/7) : 1163 –1170. DOI:10.1016/j.bbabio.2010.03.001 |
| [10] | Kong Q, Lin C L. Oxidative damage to RNA: mechanisms, consequences, and diseases[J]. Cell Mol Life Sci,2010, 67 (11) : 1817 –1829. DOI:10.1007/s00018-010-0277-y |
| [11] | Furukawa M, Xiong Y. BTB protein Keap1 targets antioxidant transcription factor Nrf2 for ubiquitination by the Cullin 3-Roc1 ligase[J]. Mol Cell Biol,2005, 25 (1) : 162 –171. DOI:10.1128/MCB.25.1.162-171.2005 |
| [12] | Zhu H, Itoh K, Yamamoto M, et al. Role of Nrf2 signaling in regulation of antioxidants and phase 2 enzymes in cardiac fibroblasts: protection against reactive oxygen and nitrogen species-induced cell injury[J]. FEBS Lett,2005, 579 (14) : 3029 –3036. DOI:10.1016/j.febslet.2005.04.058 |
| [13] | Vomhof-Dekrey E E, Picklo M J Sr. The Nrf2-antioxidant response element pathway: a target for regulating energy metabolism[J]. J Nutr Biochem,2012, 23 (10) : 1201 –1206. DOI:10.1016/j.jnutbio.2012.03.005 |
| [14] | Cheng L, Jin Z, Zhao R, et al. Resveratrol attenuates inflammation and oxidative stress induced by myocardial ischemia-reperfusion injury: role of Nrf2/ARE pathway[J]. Int J Clin Exp Med,2015, 8 (7) : 10420 –10428. |
| [15] | Maruyama A, Nishikawa K, Kawatani Y, et al. The novel Nrf2-interacting factor KAP1 regulates susceptibility to oxidative stress by promoting the Nrf2-mediated cytoprotective response[J]. Biochem J,2011, 436 (2) : 387 –397. DOI:10.1042/BJ20101748 |
| [16] | Xia B, Liu H, Xie J, et al. Akt enhances nerve growth factor-induced axon growth via activating the Nrf2/ARE pathway[J]. Int J Mol Med,2015, 36 (5) : 1426 –1432. DOI:10.3892/ijmm.2015.2329 |
| [17] | Zhang H, Liu H, Davies K J, et al. Nrf2-regulated phase Ⅱ enzymes are induced by chronic ambient nanoparticle exposure in young mice with age-related impairments[J]. Free Radic Biol Med,2012, 52 (9) : 2038 –2046. DOI:10.1016/j.freeradbiomed.2012.02.042 |
| [18] | Hwa J S, Jin Y C, Lee Y S, et al. 2-methoxycinnamaldehyde from Cinnamomum cassia reduces rat myocardial ischemia and reperfusion injury in vivo due to HO-1 induction[J]. J Ethnopharmacol,2012, 139 (2) : 605 –615. DOI:10.1016/j.jep.2011.12.001 |
| [19] | Piao C S, Gao S, Lee G H, et al. Sulforaphane protects ischemic injury of hearts through antioxidant pathway and mitochondrial K(ATP) channels[J]. Pharmacol Res,2010, 61 (4) : 342 –348. DOI:10.1016/j.phrs.2009.11.009 |
| [20] | Juhasz B, Varga B, Czompa A, et al. Postischemic cardiac recovery in heme oxygenase-1 transgenic ischemic/reperfused mouse myocardium[J]. J Cell Mol Med,2011, 15 (9) : 1973 –1982. DOI:10.1111/j.1582-4934.2010.01153.x |



