2. 400038 重庆,第三军医大学西南医院全军泌尿外科研究所
2. Institute of Urinary Surgery, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
间质性膀胱炎(interstitial cystitis,IC)是一种原因未明的以尿急、尿频、膀胱充盈后耻骨上区或盆腔疼痛,排尿后减轻为表现的临床综合征[1],又称膀胱疼痛综合征,严重影响患者生活与心理。其病因复杂,目前尚无特效的治疗方式。研究证实自噬在间质性膀胱 炎的发病中起重要作用,且自噬功能可能受到一定程度的抑制[2]。目前其原因并未阐明,内质网应激抑制自噬流是多种疾病发病的重要因素[3-4],故探索在间质性膀胱炎中自噬功能受阻是否与内质网应激有关对其发病机制的补充及提供新的临床诊治方案有着重要意义。
细胞自噬(autophagy)是一种降解细胞内的长寿蛋白质和受损的细胞器维持细胞内平衡的代谢过程[5],细胞自噬的形成过程包括双侧膜结构包裹部分细胞质和细胞内需降解的细胞器、蛋白质等形成自噬小体(autophagosome),然后与溶酶体融合形成自噬溶酶体(autophagolysosome),降解其所包裹的内容物,产生氨基酸、游离的脂肪酸等物质又被细胞重新利用。这种包裹废物形成自噬小体然后与溶酶体结合最终降解废物的过程也被称为自噬流(autophagy flux)。P62是一个多功能蛋白,可与泛素化错误折叠蛋白结合,依赖与LC3/GABARAP 家族蛋白经自噬途径降解,因此抑制自噬流将导致P62水平增高。本课题组前期研究结果表明在间质性膀胱炎中存在低水平表达的自噬[6],且增强自噬后膀胱炎症减轻且排尿功能得到一定程度恢复[2]。但增强自噬后虽然自噬小体的数量有所增加,却不能彻底包裹、清除细胞内损害的细胞器,提示其自噬流可能受到一定程度阻碍,即自噬功能受到抑制。
在动脉粥样硬化[3]及酒精性肝炎[4]等疾病中,内质网应激阻碍自噬流是其重要的发病机制。内质网(endoplasmic reticulum,ER)应激是真核细胞的一种保护性应激反应,但长期、严重的内质网应激则会诱导细胞凋亡或死亡。近来研究发现,内质网应激在机体的炎症反应中发挥重要作用,参与多种炎症性疾病的发生、发展。内质网应激下游通路IRE1可通过IRE1-凋亡信号调节激酶1(apoptosis signal-regulating kinase 1,ASK1)-c-Jun N端激酶(c-Jun-N-terminal kinase,JNK)通路介导凋亡。IRE1活化后能够募集肿瘤坏死因子受体相关因子2 (TNF-receptor associated factor-2,TRAF2),并与之形成复合体,然后激活ASK1,激活JNK[7]。Dugan 等[8]研究发现在间质性膀胱炎大鼠模型中活化的JNK通路会影响膀胱功能,阻断JNK通路后膀胱排尿功能恢复。故而内质网应激过度激活可能 是间质性膀胱炎发病的重要环节,且可能与自噬流受到抑制有关。4-苯基丁酸钠(4-phenylbutyric acid,4-PBA) 是一种小分子量的脂肪酸[9]。已被批准使用治疗小儿遗传性尿素代谢障碍、镰刀形细胞贫血和地中海贫血的一种临床用药,可以作为一种分子伴侣逆转蛋白质分子的错误移位或错误聚集,帮助其建立正常的空间结构,从而减轻内质网的负担、抑制内质网应激信号感应。Sawada等[10]在膀胱出口梗阻诱发凋亡的研究中发现4-PBA对假手术组膀胱组织无明显影响。故本研究拟通过4-PBA抑制内质网应激观察自噬流的变化以及对膀胱兴奋性的影响,进而探讨4-PBA对间质性膀胱炎可能的治疗作用。
1 材料与方法 1.1 实验材料 1.1.1 主要试剂全蛋白提取试剂盒及Western blot凝胶试剂盒购自碧云天生物技术公司,鱼精蛋白及LPS购自美国Sigma公司,乌拉坦及水合氯醛购自美国Sigma公司,GRP78兔抗大鼠购自Abcam公司,LC3A/B、P62、Beclin1兔抗大鼠购自CST公司,GAPDH购自碧云天生物技术公司,HRP和羊抗鼠二抗购自北京中杉公司,ECL化学发光显色液购自美国Thermo公司。
1.2 方法 1.2.1 动物模型建立SD雌性成年大鼠45只购自第三军医大学大坪医院野战外科研究所实验动物中 心,体质量220~250 g,按随机数字表法[11]分为:对照组(C组)、炎症组(IC组)和炎症+4-PBA组(IC+4-PBA组),每组15只。C组大鼠给予生理盐水持续灌注膀胱 处理。IC组用10 mg/mL鱼精蛋白灌注大鼠膀胱30 min,然后用生理盐水冲洗膀胱3次,再用2 mg/mL LPS灌注 大鼠膀胱45 min,最后用生理盐水冲洗3次。IC+4-PBA组在建立大鼠炎症模型时给予500 mg/(kg·d) 的4-PBA灌胃处理5 d。5 d后每组5只大鼠用于尿动力检测,其余用于分子生物学及形态学相关检测。
1.2.2 Western blot检测首先预实验取C组、IC组各5只大鼠膀胱组织,应用Western blot检测C组与IC组GRP78、LC3A/B、P62、Beclin1表达量;确定在间质性膀胱炎中自噬流是否受阻及是否存在高水平的内质网应激后,C组、IC组、IC+4-PBA组各取5只大鼠,处死后取出部分大鼠膀胱组织,全蛋白提取试剂盒提取膀胱组织总蛋白,其余膀胱组织速冻于-80 ℃冰箱。应用Western blot检测C组、IC组及IC+4-PBA 组GRP78、LC3A/B、P62、Beclin1表达量。具体方法参 见文献[12]报道的方法。抗体浓度为GRP78(1 ∶1 000),LC3A/B (1 ∶1 000),P62 (1 ∶1 000),Beclin1 (1 ∶1 000),GAPDH(1 ∶1 000),山羊抗鼠二抗(1 ∶5 000),山羊抗兔二抗(1 ∶4 000)。
1.2.3 HE染色将每组5只大鼠处死后取出膀胱,取1/2置于10%多聚甲醛液中固定,在梯度酒精脱水后石蜡包埋并切片(5 μm)用于HE染色,另外1/2膀胱组织速冻于-80 ℃冰箱,用于制作冰冻切片。HE染色切片在光镜下随机选取5个视野,观察炎症及黏膜损伤指数并进行炎症评分,评分标准参照文献[13-14],以盲法行病理学检测和评价。
1.2.4 免疫荧光染色取每组5只大鼠膀胱组织 制作冰冻切片(5 μm),经多聚甲醛常温下固定15 min,去离子水洗10 min,然后用PBS清洗10 min。切片经0.3% Triton X-100打孔5 min,PBS清洗3次,1% BSA常温下封闭2 h。接着LC3A/B(1 ∶300)4 ℃过夜孵育。随后,切片PBS清洗3次,荧光二抗山羊抗小鼠(1 ∶100)常温下孵育2 h。切片PBS清洗3次,DAPI常温下孵育5 min。PBS清洗3次,甘油封片。制作好的标本在莱卡激光显微镜下观察。
1.2.5 大鼠尿动力学检测采用文献[15-16]报道的方法。每组5只大鼠用1.2 g/kg 乌拉坦腹腔内注射麻醉,然后经尿道将导管置入大鼠膀胱,连接好多道生理信号采集处理系统,以速度为10 mL/h向大鼠膀胱内灌注生理盐水并记录大鼠膀胱收缩间歇(ICI)及排尿频率(MF)。
1.3 统计学处理实验数据处理采用SPSS 16.0统计软件进行单因素方差分析,两组间差异比较应用独立样本t检验。检验水准α=0.05。
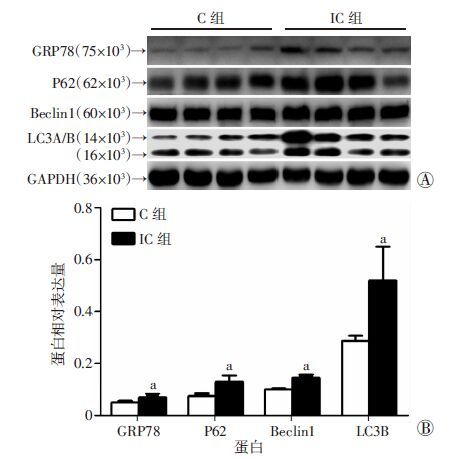
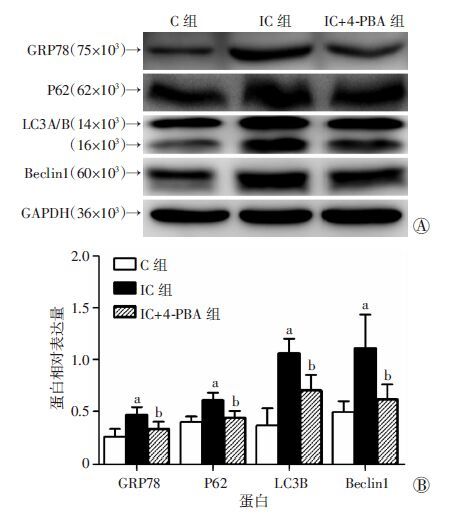
2 结果 2.1 大鼠膀胱GRP78、LC3A/B、P62、Beclin1表达Western blot检测结果(图 1)显示IC组内质网应激标记物GRP78及自噬流标记物P62水平明显高于C组,IC组自噬标记物LC3A/B、Beclin1也明显高于C组(P <0.05)。图 2显示IC+4-PBA组内质网应激标记物GRP78、自噬流标记物P62、自噬标记物LC3A/B、Beclin1明显低于IC组(P <0.05)。
|
| A:Western blot检测;B:半定量分析 a:P <0.05,与C组比较 图 1 Western blot检测C组、IC组GRP78、P62、LC3A/B和Beclin1的表达 |
|
| A:Western blot检测;B:半定量分析 a:P <0.05,与C组比较;b:P <0.05,与IC组比较 图 2 Western blot检测各组GRP78、P62、LC3A/B和Beclin1的表达 |
2.2 大鼠膀胱LC3A/B免疫荧光变化
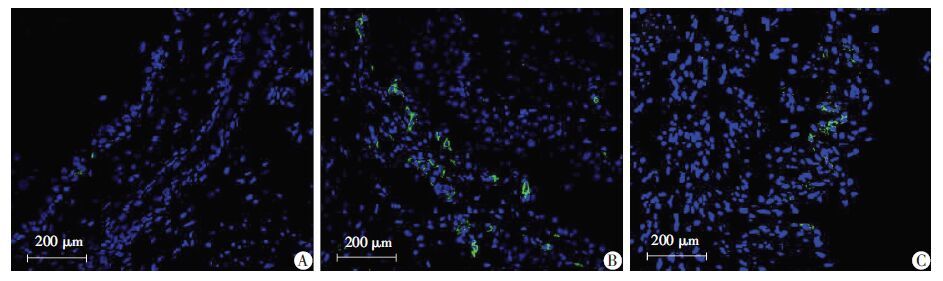
自噬相关标记物LC3A/B免疫荧光检测结果见图 3。IC+4-PBA组带荧光的细胞数占全视野细胞数 百分比(5.8%±1.4%)明显低于IC组(12.1%±1.6%),高于C组(1.2%±0.4%),差异均有统计学意义(P <0.05)。
|
| A:C组;B:IC组;C:IC+4-PBA组 图 3 免疫荧光观察C组、IC组和IC+4-PBA组LC3A/B的表达 |
2.3 HE染色观察
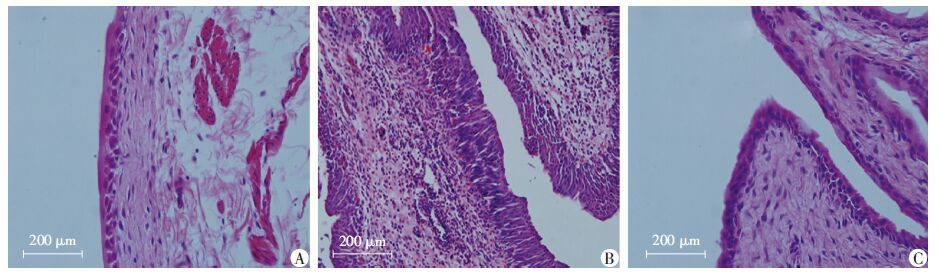
HE染色结果(图 4)显示,IC组表现出明显的上皮损伤,炎细胞浸润,黏膜及固有层明显水肿,而IC+4-PBA组表现为上皮组织有较好的完整性,炎细胞浸润和组织水肿明显减轻;膀胱组织学评分IC+4-PBA组(2.6±0.5)显著低于IC组(4.2±0.4),高于C组(1.4±0.5),差异均有统计学意义(P <0.05)。
|
| A:C组;B:IC组;C:IC+4-PBA组 图 4 HE染色观察各组大鼠膀胱组织病理学变化 |
2.4 尿动力学检测结果
尿动力学研究结果(图 5)显示,IC组较C组表现出大鼠膀胱收缩间歇缩短、排尿频率加快。而IC+4-PBA组收缩间歇较IC组明显增加、排尿频率较IC组明显减低。
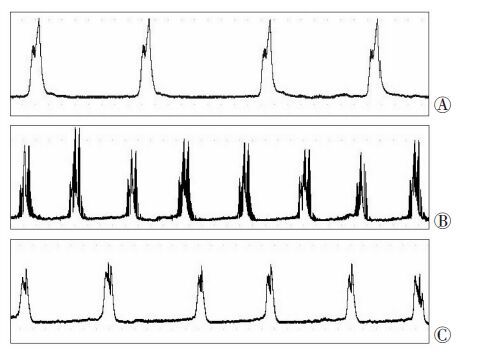
|
| A:C组;B:IC组;C:IC+4-PBA组 图 5 各组大鼠膀胱测压结果 |
3 讨论
本研究首先通过Western blot检测发现IC组内质 网应激标记物GRP78表达明显高于C组,证实在间质 性膀胱炎中存在很高的内质网应激水平;自噬标记物LC3A/B、Beclin1表达IC组也明显高于C组,表明在间质性膀胱炎中自噬水平升高,与课题组前期研究结果相符[3];自噬流标记物P62表达升高表明在间质性膀胱炎中自噬流受到阻滞,进一步解释了课题组前期研究发现自噬无法彻底吞噬胞内废物现象,即自噬清除废物功能降低。为进一步证实间质性膀胱炎中自噬流受到阻滞是否与过度增强的内质网应激有关,我们通过内质网应激抑制剂4-PBA[9]处理IC组,结果显示抑制间质性膀胱炎内质网应激后P62水平明显降低,自噬流得到一定程度恢复,故在间质性膀胱炎中自噬流受到阻滞可能与过度增强的内质网应激有关。
李龙坤等[15]在胰岛素抵抗实验研究中发现应用衣霉素增强脂肪细胞内质网应激后可诱发自噬反应,但胰岛素抵抗加强,进一步研究证实虽然其自噬水平升高但其功能受到抑制,由此可推测内质网应激虽可诱导自噬水平升高但对自噬功能产生抑制作用。本实验通过4-PBA抑制内网应激后LC3A/B、Beclin1及P62蛋白表达较IC组明显降低,表明虽然自噬水平降低,但其自噬功能得到加强。本研究进一步应用免疫 荧光技术检测LC3A/B表达水平,结果显示IC+4-PBA 组明显低于IC组但高于C组。作为可靠并被广泛运用的自噬检测和评价指标[17],IC组LC3A/B升高,提示自噬反应得到加强,并可能由过度激活的内质网应激导致。抑制内质网应激后自噬功能得到恢复,但自噬水平也随即降低,一方面可能与内质网应激受到抑制从而对自噬的诱导减弱有关;另一方面可能因抑制内质网应激后自噬功能得到增强,从而对过度堆积的废物进行有效清理,膀胱内环境得到改善,最终细胞自噬水平出现反应性降低。
进一步观察膀胱组织学变化结果发现IC经4-PBA 处理后的大鼠膀胱组织有较好的上皮组织完整性,炎细胞浸润和组织水肿程度也较IC组明显减轻;尿动力学检测结果发现IC+4-PBA组膀胱收缩间歇较IC组延长、排尿频率较IC组降低。以上研究结果提示在间质性膀胱炎中通过4-PBA抑制内质网应激后膀胱组织结构及排尿功能得到明显改善。本课题组前期研究结果表明应用雷帕霉素增强自噬后IC的膀胱组织结构及排尿功能也能得到一定程度的改善,可能与自噬流得到一定程度恢复有关,但电镜结果显示增强自噬后自噬小体虽不断增多,其清除胞内废物能力却仍然有限[2],本研究结果证实与内质网应激阻滞自噬流影响自噬功能有关。故在IC中抑制内质网应激后自噬流得到很大程度恢复,对膀胱组织细胞中废物清理作用加强,维持膀胱内环境稳态,从而对疾病的控制起重要作用,膀胱组织结构及排尿功能得到明显改善。本研究结果显示,自噬标记物LC3A/B、Beclin1在IC组中升高,在其他学者的研究中得到了证实[2, 6],但我们通过检测内质网应激标记物GRP78及自噬流标记物P62发现在间质性膀胱炎中存在高水平的内质网应激且自噬流受到阻滞,利用4-PBA抑制内质网应激后 P62水平降低,在间质性膀胱炎中为自噬流受阻找到了科学根据,并证实可能与内质网应激有关。但本实验未对内质网应激在间质性膀胱炎中调控自噬流的具体作用通路做进一步研究,将成为我们下一步的研究重点。
大量研究证明内质网应激通过IRE1信号通路影响自噬流,在胰岛素抵抗实验[18]及亨廷顿病[19]研究发现内质网应激主要通过活化IRE1信号通路干预自噬流。研究证明IRE1干预自噬流主要通过以下途径:①内质网应激通过Rab7阻止自噬小体与溶酶体融合[20]。②内质网应激通过IRE1通路抑制溶酶体内吞作用从而抑制溶酶体功能来抑制自噬流[21]。③由于自噬小体双膜结构来源于内质网/高尔基体学说,IRE1又调节内质网/高尔基体的产生,从而内质网应激IER1通路调控自噬小体双膜结构的形成[22]。故在间质性膀胱炎内质网应激可能通过IRE1信号阻碍自噬流对膀胱功能产生影响。
综上所述,我们认为在间质性膀胱炎中4-PBA通过抑制内质网应激改善自噬功能,使自噬清除废物能力增强,最终降低间质性膀胱炎膀胱兴奋性,改善膀胱功能,为间质性膀胱炎的发病机制及其治疗提出了新的观点和补充。
| [1] | Messing E M, Stamey T A. Interstitial cystitis: early diagnosis, pathology, and treatment[J]. Urology,1978, 12 (4) : 381 –392. |
| [2] | Zhao J, Song Q, Wang L, et al. Detrusor myocyte autophagy protects the bladder function via inhibiting the inflammation in cyclophosphamide-induced cystitis in rats[J]. PLoS One,2015, 10 (4) : e0122597 . DOI:10.1371/journal.pone.0122597 |
| [3] | Razani B, Feng C, Coleman T, et al. Autophagy links inflammasomes to atherosclerotic progression[J]. Cell Metab,2012, 15 (4) : 534 –544. DOI:10.1016/j.cmet.2012.02.011 |
| [4] | Gonzalez-Rodriguez A, Mayoral R, Agra N. Impaired autophagic flux is associated with increased endoplasmic reticulum stress during the development of NAFLD[J]. Cell Death Dis,2014, 5 : e1179 . DOI:10.1038/cddis.2014.162 |
| [5] | Rubinsztein D C, Codogno P, Levine B. Autophagy modulation as a potential therapeutic target for diverse diseases[J]. Nat Rev Drug Discov,2012, 11 (9) : 709 –730. DOI:10.1038/nrd3802 |
| [6] | 赵江, 董兴有, 杨星亮, 等. 人和大鼠膀胱平滑肌细胞存在低水平的自噬[J]. 第三军医大学学报,2014, 36 (13) : 1394 –1397. DOI:10.16016/j.1000-5404.2014.13.005 |
| [7] | Yung H W, Korolchuk S, Tolkovsky A M, et al. Endoplasmic reticulum stress exacerbates ischemia-reperfusion-induced apoptosis through attenuation of Akt protein synthesis in human choriocarcinoma cells[J]. FASEB J,2007, 21 (3) : 872 –884. DOI:10.1096/fj.06-6054com |
| [8] | Dugan C, Malley S, Arms L, et al. Role of c-Jun N-terminal kinase (JNK) activation in micturition reflexes in cyclophosphamide (CYP)-induced cystitis in female rats[J]. J Mol Neurosci,2014, 54 (3) : 360 –369. DOI:10.1007/s12031-014-0308-5 |
| [9] | Zhu M, Guo M, Fei L, et al. 4-phenylbutyric acid attenuates endoplasmic reticulum stress-mediated pancreatic β-cell apoptosis in rats with streptozotocin-induced diabetes[J]. Endocrine,2014, 47 (1) : 129 –137. DOI:10.1007/s12020-013-0132-7 |
| [10] | Sawada N, Yao J, Hiramatsu N, et al. Involvement of hypoxia-triggered endoplasmic reticulum stress in outlet obstruction-induced apoptosis in the urinary bladder[J]. Lab Invest,2008, 88 (5) : 553 –563. DOI:10.1038/labinvest.2008.21 |
| [11] | 林斌, 董兴有, 赵江, 等. 二甲基亚砜通过降低炎症和氧化应激改善鱼精蛋白诱导的大鼠膀胱炎[J]. 第三军医大学学报,2015, 37 (6) : 505 –509. DOI:10.16016/j.1000-5404.201410047 |
| [12] | Chen W, Jiang C, Jin X, et al. Roles of stem cell factor on loss of interstitial cells of Cajal in bladder of diabetic rats[J]. Urology,2011, 78 (6) : 1443.e1 –1443.e6. DOI:10.1016/j.urology.2011.08.019 |
| [13] | Saito M. Editorial comment to interleukin-6 levels in female rats with protamine sulfate-induced chronic cystitis treated with hyaluronic acid[J]. Int J Urol,2013, 20 (10) : 1023 . DOI:10.1111/iju.12109 |
| [14] | 王亮, 赵江, 董兴有, 等. 乙酰半胱氨酸对硫酸鱼精蛋白诱导的大鼠膀胱炎的作用[J]. 第三军医大学学报,2014, 36 (7) : 640 –644. DOI:10.16016/j.1000-5404.2014.07.022 |
| [15] | 李龙坤, 宋波, 金锡御, 等. 骶神经根电刺激对大鼠神经源性膀胱储尿功能影响的实验研究[J]. 第三军医大学学报,2003, 25 (22) : 1972 –1974. DOI:10.16016/j.1000-5404.2003.22.003 |
| [16] | Li L, Jiang C, Hao P, et al. Changes of gap junctional cell-cell communication in overactive detrusor in rats[J]. Am J Physiol Cell Physiol,2007, 293 (5) : C1627 –C1635. DOI:10.1152/ajpcell.00122.2007 |
| [17] | Klionsky D J, Abdalla F C, Abeliovich H, et al. Guidelines for the use and interpretation of assays for monitoring autophagy[J]. Autophagy,2012, 8 (4) : 445 –544. |
| [18] | Li H, Zhou B, Xu L, et al. The reciprocal interaction between autophagic dysfunction and ER stress in adipose insulin resistance[J]. Cell Cycle,2014, 13 (4) : 565 –579. DOI:10.4161/cc.27406 |
| [19] | Lee H, Noh J Y, Oh Y, et al. IRE1 plays an essential role in ER stress-mediated aggregation of mutant huntingtin via the inhibition of autophagy flux[J]. Hum Mol Genet,2012, 21 (1) : 101 –114. DOI:10.1093/hmg/ddr445 |
| [20] | Ganley I G, Wong P M, Gammoh N, et al. Distinct autophagosomal-lysosomal fusion mechanism revealed by thapsigargin-induced autophagy arrest[J]. Mol Cell,2011, 42 (6) : 731 –743. DOI:10.1016/j.molcel.2011.04.024 |
| [21] | Noh J Y, Lee H, Song S, et al. SCAMP5 links endoplasmic reticulum stress to the accumulation of expanded polyglutamine protein aggregates via endocytosis inhibition[J]. J Biol Chem,2009, 284 (17) : 11318 –11325. DOI:10.1074/jbc.m807620200 |
| [22] | Sriburi R, Jackowski S, Mori K, et al. XBP1: a link between the unfolded protein response, lipid biosynthesis, and biogenesis of the endoplasmic reticulum[J]. J Cell Biol,2004, 167 (1) : 35 –41. DOI:10.1083/jcb.200406136 |



