Tang Xiaowen,E-mail: tangxiaowen@suda.edu.cn
难治复发是影响急性髓系白血病(acute myeloid leukemia,AML)长期生存的重要不良因素,由于患者机体的耐受性及其肿瘤细胞的耐药性,可供选择的方案非常有限,因此难治复发的AML治疗仍是临床上亟需解决的难题。预激方案由重组人粒细胞集落刺激因子(recombinant human granulocyte colony stimulating factor,G-CSF) 联合低剂量阿克拉霉素(doxorubicin,Acla),阿糖胞苷(cytarabine,Ara-C)组成[1],因其低毒有效而广泛应用。我研究所创新性提出在预激方案的基础上,结合不同作用机制的地西他滨(decitabine/dacogen,DAC)和高三尖杉酯碱(homoharringtonine,HHT),组成新的化疗方案,简称DAC+HAAG方案,探索其是否能带来更高CR率,更低化疗相关毒性,更长无病生存期。我们回顾性分析了研究所36例应用DAC+HAAG方案的进展期AML患者资料,观察治疗有效率及毒性。
1 资料与方法 1.1 病例资料选取2012年12月至2015年8月收治于苏州大学附属第一医院血液科的36例AML患者,中位年龄42(14~68)岁,18例患者为标准难治复发(15例复发及3例难治),另外18例为一疗程诱导未缓解患者[所用诱导方案包括15例IA(去甲氧柔红霉素IDA、Ara-C),1例CAG(Acla、Ara-C、G-CSF),1例DA(柔红霉素DNR、Ara-C),1例IAC(IDA、Ara-C、克拉屈滨2-DdA)]。所有患者根据MICM分型(细胞形态学、免疫学、细胞遗传学、分子生物学)确诊[2]。化疗前均无严重脏器功能不全及重症感染,ECOG评分≤3分。难治复发AML的诊断标准参照文献[3]。患者基本资料见表 1。
| 病例 | n | 性别(男/女) | 中位年龄(岁) | 诊断(例) | 染色体核型 | 治疗前原始细胞 中位数(%) | 后续移植患者(例) | ||||||||
| M0 | M1 | M2 | M4 | M5 | M6 | MDS | 良好 | 中等 | 不良 | ||||||
| 全部患者 | 36 | 23/13 | 42(14~68) | 1 | 2 | 17 | 6 | 7 | 2 | 1 | 3 | 25 | 8 | 29(7.5~94.5) | 24 |
| 难治复发 | 18 | 12/6 | 47(14~68) | 0 | 0 | 11 | 3 | 4 | 0 | 0 | 3 | 13 | 2 | 28.5(3.5~91.5) | 11 |
| 一疗程诱导未缓解 | 18 | 11/7 | 38(15~54) | 1 | 2 | 6 | 3 | 3 | 2 | 1 | 0 | 12 | 6 | 30(8.5~92.0) | 13 |
1.2 治疗方案
DAC+HAAG方案:具体方案为DAC 20 mg/(m2·d),静脉滴注,第1~3天或第1~5天,HHT 1 mg/d,静脉滴注,第3~9天或第3~16天,Ara-C 10 mg/m2,每12小时1次,皮下注射,第3~9天或第3~16天,Acla 10 mg/d,静脉滴注,第3~6天或第3~10天,G-CSF 300 μg/d,皮下注射,第2~9天或第2~16天,并根据血象调整G-CSF用量。化疗第9天复查骨穿明确是否进行后续7 d用药,若达到完全缓解(complete remission,CR),则终止化疗。
1.3 支持治疗所有患者均入住我院血液科消毒隔离病房,化疗期间给予支持治疗,确保静脉补液量>3 000 mL/d,加强口腔、肛周护理。当患者粒缺期体温>38.5 ℃或出患者现畏寒寒战时,进行相关病原学检测,并给予抗感染治疗。定期监测血常规,必要时成分血输注支持。
1.4 进一步治疗18例难治复发患者中,15例获得CR或部分缓解(partial remission,PR),其进一步治疗方案包括8例直接序贯移植,3例化疗巩固后移植,2例化疗,1例放疗,1例未进一步治疗;3例未缓解(non-remission,NR)患者均未行进一步治疗。18例一疗程诱导未缓解患者中,14例获得CR或PR,其进一步治疗方案包括9例序贯移植,2例化疗后移植,1例化疗,2例未进一步治疗;4例NR患者中1例行挽救性移植,1例进一步诱导化疗缓解后移植,2例未进一步治疗。后续化疗方案包括同方案巩固、中剂量Ara-C为基础的FA(氟达拉滨+Ara-C)、中剂量Ara-C或CLAG(克拉屈滨、Acla、G-CSF)等。
1.5 观察指标治疗前行骨穿完善MICM分型,化疗第9天和化疗结束后,及脱离粒缺期后3个时间段复查髓涂片及微小残留病变(minimal residual disease,MRD),评估疗效。治疗前后监测血常规、生化全套、心电图、胸部CT;观察并记录患者用药后骨髓受抑、恶心呕吐、腹泻、感染、发热、出血等不良反应及心脏、肝脏、肾脏、神经系统等非血液学毒性。
1.6 疗效评价疗效指标分为CR、PR、NR,以CR+PR为总体有效率(overall response rate,ORR)。不良反应评估按照美国NCI-CTCAE4.03标准执行,参评指标包括血液学毒性、脏器毒性及感染等。随访截至2015年10月1日,中位生存(overall survival,OS)时间7.5(0.5~33.3)个月,末次随访时疾病状态包括持续缓解(continuous complete remission,CCR)、复发、死亡,随访方式包括电话随访、门诊复查、查阅病历,所有患者均未失访。CR:血小板计数(PLT)≥100×109/L,中性粒细胞计数(ANC)≥1.5×109/L,骨髓中原始细胞≤0.05,同时无髓外白血病浸润;PR:血细胞计数符合CR标准,骨髓中原始细胞比例降低50%以上且原始细胞比例为5%~25%[2]。NR为未达到CR和PR。OS时间即从应用DAC第1天起至末次随访时间。无病生存(disease-free survival,DFS)时间:获得CR患者,从CR之日至复发或CR状态下死亡的时间或CCR患者末次随访时间。
1.7 统计学处理采用SPSS 19.0统计学软件进行统计。采用Kaplan-Meier法计算OS率,采用非参数秩和检验进行长期生存时间、DFS时间对比。以P<0.05为差异有统计学意义。
2 结果 2.1 临床疗效评估36例患者均完成一疗程化疗,可评估疗效,其CR率为58.3%(21/36),PR率为22.2%(8/36),ORR为80.6%(29/36)。18例难治复发患者CR率为61%(11/18),PR率为22.2%(4/18),ORR为83.3%(15/18)。18例一疗程标准诱导未缓解患者CR率为55.6%(10/18),PR率为22.2%(4/18),ORR为77.8%(14/18)。见表 2。
| 病例 | n | 疗效指标[例数(%)] | 生存指标 | ||||
| CR | PR | ORR | OS时间(月) | DFS时间(月) | 1年OS率(%) | ||
| 全部患者 | 36 | 21(58.3) | 8(22.2) | 29(80.6) | 7.5(0.5~33.3) | 11(0.8~27.3) | 43.30 |
| 难治复发 | 18 | 11(61.0) | 4(22.2) | 15(83.3) | 6.5(0.5~19.5)a | 6.5(1~19.5) | 24.20a |
| 一疗程NR | 18 | 10(55.6) | 4(22.2) | 14(77.8) | 15.0(0.8~33.3) | 15.5(0.8~27.3) | 61.60 |
| 难治复发:标准难治复发患者;一疗程NR:一疗程标准诱导方案未缓解患者;a:P<0.01,与一疗程NR比较 | |||||||
分析不同因素对CR率的影响,包括性别(男,女),年龄,疾病分型(M0~M6),治疗前原始细胞百分比(≤0.3,>0.3),细胞遗传学危险度分组(良好,中等,不良),-7,t(8;21),FLT3-ITD,P值分别为0.681、0.765、0.650、0.005、0.359、1.000、0.062和 0.588。除治疗前原始细胞百分比外,其他因素差异均无统计学意义。所有CR患者的原始细胞百分比中位数为0.24(0~0.0945),非CR患者的原始细胞中位数为0.4(0.17~0.92),差异有统计学意义(P=0.032)。
2.2 不良反应分析36例患者不良反应,血液学毒性均为4级。3~5级感染发生率为72.2%(26/36),其中肺部感染发生率为30.6%(11/36),消化道感染发生率13.9%(5/36),败血症发生率8.3%(3/36),导管相关感染发生率5.6%(2/36),泌尿系感染发生率2.8%(1/36),未明确部位感染发生率17.4%(7/36)。3~4级发热的发生率2.8%(1/36)。肝脏毒性发生率36.1%(13/36),其中1~2级毒性占33.3%(12/36),3~4级毒性占2.8%(1/36)。出血发生率为8.3%(3/36),其中2例2级出血,表现为肠道感染伴随的少量血便,1例脑出血并导致死亡。化疗期间预防性应用止吐药物,未发生明显恶心呕吐。未发生明显肾脏、心脏、神经系统毒性。
2.3 生存随访截止至随访终点,全部患者中位OS时间为7.5(0.5~33.3)个月,难治复发患者中位OS时间为6.5(0.5~19.5)个月,一疗程标准方案诱导未缓解患者中位OS时间为15.0(0.8~33.3)个月(P=0.01)。全部患者1年OS为(43.3±8.4)%,难治复发患者1年 OS率为(24.2±10.5)%,一疗程未缓解患者1年OS率为(61.1±11.5)%,2年OS率为48.6%(P=0.01)。全部CR患者的DFS中位时间为11(0.8~27.3)个月,难治复发患者6.5(1~19.5)个月,一疗程未缓解患者为15.5(0.8~27.3)个月(P=0.085)(表 2)。
36例患者中有24例后续接受异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT),12例存活患者均接受allo-HSCT。24例接受allo-HSCT患者,包含11例难治复发和13例一疗程未缓解患者,中位OS时间为15(1.3~33.3)个月,明显优于未移植患者(P=0.00)。移植患者半年OS率为(78.6±8.5)%,1年OS率为(65.5±9.9)%,未移植患者均未活过1年,半年OS率为(25.0±12.5)%(P=0.00)(图 1)。难治复发患者中11例患者后续接受allo-HSCT,7例未行移植,移植患者1年OS率为(40.9±15.6)%,半年OS率为(71.6±14.0)%,未移植患者最长随访10个月,半年OS率为(28.6±17.1)%(P=0.03)(表 3)。
对可能影响长期生存的因素与OS的关系,进行单因素与多因素分析,分析因素包括患者发病时特征[性别、年龄、疾病分型、治疗前原始细胞百分比、细胞遗传学危险度分组,是否伴有-7、t(8;21)、FLT3-ITD],一疗程是否达CR,后续治疗模式(继续化疗或allo-HSCT)。单因素分析结果显示,后续治疗模式与是否伴有FLT3-ITD两个因素差异有统计学意义,P值分别为0.00和0.034,其他分析因素P值均大于0.05。对单因素分析P<0.05的因素进一步进行多因素分析结果显示,后续allo-HSCT(RR=14.065,95% CI:4.458~44.374,P=0.00)、不伴有FLT3-ITD(RR=6.475,95%CI:2.188~19.161,P=0.001)是改善OS的预后因素。
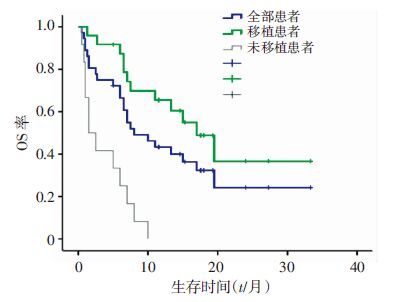
|
| 图 1 移植与未移植患者的OS率比较 |
| 患者 | n | 半年OS率 | 1年OS率 |
| 全部患者 | 36 | ||
| 移植患者 | 24 | 78.6±8.5a | 65.5±9.9 |
| 未移植患者 | 12 | 25.0±12.5 | 0 |
| 难治复发患者 | 18 | ||
| 移植患者 | 11 | 71.6±14.0a | 40.9±15.6 |
| 未移植患者 | 7 | 28.6±17.1 | 0 |
| a:P<0.05,与未移植患者比较 | |||
3 讨论
近年来随着治疗手段不断发展,AML患者预后明显改善,但是很多患者仍旧面临诱导不缓解及复发问题。难治复发多是由于白血病细胞对化疗药物产生耐药性,这部分AML患者再次缓解率低,生存期短,预后差。其治疗原则[3]包括:应用与原方案无交叉耐药的新药组成的挽救化疗方案,给予包含中、高剂量Ara-C的化疗方案,造血干细胞移植,新的靶向治疗及生物治疗,耐药逆转剂的应用等。
预激方案因其应用化疗药物剂量小,不良反应多可耐受,逐渐在AML的治疗中占据一席之地。预激方案最早于1995年提出,Yamada等[1]应用CAG方案治疗复发AML,CR率可达83%,同时不良反应较少。CAG也逐渐成为应用较成熟的预激方案,文献[4-5]指出CAG方案用于难治复发急性淋巴细胞白血病(ALL)和急性混合细胞白血病(MPAL)也取得可喜的效果。经典CAG方案由Ara-c、Acla及G-CSF组成。G-CSF即粒细胞集落刺激因子,由于几乎所有AML幼稚细胞均表达G-CSF受体,因此在预激方案中,G-CSF通过与其受体结合还可以诱导处于难杀伤的静止期(G0/G1期)的肿瘤细胞进入增殖期(S期),从而提高化疗药物尤其是Ara-C等细胞周期依赖性药物对肿瘤细胞的杀伤作用,提升化疗效果[6]。Ara-C是作用于细胞周期S期的胞嘧啶核苷的合成同类物,通过阻碍DNA的合成发挥作用,同时有一定细胞毒作用,和G-CSF有协同作用。Acla为蒽环类药物,细胞周期非特异性,与Ara-C有协同杀灭白血病细胞的作用,同时G-CSF也可增强其清除肿瘤细胞的效应。Acla在较低浓度时对白血病细胞有诱导分化作用,并且可维持细 胞内较高浓度,通过嵌入DNA双螺旋结构和抑制mRNA 合成发挥作用[6-7],对于多药耐药细胞更有效。
而我研究所创新性提出的DAC+HAAG方案,在新型预激方案HAAG的基础上加用去甲基化药物地西他滨(DAC)。HHT能使真核细胞多聚核糖体解聚,抑制其蛋白质的合成[8],干扰蛋白核体糖功能,同时可诱导白血病细胞分化和凋亡,将其阻滞于S期,即可增强Ara-C效果,同时多药联合进一步减少了耐药的发生。DAC可抑制DNA甲基转移酶,逆转过度甲基化的DNA,使由于DNA过度甲基化而失活的基因重新恢复活性,使细胞恢复正常终末分化和凋亡。也可使抑癌基因恢复正常的去甲基化状态,从而达到治疗肿瘤的目的。DAC具有双重作用机制,低剂量应用时能激活过度甲基化的沉默基因表达并促进细胞分化,高剂量时通过细胞毒作用杀死瘤细胞[9]。DAC与Ara-c可以发挥协同作用,提高Ara-c对白血病细胞的杀伤作用,提高难治复发AML患者的缓解率[10]。单药DAC用于治疗难治复发AML的临床疗效并不理想,近些年有报道DAC联合其他化疗药物治疗难治复发AML取得不错的效果[11-14],并且不良反应可耐受。
我中心创新性提出DAC联合HAAG方案治疗难治复发AML,一疗程CR率为61%,ORR为83.3%,优于既往难治复发AML治疗的文献报道,同时我们发现DAC+HAAG方案用于标准难治复发患者和一疗程标准方案诱导未缓解患者的临床疗效无差别。全部36例患者中,需要临床药物干预的3~5级感染发生率为72.2%,除1例患者死于肺部感染并发呼吸衰竭,其余患者感染均在治疗后控制。另有1例患者化疗后骨髓抑制期死于脑出血,其余患者不良反应均可耐受。可见DAC+HAAG方案在不增加毒性的基础上提高患者的治疗反应,为其造血干细胞移植等后续治疗创造了可能,同时也适用于高龄等耐受性较差的患者。同时我们发现移植患者的OS明显优于未移植患者(P=0.00),进一步证实了移植可以改善难治复发等高危AML患者的预后。但是本研究纳入标准难治复发患者1年OS不及一疗程诱导未缓解患者18例难治复发患者(P=0.01),提示难治复发患者长期生存率低。
可见,难治复发AML患者可选择DAC+HAAG方案以期降低肿瘤负荷并获得再次缓解,之后序贯造血干细胞移植,移植后更应加强MRD的监测,定期巩固治疗,延长患者长期生存时间。今后有必要纳入更多临床病例进行随机对照研究来证实DAC联合HAAG治疗难治复发AML患者的疗效和安全性。
| [1] | Yamada K, Furusawa S, Saito K, et al. Concurrent use of granulocyte colony-stimulating factor with low-dose cytosine arabinoside and aclarubicin for previously treated acute myelogenous leukemia: a pilot study[J]. Leukemia,1995, 9 (1) : 10 –14. |
| [2] | 张之南, 沈悌. 血液病诊断及疗效标准[M]. 3版 北京: 科学出版社, 2007 : 131 -134. |
| [3] | 中华医学会血液学分会. 急性髓系白血病(复发难治性)中国诊疗指南(2011年版)[J]. 中华血液学杂志,2011, 32 (12) : 887 –888. DOI:10.3760/cma.j.issn.0253-2727.2011.12.023 |
| [4] | Liu L, Qu Q, Jiao W, et al. Increasing aclarubicin dose in low-dose cytarabine and aclarubicin in combination with granulocyte colony-stimulating factor(CAG regimen) is efficacious as salvage chemotherapy for relapsed/refractory mixed-phenotype acute leukemia[J]. Leuk Res,2015, 39 (8) : 805 –811. DOI:10.1016/j.leukres,2015.04.006 |
| [5] | Xue S L, Cui H X, Zou J Y, et al. Low-dose cytarabine and aclarubicin combined with granulocyte colony-stimulating factor for the treatment of relapsed or primary refractory acute lymphocytic leukemia: a retrospective study of 25 Chinese patients[J]. HematolOncol,2013, 31 (4) : 206 –212. DOI:10.1002/hon.2051 |
| [6] | Qu Q, Liu L, Zhang Y, et al. Increasing aclarubicin dosage of the conventional CAG (low-dose cytarabine and aclarubicin in combination with granulocyte colony-stimulating factor) regimen is more efficacious as a salvage therapy than CAG for relapsed/refractory acute myeloid leukemia[J]. Leuk Res,2015, 39 (12) : 1353 –1359. DOI:10.1016/j.leukres,2015.09.014 |
| [7] | Horinaka M, Yoshida T, Nakata S, et al. Aclarubicin enhances tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis through death receptor 5 upregulation[J]. Cancer Sci,2012, 103 (2) : 282 –287. DOI:10.1111/j.1349-7006.2011.02150.x |
| [8] | Lu S, Wang J. Homoharringtonine and omacetaxine for myeloid hematological malignancies[J]. J HematolOncol,2014, 7 : 2 . DOI:10.1186/1756-8722-7-2 |
| [9] | 周华, 唐晓文. 去甲基化药物在异基因造血干细胞移植中的临床应用进展[J]. 中华临床医师杂志: 电子版,2013, 7 (24) : 11755 –11758. DOI:10.3877/cma.j.issn.1674-0785.2013.24.159 |
| [10] | Chowdhury S, Seropian S, Marks P W. Decitabine combined with fractionated gemtuzumabozogamicin therapy in patients with relapsed or refractory acute myeloid leukemia[J]. Am J Hematol,2009, 84 (9) : 599 –600. DOI:10.1002/ajh.21478 |
| [11] | 高然, 张蕊, 于锦香, 等. 地西他滨联合半量CAG方案治疗老年性及复发难治性急性髓细胞白血病的疗效分析[J]. 中国医科大学学报,2013, 42 (6) : 515 –517. DOI:10.3969/j.issn.0258-4646.2013.06.009 |
| [12] | Qin T, Youssef E M, Jelinek J, et al. Effect of cytarabine and decitabine in combination in human leukemic cell lines[J]. Clin Cancer Res,2007, 13 (14) : 4225 –4232. DOI:10.1158/1078-0432.CCR-06-2762 |
| [13] | Song LX, Xu L, Li X, et al. Clinical outcome of treatment with a combined regimen of decitabine and aclacinomycin/cytarabine for patients with refractory acute myeloid leukemia[J]. Ann Hematol,2012, 91 (12) : 1879 –1886. DOI:10.1007/s00277-012-1550-y |
| [14] | Kantarjian H M, Thomas X G, Dmoszynska A, et al. Multicenter, randomized, open-label, phase Ⅲ trial of decitabineversus patient choice, with physician advice, of either supportive care or low-dose cytarabine for the treatment of older patients with newly diagnosed acute myeloid leukemia[J]. J ClinOncol,2012, 30 (21) : 2670 –2677. DOI:10.1200/JCO.2011.38.9429 |



