内源性神经干细胞(neural stem cell,NSC)具有改善卒中后神经功能缺损的潜能[1-2]。脑缺血损伤可促进脑室下区(sub ventricular zone,SVZ)成神经干细胞增殖迁移到损伤区域分化为成熟的神经细胞补充缺血区神经细胞的丢失[3]。而在成人甚至是年老的卒中患者中也已经证实脑卒中可以诱发神经再生。但是NSC的增殖非常有限,患者的神经功能恢复欠佳,所以找到一个有效的外源性干预手段来促进内源性神经细胞再生至关重要。课题组前期的研究已证实,缺血性脑损伤使缺血侧皮质内脑衰反应调节蛋白2(collapsin response mediator protein 2,CRMP2)表达下降,并不利于轴突修复;而阻断CRMP2的磷酸化有利于轴突再生[4]。其他研究发现,在大鼠大脑中动脉缺血(middle cerebral artery occlusion,MCAO)模型中病灶侧缺血半暗带及纹状体内的CRMP2的表达水平升高,可能与缺血后的神经再生有关[5];在人类免疫缺陷病毒相关性认知障碍研究中发现病毒相关蛋白Tat通过激活细胞周期依赖性蛋白激酶5(cyclin dependent kinase,CDK5)调节其下游因子CRMP2、Tau及神经元迁移蛋白(doublecortin,DCX),从而影响细胞的再生、迁移分化、血管新生及轴突重塑[6]。因此,我们推测CRMP2可能是一个能够调节内源性神经干细胞增殖的蛋白,但其具体的作用机制尚不明确。本实验采用立体定位注射CRMP2真核表达质粒的方式,使大鼠脑内CRMP2表达升高,探索CRMP2对大鼠缺血再灌注损伤后神经元及神经干细胞的影响及潜在机制。
1 材料与方法 1.1 试剂及器材CRMP2真核表达质粒pCDNA3.1+(上海生工),兔抗CRMP2(美国CST公司),兔抗β-actin(Proteintech),山羊抗兔二抗(碧云天公司),兔抗脑源性神经营养因子(brain derived neurotrophic factor,BDNF,美国Abcam),兔抗DCX(Proteintech),兔抗微管相关蛋白2(microtubule associated protein 2,MAP2,Proteintech),兔抗胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP,Proteintech),Edu试剂盒(广州锐博)。大鼠脑立体定位仪(深圳瑞沃德)。
1.2 实验方法 1.2.1 动物及分组健康成年雄性SD大鼠60只,体质量200~250 g,由重庆医科大学实验动物中心提供,分为假手术组(sham)、缺血再灌注组(MCAO)、缺血再灌注加空白质粒组(MCAO+GFP)、缺血再灌注加CRMP2真核质粒干预组(MCAO+CRMP2,n=15),其中用于Western blot检测、荧光及组化检测、神经功能评分各5只大鼠。
1.2.2 脑立体定位注射以前囟为坐标原点,右侧侧脑室注射的坐标点为1.2、-1.5、-4.5 mm。大鼠缺血再灌注模型手术前1 d进行立体定向手术,CRMP2真核表达质粒(160 ng/μL)或者空载体质粒(160 ng/μL)分别注射到对应组别的对应靶点,每个点注射质粒4 μL,注射速度为0.3 μL/min,注射完毕后留针5 min。
1.2.3 大鼠大脑中动脉缺血再灌注模型制备参照本课题组前期的实验操作方法[5]:大鼠经腹腔注射浓度为10%的水合氯醛(3.5 mL/kg),固定在操作台上,脑正中切口,分离出颈总动脉、颈外动脉、颈内动脉,游离颈外动脉,夹闭颈总和颈内动脉,将直径0.20 mm、头端0.40 mm的栓从颈外缓慢逆行插入颈内动脉,在17~19 mm处感阻力,结扎固定线栓,2 h后再灌注。结合Longa评分,1~3分纳入实验,0、4分以及取材有蛛网膜下腔出血者剔除,从同批次模型中随机补充。
1.2.4 Edu标记神经细胞再生建立缺血再灌注模型成功后,根据Edu染色试剂盒说明书提示,第5、6天注射浓度为1 mg/mL的Edu溶液(5 mg/kg),每天注射2次,第7天注射1次,4 h后灌注取脑。
1.2.5 Western blot检测缺血再灌注7 d后将大鼠断头取脑,取右侧缺血区皮质液氮速冻后-80 ℃保存。按照蛋白提取说明书提取总蛋白,计算蛋白浓度,配至5 μg/μL。蛋白样品在浓度为10%的SDS-PAGE凝胶中分离后,转移至PVDF膜上,浓度为5 g/L的脱脂牛奶封闭90 min,CRMP2(55~65)×103一抗(1 ∶1 000)、BDNF(28×103)一抗(1 ∶400)及N-甲基-D-天冬氨酸受体2B(N-methyl-D-aspartate receptor 2B,NMDAR2B)(166×103)一抗(1 ∶800)4 ℃孵育18 h,山羊抗兔二抗(1 ∶1 000)37 ℃孵育1 h后,Fusion软件扫描分析。
1.2.6 免疫荧光及免疫组化为行免疫荧光双标记,Edu标记后的大鼠在7 d灌注取脑,多聚甲醛固定,冰冻切片成厚10 μm的贴片,-80 ℃保存。切片,晾干,修复后,Nestin(1 ∶50)、MAP2(1 ∶50)及GFAP(1 ∶100)一抗孵育,4 ℃过夜,山羊抗兔FITC(1 ∶50)避光孵育2 h,甘油封片或者加Edu染色试剂盒染色后甘油封片,而Edu单标则仅需Edu染色,甘油封片,共聚焦显微镜扫描并拍照。进行免疫组化染色的冰冻切片,-80 ℃拿出,晾干修复后,37 ℃,加3%H2O2孵育20 min,封闭后加CRMP2(1 ∶50)一抗孵育4 ℃过夜,山羊抗兔二抗孵育30 min,辣根过氧化物酶反应30 min,DAB染色加苏木精复染,最后中性树胶封片,拍照。
1.2.7 神经功能评分采用Shen等[7]的评估方法,最低分为3分,最高分为18分,得分越低表示神经功能缺损越严重。
1.3 统计学分析采用SPSS 22.0统计软件,数据以x±s表示,多组间比较行单因素方差分析,方差齐是两两比较行LSD检验,方差不齐时行Tamhane检验。检验水准α=0.05。
2 结果 2.1 各组大鼠脑缺血侧皮质MAP2及GFAP的表达与sham组相比,再灌注后7 d,MCAO组大鼠可见明显的神经元丢失及大量胶质细胞的激活。MCAO+ GFP组大鼠皮质MAP2及GFAP的表达与MCAO组无明显差异(P>0.05)。而CRMP2真核质粒干预后,MAP2表达增多(P < 0.05),GFAP的表达明显减少(P < 0.05)。结果见图 1,表 1。
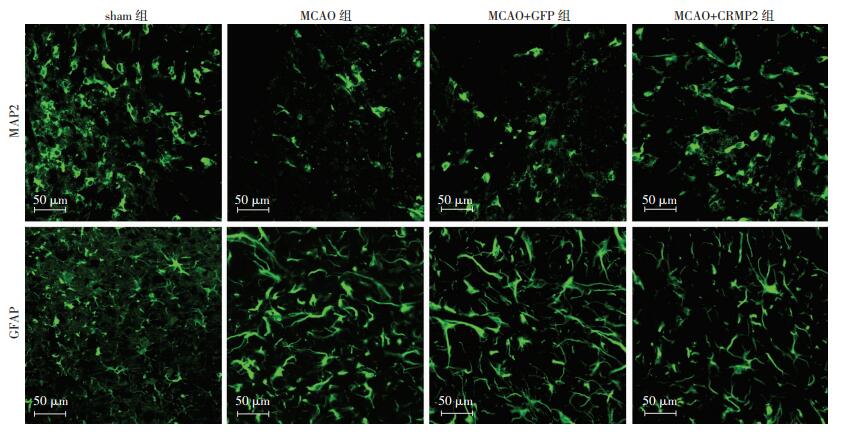
|
| 图 1 脑缺血再灌注7 d各组大鼠缺血皮质MAP2及GFAP的表达情况 (免疫荧光) |
| 组别 | MAP2 | GFAP |
| sham组 | 118.20±13.00 | 12.20±5.63 |
| MCAO组 | 47.00±8.69a | 80.00±7.90a |
| MCAO+GFP组 | 48.40±8.44ab | 80.60±7.91ab |
| MCAO+CRMP2组 | 76.20±6.76ac | 59.40±3.65ac |
| a:P < 0.05,与sham组比较;b:P < 0.05,与MCAO+CRMP2组比较;c:P < 0.05,与MCAO组比较 | ||
2.2 各组大鼠SVZ及缺血侧皮质Edu标记的阳性细胞数
共聚焦结果显示,与假手术比较,脑缺血再灌注损伤促进了SVZ及缺血侧皮质Edu标记阳性细胞的表达(P < 0.05);而CRMP2真核质粒干预之后Edu标记阳性细胞在这两个部位的表达量较其余3组均明显增多(P < 0.05),提示过表达的CRMP2可促进神经细胞增殖(表 2,图 2)。
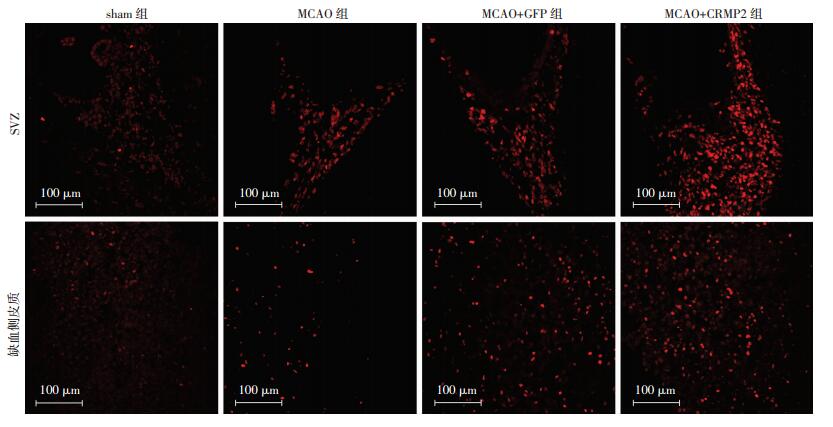
|
| 图 2 脑缺血再灌注7 d各组大鼠SVZ及缺血侧皮质Edu标记阳性细胞的表达 (免疫荧光) |
| 组别 | SVZ | 缺血侧皮质 |
| sham组 | 5.60±2.07 | 3.00±2.23 |
| MCAO组 | 62.00±7.65a | 39.60±7.92a |
| MCAO+GFP组 | 62.60±7.06ab | 39.60±8.44ab |
| MCAO+CRMP2组 | 100.20±11.52ac | 96.80±6.30ac |
| a:P < 0.05,与sham组比较;b:P < 0.05,与MCAO+CRMP2组比较;c:P < 0.05,与MCAO组比较 | ||
2.3 各组大鼠SVZ Nestin/Edu双标细胞观察
免疫荧光双标结果显示,缺血再灌注后7 d,MCAO组及MCAO+GFP组Nestin[(31.60±5.50) vs (0.80±0.84)]与Edu[(31.60±5.40) vs (0.80±0.84)]的双标数量较sham组明显增多(P < 0.05),而两组之间差异无统计学意义(P>0.05)。过表达CRMP2之后Nestin与Edu的双标数量(57.20±4.80)较其余3组明显增多(P < 0.05),提示CRMP2促进了内源性神经干细胞的增殖(图 3~5)。
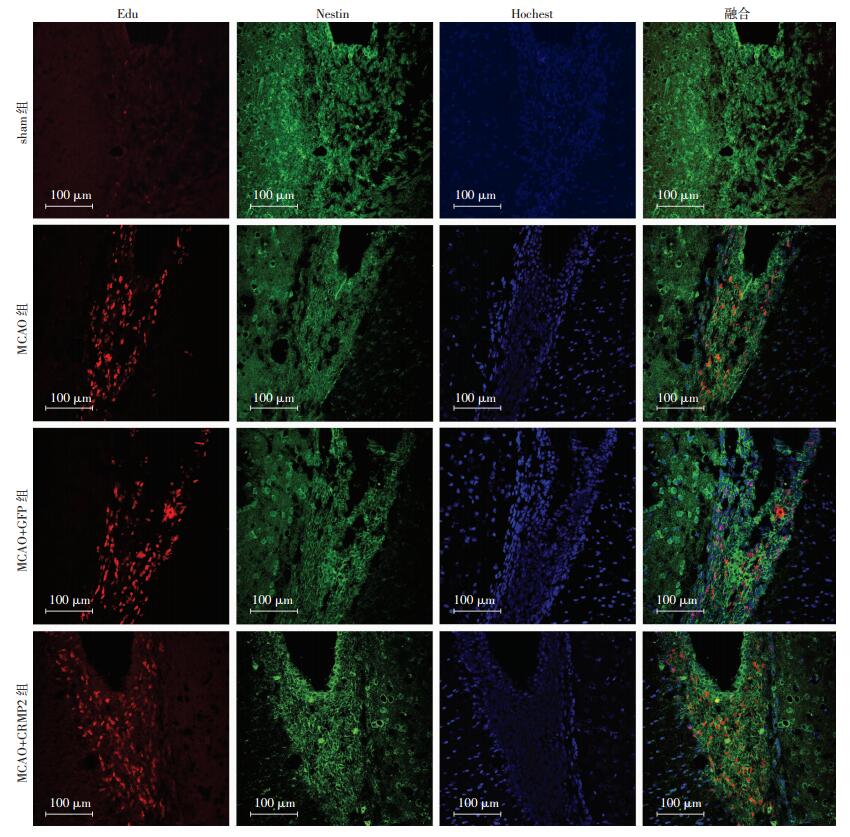
|
| 图 3 脑缺血再灌注后7 d各组大鼠Nestin与Edu双标记细胞形态观察 (免疫荧光) |

|
| LV:侧脑室;SVZ:脑室下区 图 4 脑缺血再灌注7 d后MCAO组大鼠Edu标记的侧脑室形态观察 (激光共聚焦显微镜×100) |
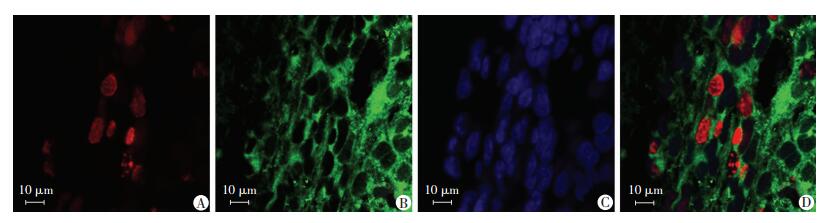
|
| A: Edu; B: Nestin; C: Hochest; D:融合 图 5 脑缺血再灌注7 d后Nestin与Edu双标记细胞形态观察 (免疫荧光) |
2.4 各组大鼠缺血侧皮质CRMP2、BDNF及NMDAR2B蛋白表达
与sham组相比,MCAO及MCAO+GFP组CRMP2表达明显降低(P < 0.05),而BDNF及NMDAR2B的表达明显升高(P < 0.05)。与其余3组比较,CRMP2真核质粒干预后上调了CRMP2的表达,且使BDNF表达进一步增高(P < 0.05);同时降低了NMDAR2B的表达(P < 0.05,图 6,表 3)。

|
| 1:sham组;2:MCAO组;3:MCAO+GFP组;4:MCAO+CRMP2组 图 6 脑缺血再灌注7 d各组大鼠脑组织CRMP2、BDNF及NMDAR2B的表达 |
| 组别 | CRMP2蛋白灰度比值 | BDNF蛋白灰度比值 | NMDAR2B蛋白灰度比值 |
| sham组 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 |
| MCAO组 | 0.52±0.14a | 2.16±0.22a | 1.52±0.07a |
| MCAO+GFP组 | 0.52±0.14ab | 2.18±0.21ab | 1.53±0.07ab |
| MCAO+CRMP2组 | 0.85±0.08ac | 3.28±0.19ac | 1.27±0.05ac |
| a:P < 0.05,与sham组比较; b:P < 0.05,与MCAO+CRMP2组比较; c:P < 0.05,与MCAO组比较 | |||
2.5 免疫组化观察CRMP2的表达部位
再灌注后7 d,通过免疫组化染色观察到CRMP2表达部位,结果显示CRMP2主要在细胞质表达(图 7)。
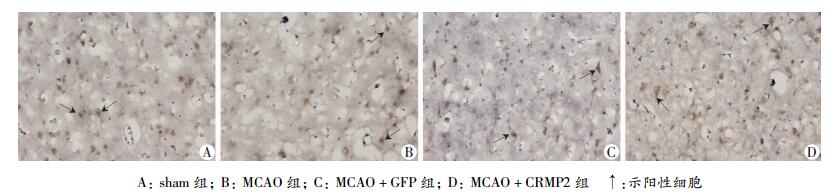
|
| 图 7 免疫组化观察脑缺血再灌注7 d各组大鼠CRMP2的表达 (SABC ×400) |
2.6 神经功能评估
MCAO组(8.98±0.92)和MCAO+GFP组(8.86±1.11)脑缺血再灌注后7 d,与sham组(17.23±0.31)相比,显示出严重的神经功能缺损(P < 0.05);而给予CRMP2真核质粒干预后,大鼠神经功能评分较MCAO组、MCAO+GFP组有明显改善[(11.96±1.23),P < 0.05]。
3 讨论脑缺血再灌注损伤的病理过程极为复杂,包括兴奋性氨基酸毒性、离子不平衡、氧化应激、炎症反应、自噬、凋亡和细胞坏死等[8],导致大量的神经细胞丢失;同时使星形胶质细胞活化并增生形成反应性星形胶质细胞,部分形成胶质瘢痕,作为一个物理屏障阻碍轴突再生,同时释放大量的炎症介质进一步损伤神经细胞[9]。在对大鼠缺血性脑损伤的研究中发现CRMP2可能具有多重的神经保护作用[4, 10]。NSC在卒中后的神经修复潜能已经得到肯定[1-3],而CRMP2可能对其增殖有一定的影响[6-7]。
类似前期研究结果[4, 10],本实验结果证实缺血损伤后大鼠皮质CRMP2的表达较sham组明显降低。而CRMP2真核质粒干预后,CRMP2的表达量较MCAO组明显升高,证实真核质粒干预后,能使大鼠缺血侧脑组织CRMP2表达上调。脑缺血损伤可使CRMP2在体内磷酸化,致使pCRMP2表达增加,而CRMP2表达下调,该变化不利于轴突再生[4]。同时缺血后的兴奋性毒性反应及NMDA受体表达的上调将激活钙调蛋白酶(calpain),从而裂解全长CRMP2(64×103),生成55×103的短CRMP2[11];大部分神经系统疾病损伤均将导致轴突退化,而轴突退化研究中发现CRMP2可被calpain酶解生成58×103的片段[12]。CRMP2具有多个calpain酶解位点[12],被酶解后的片段还可发生核异位,而脑缺血损伤所诱发的酶解发生于哪些位点,是否有更小的降解片段目前尚不清楚。由此,我们推测,脑缺血损伤后CRMP2表达降低可能与其被磷酸化及酶解等有关。
本实验将CRMP2真核表达质粒转染到大鼠颅内后,观察了缺血后神经元及胶质细胞的数量以及其对SVZ内神经干细胞增殖的影响。结果表明,缺血再灌注后7 d,过表达CRMP2使神经元丢失减少,同时抑制了胶质细胞的过度活化,提示CRMP2可改善缺血性脑损伤对神经细胞结构及分布的破坏,为神经修复提供良好的内环境。本研究发现,CRMP2促进了SVZ及缺血皮质Edu标记阳性细胞的表达,提示CRMP2可促进脑缺血再灌注后神经细胞的增殖,调动了神经修复的启动。同时,过表达CRMP2促进了SVZ Nestin/Edu标记阳性细胞的表达,提示CRMP2促进了内源性神经干细胞的增殖。此外,过表达CRMP2还减轻了神经功能缺损。
为了对CRMP2的作用机制有进一步的认识,本实验还检测了BDNF在各组大鼠脑组织中的表达,发现脑缺血再灌注后BDNF表达升高,而过表达CRMP2使BDNF进一步升高。BDNF已经被证实可通过其受体TrkB介导内源性神经干细胞的再生[13];还可通过依赖细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)方式激活转录因子NF-κB[14],后者是神经细胞再生的重要调节因子[15]。有研究证实CRMP2可调节BDNF受体TrkB向轴突终端的传送[16],实现BDNF的信号传导,从而我们推测,CRMP2促进神经再生可能是通过上调BDNF的表达来实现的,其具体调节方式可能是通过CRMP2/BDNF/ERK/NF-κB信号通路来完成。
有研究表明,采用NMDAR抑制剂MK801抑制其表达之后可促进成年大鼠神经细胞的增殖[17];同时发现用甲基苯丙胺上调NMDAR2B的表达抑制了神经细胞的增殖[18-19]。这些均证明NMDA受体对神经再生的抑制效应。前期研究发现CRMP2酶解后可降低细胞表面NMDAR2B的表达[11]。本实验证实,脑缺血再灌注损伤之后NMDAR2B表达升高,而上调CRMP2抑制了其表达,同时促进了神经再生。由此,我们推测CRMP2还可能通过抑制NMDAR2B的表达促进神经细胞的再生。而有研究发现,NMDA受体的过度激活可通过转录激活NF-κB[20],抑制NMDA受体的表达能够上调BDNF及其受体TrkB及P75的表达,而这种效应能被ERK抑制剂所抑制[21]。结合前面的结果,我们进一步推测CRMP2可能是通过调节NMDA受体及BDNF的表达促进神经细胞再生。
综上所述,上调CRMP2的表达可改善神经细胞的病理损伤,为神经修复提供良好的内环境,同时还可促进神经细胞的再生,说明CRMP2具有多重的神经调节作用,可能是一个具有巨大神经保护潜能的蛋白分子。这些作用可能与CRMP2调节了BDNF及NMDAR2B的信号传递有关,我们将在以后的研究中对其进行更深入地探讨。
| [1] | Peron S, Berninger B. Imported Stem Cells Strike against Stroke[J]. Cell Stem Cell,2015, 17 (5) : 501 –502. DOI:10.1016/j.stem.2015.10.006 |
| [2] | Lindvall O, Kokaia Z. Neurogenesis following stroke affecting the adult brain[J]. Cold Spring Harb Perspect Biol,2015, 7 (11) : pii: a019034 . DOI:10.1101/cshperspect.a019034 |
| [3] | Luo J, Hu X, Zhang L, et al. Physical exercise regulates neural stem cells proliferation and migration via SDF-1α/CXCR4 pathway in rats after ischemic stroke[J]. Neurosci Lett,2014, 578 : 203 –208. DOI:10.1016/j.neulet.2014.06.059 |
| [4] | Wang T, Wu X, Yin C, et al. CRMP-2 is involved in axon growth inhibition induced by RGMa in vitro and in vivo[J]. Mol Neurobiol,2013, 47 (3) : 903 –913. DOI:10.1007/s12035-012-8385-3 |
| [5] | Indraswari F, Wong P T, Yap E, et al. Upregulation of Dpysl2 and Spna2 gene expression in the rat brain after ischemic stroke[J]. Neurochem Int,2009, 55 (4) : 235 –242. DOI:10.1016/j.neuint.2009.03.005 |
| [6] | Fields J A, Dumaop W, Crews L, et al. Mechanisms of HIV-1 Tat neurotoxicity via CDK5 translocation and hyper-activation: role in HIV-associated neurocognitive disorders[J]. Curr HIV Res,2015, 13 (1) : 43 –54. DOI:10.2174/1570162X13666150311164201 |
| [7] | Shen L, Miao J, Yuan F, et al. Overexpression of adiponectin promotes focal angiogenesis in the mouse brain following middle cerebral artery occlusion[J]. Gene Ther,2013, 20 (1) : 93 –101. DOI:10.1038/gt.2012.7 |
| [8] | Li H, Liu X, Zhu Y, et al. Magnolol derivative 002C-3 protects brain against ischemia-reperfusion injury via inhibiting apoptosis and autophagy[J]. Neurosci Lett,2015, 588 : 178 –183. DOI:10.1016/j.neulet.2015.01.007 |
| [9] | Yuan J, Zou M, Xiang X, et al. Curcumin improves neural function after spinal cord injury by the joint inhibition of the intracellular and extracellular components of glial scar[J]. J Surg Res,2015, 195 (1) : 235 –245. DOI:10.1016/j.jss.2014.12.055 |
| [10] | Nada S E, Tulsulkar J, Shah Z A. Heme oxygenase 1-mediated neurogenesis is enhanced by Ginkgo biloba (EGb 761) after permanent ischemic stroke in mice[J]. Mol Neurobiol,2014, 49 (2) : 945 –956. DOI:10.1007/s12035-013-8572-x |
| [11] | Bu X, Zhang N, Yang X, et al. Proteomic analysis of cPKCβⅡ-interacting proteins involved in HPC-induced neuroprotection against cerebral ischemia of mice[J]. J Neurochem,2011, 17 (2) : 346 –356. DOI:10.1111/j.1471-4159.2011.07209.x |
| [12] | Touma E, Kato S, Fukui K, et al. Calpain-mediated cleavage of collapsin response mediator protein(CRMP)-2 during neurite degeneration in mice[J]. Eur J Neurosci,2007, 26 (12) : 3368 –3381. DOI:10.1111/ejn.2007.26.issue-12 |
| [13] | Vilar M, Mira H. Regulation of Neurogenesis by Neurotrophins during Adulthood: Expected and Unexpected Roles[J]. Front Neurosci,2016, 10 : 26 . DOI:10.3389/fnins.2016.00026 |
| [14] | Ortega F, Perez-Sen R, Morente V, et al. P2X7, NMDA and BDNF receptors converge on GSK3 phosphorylation and cooperate to promote survival in cerebellar granule neurons[J]. Cell Mol Life Sci,2010, 67 (10) : 1723 –1733. DOI:10.1007/s00018-010-0278-x |
| [15] | Kaltschmidt B, Kaltschmidt C. NF-KappaB in Long-Term Memory and Structural Plasticity in the Adult Mammalian Brain[J]. Front Mol Neurosci,2015, 8 : 69 . DOI:10.3389/fnmol.2015.00069 |
| [16] | Arimura N, Kimura T, Nakamuta S, et al. Anterograde transport of TrkB in axons is mediated by direct interaction with SlP1 and Rab27[J]. Dev Cell,2009, 16 (5) : 675 –686. DOI:10.1016/j.devcel.2009.03.005 |
| [17] | Gao Z Y, Yang P, Huang Q J, et al. The influence of dizocilpine on the reserpine-induced behavioral and neurobiological changes in rats[J]. Neurosci Lett,2016, 614 : 89 –94. DOI:10.1016/j.neulet.2016.01.006 |
| [18] | Singhakumar R, Boontem P, Ekthuwapranee K, et al. Melatonin attenuates methamphetamine-induced inhibition of neurogenesis in the adult mouse hippocampus: An in vivo study[J]. Neurosci Lett,2015, 606 : 209 –214. DOI:10.1016/j.neulet.2015.09.011 |
| [19] | Ekthuwapranee K, Sotthibundhu A, Govitrapong P. Melatonin attenuates methamphetamine-induced inhibition of proliferation of adult rat hippocampal progenitor cells in vitro[J]. J Pineal Res,2015, 58 (0) : 418 –428. DOI:10.1111/jpi.12225 |
| [20] | Delavallee L, Cabon L, Galan-Malo P, et al. AIF-mediated caspase-independent necroptosis: a new chance for targeted therapeutics[J]. IUBMB Life,2011, 63 (4) : 221 –232. DOI:10.1002/iub.432 |
| [21] | Yu W, Zhu H, Wang Y, et al. Reactive Transformation and Increased BDNF Signaling by Hippocampal Astrocytes in Response to MK-801[J]. PLoS One,2015, 10 (12) : e0145651 . DOI:10.1371/journal.pone.0145651 |



