T-淋巴母细胞淋巴瘤(T-lymphoblastic lymphoma,T-LBL)为高度侵袭性淋巴瘤,对其治疗目前仍无规范的指南推荐。先后给予传统的非霍奇金淋巴瘤、儿童急性淋巴细胞白血病强化样方案治疗成人T-LBL,完全缓解(complete remission,CR)虽然有了明显提高,但其复发率仍较高。对于复发患者,二线方案解救疗效欠佳,即使采用大剂量化疗联合自体造血干细胞移植 (autologous peripheral blood stem cell transplant,APSCT) 方案,死亡率仍较高。Gokbuget等[1]研究发现:对于复发的T-LBL,APSCT 1年总生存率(overall survival,OS)为24%,6年OS仅为11%。异基因造血干细胞移植由于其HLA相合供体限制、移植费用高、移植物抗宿主病(graft-versus-host disease,GVHD)发生率高、移植相关死亡率高等问题,影响了其整体疗效。如何提高成人T-LBL的治疗效果,减低复发率仍是临床上需要探索的课题。双次APSCT可以通过两次超大剂量预处理,最大限度地减少血液肿瘤患者体内肿瘤细胞,发挥体内净化作用,减少移植后复发率,从而增加长期无病生存率。该方法已经成功应用于复发难治的恶性淋巴瘤的治疗并取得了较好的临床疗效,但对于T-LBL,目前尚无大宗病例临床报道。基于上述原因,我们自2008年2月至2013年11月对住院治疗的21例T-LBL患者进行了双次APSCT,现将其治疗效果、安全性及疗效报告如下。
1 资料与方法 1.1 病例资料收集2008年2月至2013年11月我中心进行双次APSCT的T-LBL住院患者21例。其中男性16例,女性5例,初诊年龄范围:18~50岁,中位年龄29岁;ECOG评分:0~1分 8例,≥2分 13例;按Ann Arbor分期系统:Ⅲ期5例,Ⅳ期16例,伴随B症状有12例。aaIPI评分2分8例,3分13例;纵隔肿块4例,骨髓侵犯12例,中枢侵犯2例,多浆膜腔积液2例;移植前处于完全缓解(complete remission,CR)16例,部分缓解(partial remission,PR)为5例。所有患者均接受急性淋巴细胞白血病样含多药联合强烈治疗方案诱导治 疗,如VDCP(长春新碱、吡柔比星、环磷酰胺、泼尼松)± 左旋门冬酰胺酶、Hyper-CVAD(环磷酰胺、长春新碱、多柔吡星、地塞米松),以及以大剂量甲氨蝶呤、中剂量阿糖胞苷、大剂量环磷酰胺等为基础的巩固、强化治疗。化疗期间给予规范的中枢神经系统淋巴瘤的预防和治疗。21例患者均签署知情同意,并且获得第三军医大学伦理委员会批准。
1.2 自体造血干细胞动员采用MOED+MTX[米托蒽醌 6 mg/(m2·d),静脉滴注,第1~3天,长春地辛 1.4 mg/(m2·d),静脉滴注,第1天,依托泊苷 100 mg/(m2·d),静脉滴注,第1~3天,地塞米松 15~20 mg,静脉滴注,第1~5天或第1~7天,甲氨蝶呤 2 g/(m2·d),静脉滴注,第6天]方案动员,其中5例患者因第1次动员的干细胞数量不能满足双次自体造血干细胞移植需要量,使用CTOD方案[环磷酰胺 750 mg/(m2·d),静脉滴注,第1天,吡柔比星 40 mg/(m2·d),静脉滴注,第1~3天,长春新碱 2 mg/(m2·d),静脉滴注,第1天,地塞米松15~20 mg,静脉滴注,第1~5天或第1~7天]第2次移植前再动员。单次移植所需外周血单个核细胞数(mononuclear cells,MNC)>4×108/kg,CD34+细胞数>2×106/kg,采集的细胞经程序降温仪冷冻,-80 ℃冰箱冻存。移植前42 ℃快速复温,以台盼蓝拒染率计数活细胞比例[2]。
1.3 预处理方案及造血重建评判指标第1次自体移植预处理方案采用CEAC[环己亚硝脲 200 mg/(m2·d),静脉滴注,第1天,环磷酰胺 1 g/(m2·d),静脉滴注,第2~3天,阿糖胞苷1.0 g/m2,每12小时1次,第1~4天,依托泊苷100 mg/(m2·d),静脉滴注,第1~4天]。预处理结束后休息1 d回输自体外周血MNC 5.6×108/kg[(4.2~9.5)×108/kg],CD34+细胞数3.7×106/kg[(2.2~11.8)×106/kg]。 第2次自体移植预处理方案采用IAC[伊达比星10 mg静脉滴注,第1~3天,环磷酰胺1 g/(m2·d),静脉滴注,第2~3天,阿糖胞苷1.0 g/m2,每12小时1次,第1~4天]。预处理结束后休息1 d回输自体外周血MNC 4.9×108/kg[(4.3~11.8)×108/kg],CD34+细胞2.9×106/kg[(2.5~8.5)×106/kg]。以外周血中性粒细胞绝对值大于0.5×109/L,持续3 d,未输注血小板情况下血小板> 20×109/L为造血功能重建。
1.4 移植后主要并发症的防治 1.4.1 肝静脉闭塞病低分子肝素钙5 000 IU皮下注射每天1次;前列地尔注射液20 μg/d;血小板<50×109/L停用低分子右旋糖酐、阿魏酸钠或复方丹参注射液。
1.4.2 巨细胞病毒感染的监测、预防和治疗自预处理开始每周监测血巨细胞病毒(cytomegalovirus,CMV)DNA。移植前使用更昔洛韦/阿昔洛韦常规预防,若出现病原学阳性给予更昔洛韦或鳞甲酸纳抗病毒治疗[3-4]。
1.4.3 其他感染的防治进入层流病房前1周即开始予氟康唑、复方磺胺甲噁唑(SMZ)、诺氟沙星行肠道清洁预防感染。移植后如出现发热,积极寻找感染灶,行血液细菌培养,造血重建前予广谱抗生素抗感染治疗。如出现(或疑似)真菌感染,给予广谱抗真菌药物治疗。
1.4.4 其他移植并发症的处理患者移植期间均常规给予保肝、护心、保护胃肠道黏膜和止吐等对症支持治疗;血红蛋白<60 g/L时输注浓缩红细胞,血小板<20×109/L时输注新鲜血小板等。
1.5 统计学方法主要终点为OS时间:从双次移植后至任何原因引起的死亡时间。无进展生存期(progression-free survival,PFS)时间:从双次移植后到疾病复发/进展或发生因为任何原因引起的死亡时间。两次移植造血恢复时间比较采用t检验;Kaplan-Meier估计生存曲线,单因素分析采用对数秩检验。P<0.05被视为差异有统计学意义。所有统计均用SPSS 19.0软件进行。
2 结果 2.1 植入情况所有患者双次自体移植后造血功能均顺利重建,第1次自体移植后中性粒细胞恢复至0.5×109/L的中位时间12 d(移植后9~21 d),血小板恢复至20×109/L的中位时间13 d(移植后9~31 d)。第2次自体移植中性粒细胞恢复的中位时间14 d (移植后10~17 d),血小板恢复的中位时间14 d(移植后8~50 d)。2次移植后造血重建时间差异无统计学意义(P>0.05)。
2.2 移植并发症患者移植并发症中,以发热及消化道症状(恶心呕吐)发生率较高,予以抗感染及止吐等治疗后缓解,不影响整个治疗的进程。其中,第1次移植过程中有14例出现了消化道症状,第2次移植过程中有7例;第1次移植过程中有6例出现口腔溃疡,第2次移植过程中有5例;双次移植过程中各有16例出现了发 热,3例出现皮肤黏膜出血。第1次移植过程中有1例发生肝功损害,2例发生了出血性膀胱炎,1例出现了植入综合征。未发现继发第二肿瘤和慢性心脏毒性。
2.3 临床疗效21例T-LBL患者,第1次移植前CR或接近CR 16例,PR 5例,双次移植后CR 17例,PR 4例,其中第1次移植后CR 19例,PR 2例,至双次移植前有5例患者出现疾病进展,其中3例给予二线方案化疗后再次达CR,2例化疗后PR。随访至2015年1月,中位随访24(2~81)个月,复发3例,死亡4例,其中复发死亡2例,疾病进展死亡1例,移植相关死亡1例,无病存活12例,4例疾病稳定,1例研究截止时疾病复发进展,3年预期无进展生存率为68.9%,总生存率为73.6%(图 1)。
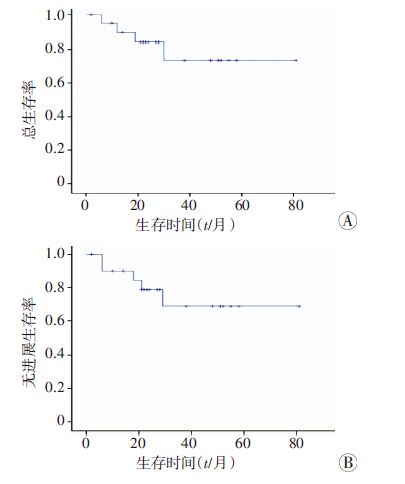
|
| 图 1 T-LBL患者的总生存曲线(A)和无进展生存曲线(B)分析 |
2.4 预后因素
单因素分析中,患者的aaIPI评分、疾病分期、有无B症状、移植前化疗次数、有无纵隔包块、中枢及骨髓侵犯与否对PFS和OS无影响(P>0.05);而患者的中位年龄是否小于29岁、第1次移植后疾病状态是否CR影响患者的OS和PFS(图 2、3);第1次移植前疾病状态是否CR影响患者的OS(P<0.05,图 4)。
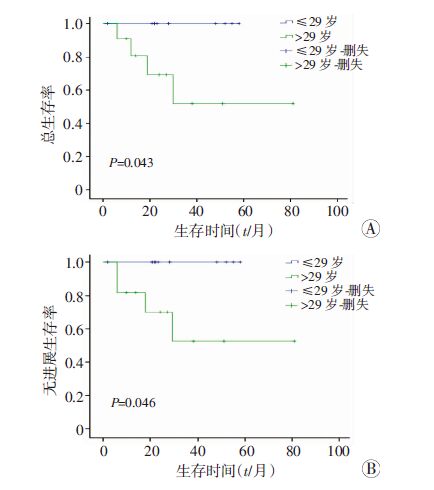
|
| 图 2 中位年龄对T-LBL患者的OS(A)和PFS生存(B)的影响 |
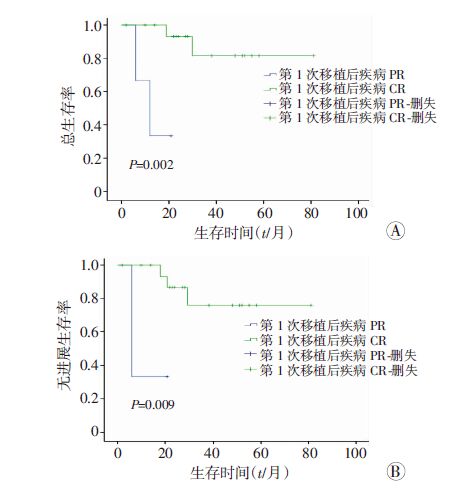
|
| 图 3 第1次移植后疾病状态是否CR对T-LBL患者的OS(A)和PFS(B)的影响 |
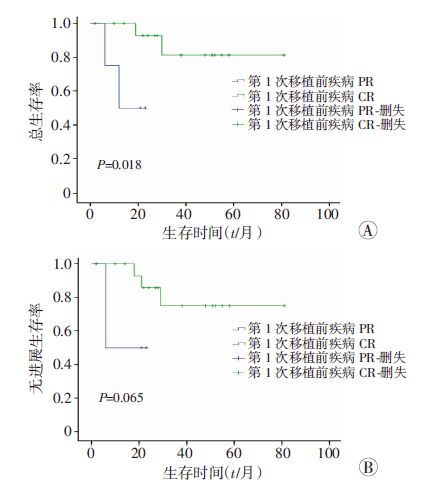
|
| 图 4 第1次移植前疾病状态是否CR对T-LBL患者的OS(A)和PFS(B)的影响 |
3 讨论
T-淋巴母细胞淋巴瘤的治疗目前仍无最佳方案,临床上以ALL样强化方案联合自体造血干细胞移植为主。一些回顾性研究证实大剂量化疗联合自体造血干细胞移植较序贯化疗可改善生存,但前瞻随机性研究表明大剂量化疗联合APSCT并不能提高患者的总生存率[5]。异基因造血干细胞移植伴发较高的移植相关死亡率(transplantation related mortality,TRM,移植后6个月TRM 18%),导致其整体疗效并不优于自体HSCT[6]。如何提高T-LBL患者的OS及PFS,减少复发,目前仍是临床关注的重点内容。
常规化疗无法彻底清除体内的肿瘤细胞,微小残留病灶中肿瘤细胞增殖浸润成为复发的主要原因。提高化疗剂量可以增加对微小残留病灶的清除效果,在此基础上联合自体造血干细胞移植可明显增加对包括淋巴瘤在内的血液系统恶性肿瘤的治疗效果。双次APSCT通过重复的超剂量化疗达到体内二次净化的作用,能更好地清除体内残留肿瘤细胞,从而减少移植后微小残留病进而减少复发率。双次APSCT技术 在血液系统恶性肿瘤如急性白血病、多发性骨髓瘤中已成功应用并取得了较好的临床疗效[7]。近年来,该移植技术在淋巴瘤的应用也有相应的临床研究探讨。Le-Gouill等[8]对15例难治复发高危NHL(non-Hodgkin’s lymphoma,NHL) 患者进行双次APSCT,中位随访20(5~55)个月,其总体生存率为67%。Espigado等[9]研究也表明双次APSCT治疗恶性淋巴瘤患者,12年总体生存率可达71%,显著高于未接受移植者;而在第1次达到完全缓解进行移植者和进展期时移植的12年总体生存率分别为89%和65%,二者差异有统计学意义。Vranovsky等[10]研究发现,将双次自体移植作为高危侵袭性淋巴瘤的一线治疗方案,其有效率可达79%,预计5年生存率为59%。上述研究所报道的淋巴瘤主要为弥漫大B细胞淋巴瘤、套细胞淋巴瘤以及外周T细胞淋巴瘤,而目前尚无对T-LBL的大宗病例报道。
我们的研究发现,所有患者双次自体移植后造血 功能均顺利重建。2次移植后中性粒细胞恢复至0.5× 109/L的中位时间分别为12 d和14 d,血小板恢复至20×109/L的中位时间分别为13 d和14 d,2次移植后中性粒细胞的重建及血小板的重建时间差异均无统计学意义。其中12例患者初诊时已出现了骨髓侵犯,多数患者在自体移植前接受了平均5(3~9)个疗程的化疗,骨髓耐受性较差,2次移植过程兼顾了预处理强度及骨髓抑制程度,根据个体差异及既往治疗反应对预处理药物剂量进行了增减,提高移植疗效的同时保 证安全性,对这类患者造血成功重建,证实了双次APSCT 的安全性。
移植相关并发症是影响移植安全性的另一项重要因素。在本组患者中,移植相关并发症发生率最高的是感染和胃肠道反应,2次移植过程中分别有16例患者在重度骨髓抑制期出现了发热,其中1例出现了巨细胞病毒感染,1例大肠埃希菌感染,1例表皮葡萄球菌感染,13例相关病原学检查阴性;双次移植过程中分别有14和7例患者出现了恶心、呕吐等消化道症状,经对症抗炎支持治疗均得到有效控制。无1例出现肝静脉闭塞病。随访至2015年1月,本组患者未发现继发第二肿瘤和慢性心脏毒性,证实了其安全性。
预处理方案的选择,第1次移植采用经典的环己亚硝脲+依托泊苷+阿糖胞苷+环磷酰胺预处理,第2次移植方案设计中,考虑肿瘤耐药,T-LBL易合并中枢侵犯,同时依托泊苷有继发第二肿瘤的潜在风险等因素,将预处理方案调整为伊达比星+阿糖胞苷+环磷酰胺。伊达比星可透过血脑屏障,加强中枢清肿瘤效应,可减少移植后中枢复发。我们的研究中,21例T-LBL患者接受双次自体移植后,无1例再发中枢神经系统淋巴瘤。
21例患者中位随访24(2~81)个月,复发率为14.3%(3/21),死亡率19%(4/21),3年预期无病生存率为68.9%,总生存率为73.6%。Shi等[11]研究了化疗联合造血干细胞移植(自体或异基因)治疗的淋巴母细胞淋巴瘤患者,5年的无病生存率为42%,总生存率为64%。与文献比较,我们的研究结果在OS率及PFS率均有明显提高,证明双次APSCT在T淋巴母细胞淋巴瘤的临床治疗策略是可行的。本研究中移植后有3例患者复发,最早复发时间为2个月,以纵隔包块复发为首要表现。文献[12]证实约50%的T-LBL患者复发的常见部位为纵隔。因此针对初诊时伴纵隔包块患者,应在移植后常规给予放疗。该患者依从性较差,未规律放疗,这可能和其早期复发有关。
预后因素分析中,我们的研究发现双次自体造血干细胞移植患者中,中位年龄≤29岁或第1次移植治疗后疾病CR的患者,OS和PFS明显高于中位年龄>29岁,以及第1次移植后仍未完全缓解的患者(P<0.05)。Bersvendsen等[13]给予T-LBL患者ALL样大剂量化疗联合自体造血干细胞移植治疗,参与研究的患者中位年龄33岁,发现了≤33岁的患者PFS和OS分别为54%和69%,明显高于中位年龄>33岁患者,而我们的研究也提示中位年龄≤29岁的T-LBL患者PFS与OS明显高于中位年龄>29岁的患者,这可能与年轻患者骨髓耐受良好,前期诱导化疗剂量大,残留病细胞清除彻底,因此获得移植前更深层次的缓解有关。而第1次移植前疾病CR的患者接受双次自体造血干细胞移植术后,其OS明显高于移植前PR患者(P=0.018),与其他报道相符[14]。
总之,本研究发现双次自体造血干细胞移植在治疗T淋巴母细胞淋巴瘤疗效好,造血重建顺利,移植相关死亡率低,可以明显提高OS及EFS率。由于本研究患者数量有限,结果具有局限性,未来需扩大病例数来进一步证实双次APSCT在T-LBL的治疗效果。
| [1] | Gokbuget N, Basara N, Baurmann H, et al. High single-drug activity of nelarabine in relapsed T-lymphoblastic leukemia/ lymphoma offers curative option with subsequent stem cell transplantation[J]. Blood,2011, 118 (13) : 3504 –3511. DOI:10.1182/blood-2011-01-329441 |
| [2] | Zhang C, Chen X, Zhang X, et al. Mobilization of peripheral blood stem cells for autologous transplantation patients with hematological malignancies: Influence of disease, mobilization method, age and sex[J]. Transfus Apher Sci,2008, 39 (1) : 21 –28. DOI:10.1016/j.transci.2008.05.011 |
| [3] | Zhang C, Zhang X, Chen X H, et al. Features and clinical outcomes in 40 patients with mixed-lineage acute leukemia in a single center[J]. Hematology,2013, 18 (6) : 309 –314. DOI:10.1179/1607845413Y.0000000077 |
| [4] | Chen X H, Zhang C, Zhang X, et al. Role of antithymocyte globulin and granulocyte-colony stimulating factor-mobilized bone marrow in allogeneic transplantation for patients with hematologic malignancies[J]. Biol Blood Marrow Transplant,2009, 15 (2) : 266 –273. DOI:10.1016/j.bbmt.2008.11.029 |
| [5] | Sweetenham J W, Santini G, Qian W, et al. High-dose therapy and autologous stem-cell transplantation versus conventional-dose consolidation/maintenance therapy as postremission therapy for adult patients with lymphoblastic lymphoma: results of a randomized trial of the European Group for Blood and Marrow Transplantation and the United Kingdom Lymphoma Group[J]. J Clin Oncol,2001, 19 (11) : 2927 –2936. |
| [6] | Levine J E, Harris R E, Loberiza F R Jr, et al. A comparison of allogeneic and autologous bone marrow transplantation for lymphoblastic lymphoma[J]. Blood,2003, 101 (7) : 2476 –2482. DOI:10.1182/blood-2002-05-1483 |
| [7] | 肖方, 刘利, 郝淼旺, 等. 双次自体造血干细胞移植治疗T细胞非霍奇金淋巴瘤疗效观察[J]. 临床血液学杂志,2012, 25 (4) : 425 –429. DOI:10.13201/j.issn.1004-2806.2012.04.007 |
| [8] | Le-Gouill S, Moreau P, Morineau N, et al. Tandem high-dose therapy followed by autologous stem-cell transplantation for refractory or relapsed high grade non-Hodgkin’s lymphoma with poor prognosis factors: a prospective pilot study[J]. Haematologica,2002, 87 (3) : 333 –334. |
| [9] | Espigado I, Rios E, Marin-Niebla A, et al. High rate of long-term survival for high-risk lymphoma patients treated with hematopoietic stem cell transplantation as consolidation or salvage therapy[J]. Transplant Proc,2008, 40 (9) : 3104 –3105. DOI:10.1016/j.transproceed.2008.08.092 |
| [10] | Vranovsky A, Ladicka M, Lakota J. Autologous stem cell transplantation in first-line treatment of high-risk aggressive non-Hodgkin’s lymphoma[J]. Neoplasma,2008, 55 (2) : 107 –112. |
| [11] | Shi Y, Zhou S, He X, et al. Autologous hematopoietic stem cell transplantation in chemotherapy-sensitive lymphoblastic lymphoma: treatment outcome and prognostic factor analysis[J]. Chin J Cancer Res,2015, 27 (1) : 66 –73. DOI:10.3978/j.issn.1000-9604.2015.02.04 |
| [12] | Thomas D A, Faderl S, O’Brien S, et al. Chemoimmunotherapy with hyper-CVAD plus rituximab for the treatment of adult Burkitt and Burkitt-type lymphoma or acute lymphoblastic leukemia[J]. Cancer,2006, 106 (7) : 1569 –1580. DOI:10.1002/cncr.21776 |
| [13] | Bersvendsen H, Kolstad A, Blystad A K, et al. Multimodal treatment with ALL-like chemotherapy, Auto-SCT and radiotherapy for lymphoblastic lymphoma[J]. Acta Oncol,2014, 53 (5) : 680 –687. DOI:10.3109/0284186X.2013.855816 |
| [14] | Song K W, Barnett M J, Gascoyne R D, et al. Primary therapy for adults with T-cell lymphoblastic lymphoma with hematopoietic stem-cell transplantation results in favorable outcomes[J]. Ann Oncol,2007, 18 (3) : 535 –540. DOI:10.1093/annonc/mdl426 |



