脂氧合酶(lipoxygenase, LOXs)是不饱和脂肪酸代谢的关键酶,可催化一系列多不饱和脂肪酸生成具有生物活性的脂类介质。12-脂氧合酶(12-lipoxygenase,12-LO)可分为3种类型:血小板型、白细胞型和表皮型。大鼠、小鼠、猪等主要表达白细胞型12-LO,与主要表达在人、兔的15-脂氧合酶(15-lipoxygenase,15-LO)高度同源,合称12/15-脂氧合酶(12/15-lipoxygenase, 12/15-LO)[1]。既往研究表明12/15-LO的表达水平显著影响血管内皮细胞的功能,但这种作用尚存在争议[2]。因此,本实验通过建立大鼠颈动脉球囊损伤模型,探讨12-LO对血管内皮功能的影响。
1 材料与方法 1.1 实验动物与试剂雄性SD大鼠30只,体质量380~420 g,购于重庆医科大学实验动物中心;12-LO过表达慢病毒和慢病毒阴性对照(基因ID号:NM_031010) ,均购于吉凯基因公司;Fogarty动脉取血栓导管(2F),购于美国爱德华生命科学有限公司;RNA试剂盒、逆转录试剂盒、荧光染料SYBR,购于TaKaRa公司;PCR引物由TaKaRa公司合成;免疫组化试剂盒,购于中杉金桥;兔抗eNOS一抗购于Santa Cruz公司;小鼠抗12-LO一抗、小鼠抗ICAM-1一抗,购于Abcam公司;羊抗小鼠二抗、羊抗兔二抗,购于中国碧云天公司。
1.2 实验方法 1.2.1 实验分组将30只SD大鼠分为假手术组(sham组,n=6) 、球囊损伤组(balloon injury,BI组,n=8) 、球囊损伤+空载组(balloon injury+lentivirus-GFP,BI+Lv-GFP组,n=8) 、球囊损伤+过表达组(balloon injury+lentivirus-12-LO,BI+Lv-12-LO组,n=8) 。除sham组外,所有大鼠行左颈总动脉球囊损伤术,BI+Lv-GFP组和BI+Lv-12-LO在损伤的颈动脉局部转染慢病毒。
1.2.2 球囊损伤与慢病毒转染参考既往的建模方法[3],10%水合氯醛3 mL/kg腹腔注射麻醉,无菌操作暴露左颈总动脉,分离周围组织至动脉分叉处,结扎颈外动脉远端及其分支,并用动脉夹暂时阻断颈内动脉及颈总动脉近心端血流。在距动脉分叉处5~10 mm 的颈外动脉远心端剪一小切口,插入2F动脉取血栓导管约2 cm,从导管注入0.2 mL空气扩张球囊,反复来回拉动球囊3次。撤除球囊导管后,用生理盐水冲洗管腔,注入慢病毒介导的GFP或12-LO(1.0×108 TU/mL)100 μL,夹闭颈总动脉分叉处,保留30 min。吸出病毒液,生理盐水冲洗管腔,颈动脉注入肝素100 U/kg,结扎颈外动脉切口。恢复颈内动脉和颈总动脉血流,封闭切口。sham组仅分离出左颈总动脉,不予以球囊损伤。
1.2.3 样本采集与保存术后14 d处死大鼠,快速剪下左侧颈总动脉约2 cm,一部分迅速放入液氮中保存;另一部分生理盐水冲洗后置入4%多聚甲醛中固定。
1.3 指标检测 1.3.1 慢病毒在损伤动脉壁转染效率的测定处死大鼠后,取出转染慢病毒的血管节段,PBS清洗血管腔,立即行冰冻切片,甘油封片。置于荧光显微镜下观察GFP表达情况,评价慢病毒在损伤动脉壁的转染情况。
1.3.2 组织形态学观察血管组织经固定、脱水后,行石蜡包埋,间断切片,厚度约4 μm。切片行HE染色,光学显微镜观察血管内膜增生情况及平滑肌细胞的增殖、移行。并用Image Pro Plus 6.0图像分析软件测定血管内中膜厚度(intima-media thickness,IMT)。
1.3.3 定量PCR检测eNOS、ICAM-1 mRNA表达水平取出左颈总动脉后,取适量血管组织加入TRIzol 试剂充分裂解、匀浆管匀浆、提取RNA、测定浓度、逆转录制备cDNA。引物序列见表 1。以cDNA为模板,PCR反应条件为:95 ℃预变性2 min,95 ℃ 30 s,95 ℃ 5 s,62 ℃ 30 s,72 ℃ 20 s,40个PCR循环。采用2-△△Ct法计算目的基因的相对表达量。
| 引物 | 引物序列 | 长度(bp) |
| ICAM-1 | 上游 5′-TGGGGTTGGAGACTAACTGGAT-3′ | 22 |
| 下游 5′-TCGCTCTGGGAACGAATACAC-3′ | 21 | |
| eNOS | 上游 5′-ATGTTTGTCTGCGGTGATGTC-3′ | 21 |
| 下游 5′-AATGTCCTCGTGGTAGCGTTG-3′ | 21 | |
| GAPDH | 上游 5′-AAGTTCAACGGCACAGTCAAGG-3′ | 22 |
| 下游 5′-CGCCAGTAGACTCCACGACATA-3′ | 22 |
1.3.4 免疫组织化学染色法检测eNOS、ICAM-1在血管壁的表达
将血管石蜡包埋,常规切片,参照试剂盒方法步骤,行二甲苯脱蜡,水化,3%H2O2阻断10 min,组织抗原修复,正常山羊血清封闭10 min,一抗4 ℃孵育过夜:eNOS(1 ∶250) 、ICAM-1(1 ∶200) 。生物素化二抗工作液37 ℃孵育20 min,辣根酶标记链霉卵白素工作液37 ℃孵育20 min,DAB显色,苏木精复染,封片。光学显微镜下每张随机取5个高倍镜视野, 应用Image Pro Plus 6.0图像分析软件对每个视野中阳性细胞的光密度值行半定量分析。
1.3.5 Western blot检测12-LO、eNOS、ICAM-1蛋白表达水平提取总蛋白,BCA法测定蛋白浓度后煮沸变性。每组取40 μg蛋白上样,SDS-PAGE电泳分离蛋白,将蛋白转移到硝酸纤维PVDF膜上,5%脱脂奶粉封闭2 h,加入一抗12-LO(1 ∶500) 、eNOS(1 ∶500) 、ICAM-1 (1 ∶1 000) ,4 ℃孵育过夜。辣根过氧化物酶标记的二抗(羊抗兔IgG抗体、 羊抗小鼠IgG抗体,均为1 ∶1 000) 37 ℃孵育1 h。ECL化学显色,Bio-Rad凝胶成像系统分析条带,以GAPDH作为内参。
1.4 统计学分析实验数据以x ±s表示,采用SPSS 17.0 统计软件分析, 应用单因素方差分析比较多组数据的差异,以P<0.05为差异有统计学意义。
2 结果 2.1 慢病毒在球囊损伤血管内的表达在荧光显微镜下观察发现,球囊损伤后未转染慢病毒的BI组仅见中膜弹力层有自发性绿色荧光,内膜组织无荧光。血管球囊损伤处转染慢病毒介导的GFP、12-LO后可见增生的内膜组织内有较强的绿色荧光分布(图 1)。

|
| A:NC组;B:Lv-GFP组;C:Lv-12-LO组 ↑:示GFP 图 1 荧光显微镜观察各组大鼠转染慢病毒介导的GFP、12-LO表达 (×400) |
Western blot检测结果显示,NC组和Lv-GFP组的12-LO表达差异无统计学意义[(1.00±0.20) vs (1.01±0.14) ,P=0.971]。而Lv-12-LO组12-LO表达较Lv-GFP组明显升高[(2.48±0.53) vs(1.01±0.14) ,P<0.01]。上述结果说明慢病毒成功转染血管壁并表达(图 2)。

|
| 1: NC组;2:Lv-GFP组;3:Lv-12-LO组 图 2 Western blot检测各组大鼠转染慢病毒介导的12-LO表达水平 |
2.2 大鼠颈动脉病理变化
sham组大鼠颈总动脉镜下仅见单层内皮细胞,内弹力膜完整。球囊损伤后可见损伤处新生内膜呈不均一增厚,管腔明显狭窄,管壁增厚,内皮下组织增生明显(图 3)。与sham组相比较,BI组IMT升高[(0.13± 0.01) vs (0.08±0.01) ,P<0.01];BI+Lv-12-LO组IMT比值较BI+Lv-GFP组明显增加[(0.15±0.01) vs (0.13±0.01) ,P=0.001]。
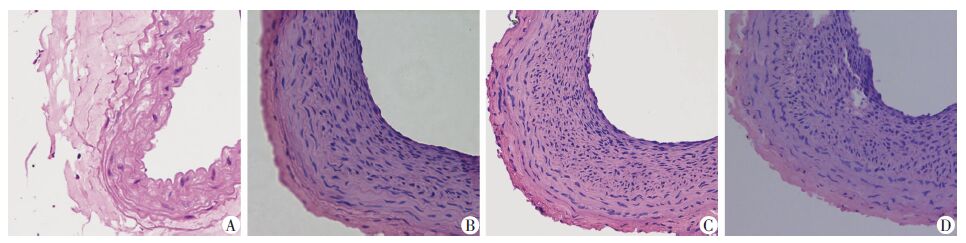
|
| A:sham组;B:BI组;C:BI+Lv-GFP组;D:BI+Lv-12-LO组 图 3 光学显微镜观察各组大鼠血管内中膜厚度变化 (HE ×200) |
2.3 12-LO过表达对ICAM-1、eNOS表达的影响
定量PCR检测结果显示,与sham组相比,BI组ICAM-1表达显著升高[(1.80±0.12) vs (1.00±0.09) ,P=0.001],eNOS表达显著降低[(0.79±0.07) vs (1.00±0.07) ,P=0.012]。与BI+Lv-GFP组相比,BI+Lv-12-LO组中ICAM-1 mRNA表达水平进一步升高[(2.18±0.14) vs (1.78±0.18) ,P=0.009],eNOS mRNA表达水平进一步降低[(0.49±0.06) vs (0.73±0.09) ,P=0.004]。
ICAM-1、eNOS免疫组化阳性染色为棕黄色。与sham组相比,BI组中ICAM-1阳性细胞数显著增多 (P=0.007) ,eNOS阳性细胞数显著减少(P=0.001) ,与BI+Lv-GFP组相比,BI+Lv12-LO过表达组ICAM-1阳性细胞数进一步增多(P<0.01) ,eNOS阳性细胞数进一步减少(P<0.01,图 4A、B)。
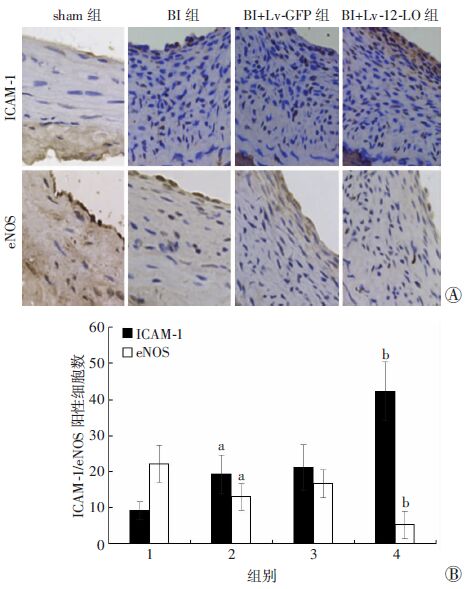
|
| A:免疫组化检测结果(S-P ×400) ;B:定量PCR检测结果 1:sham组;2:BI组;3:BI+Lv-GFP组;4:BI+Lv-12-LO组 a:P<0.01,与Sham组比较;b:P<0.01,与BI+Lv-GFP组比较 图 4 免疫组化检测各组大鼠炎症因子ICAM-1和内皮因子eNOS的表达 |
同免疫组化结果一致,Western blot检测结果显示,与sham组相比,BI组ICAM-1表达明显升高(P=0.038) ,eNOS表达明显降低(P=0.009) 。与BI+Lv-GFP组相比,BI+Lv-12-LO组中ICAM-1蛋白表达水平进一步升高(P=0.002) ,eNOS蛋白表达水平进一步降低(P=0.020,图 5A、B)。

|
| A:Western blot检测结果;B:半定量分析 1:sham组;2:BI组;3:BI+Lv-GFP组;4:BI+Lv-12-LO组 a:P<0.01,与sham组比较;b:P<0.01,与BI+Lv-GFP组比较;c:P<0.05,与sham组比较;d:P<0.05,与BI+Lv-GFP组比较 图 5 Western blot检测各组大鼠炎症因子ICAM-1和内皮因子eNOS的表达 |
3 讨论
血管内皮功能障碍是动脉粥样硬化发生和加重的关键因素。血管内皮损伤后可导致血管张力异常,脂质浸润增加,白细胞黏附迁移,血管平滑肌细胞增殖等,是动脉粥样硬化形成的早期始动环节[4]。研究发现,12/15-LO通过调节炎症反应参与动脉粥样硬化疾病的发生、发展[5]。尽管其具体作用尚存在争议,但更多的研究表明,12/15-LO具有促动脉粥样硬化的作用。本模型研究结果显示,球囊损伤术后,大鼠左颈动脉平滑肌细胞增生迁移,排列紊乱,内膜明显增厚,管腔狭窄。血管内皮功能紊乱和内皮完整性的破坏是动脉粥样硬化发生的始动环节,主要表现为血管张力的变化和粘附分子的异常表达。eNOS是血管中一氧化氮(nitric oxide,NO)的主要来源,在血管内皮保护中具有重要意义。ICAM-1在增生的血管内皮细胞中表达最强,ICAM-1与单核细胞表面的整合素类结合,促进单核细胞与内皮细胞的黏附,为单核细胞迁入内皮下创造条件[6]。本实验球囊损伤后,大鼠颈动脉eNOS表达减少,ICAM-1表达增加,提示内皮功能障碍。这与常静等[7]和王敬祥等[8]的报道一致,其机制可能与内皮细胞损伤后激活,继而表达大量粘附分子有关。
本实验成功建立12-LO过表达模型,同时我们发现,与阴性载体组相比,12-LO过表达后大鼠颈动脉IMT增厚更加显著,也提示我们12-LO的过表达可能通过对炎症以及内皮因子的影响从而导致这种现象的发生。本研究发现12-LO的过表达使得ICAM-1的表达进一步增高,同时,eNOS表达进一步降低,提示12-LO过表达在体内似乎起着促进炎症因子以及减少内皮因子释放的作用。既往关于12/15-LO对炎症的影响存在争议。Kronke等[9]研究发现随着 12/15-LO表达下降,小鼠体内炎症反应和组织损伤逐渐加重。12/15-LO的产物12(S)-HETE、15(S)-HETE等为过氧化物酶体增殖物激活受体γ的内源性配体[10],在大鼠脑缺血损伤模型中,给予外源性的12(S)-HETE、15(S)-HETE可激活PPARγ,抑制核转录因子的活性,从而抑制炎症反应[11]。同时有研究表明12/15-LO可能具有促进炎症因子释放的作用。Ibrahim等[12]研究发现12/15-LO可通过NADPH氧化酶生成氧自由基,从而通过多种信号通路,促进炎症因子表达、单核细胞聚集粘附等。12/15-LO参与低密度脂蛋白的氧化,是血管炎症发生的早期关键事件,氧化型低密度脂蛋白通过启动下游信号的级联反应,加重炎症反应,引起内皮功能紊乱,进而形成动脉粥样硬化斑块。Anning等[13]研究发现,在12/15-LO-/-小鼠中eNOS表达增加,NO生物活性显著增强。造成以上研究的差异可能与研究种属类别、饮食情况以及12/15-LO及其代谢产物在不同细胞种类之间的表达差异有关。
本实验通过建立颈动脉球囊损伤和慢病毒转染的模型,发现12-LO过表达可能减少内皮因子表达和促进炎症因子释放,从而加重血管内皮损伤。12-LO与动脉粥样硬化密切相关,明确12-LO在动脉粥样硬化中的作用将为以后治疗动脉粥样硬化提供一个新的方向。
| [1] | Rossaint J, Nadler J L, Ley K, et al. Eliminating or blocking 12/15-lipoxygenase reduces neutrophil recruitment in mouse models of acute lung injury[J]. Crit Care,2012, 16 (5) : R166 . DOI:10.1186/cc11518 |
| [2] | Wuest S J, Crucet M, Gemperle C, et al. Expression and regulation of 12/15-lipoxygenases in human primary macrophages[J]. Atherosclerosis,2012, 225 (1) : 121 –127. DOI:10.1016/j.atherosclerosis.2012.07.022 |
| [3] | Zhang X W, Wang Y, Cai J B, et al. Downregulation of quinone reductase 2 attenuates vascular smooth muscle cells proliferation and neointimal formation in balloon injured rat carotid artery[J]. Cell Physiol Biochem,2012, 29 (3/4) : 453 –462. DOI:10.1159/000338499 |
| [4] | Vanhoutte P M. Endothelial dysfunction: the first step toward coronary arteriosclerosis[J]. Circ J,2009, 73 (4) : 595 –601. DOI:10.1253/circj.CJ-08-1169 |
| [5] | Powell W S, Rokach J. Biosynthesis, biological effects, and receptors of hydroxyeicosatetraenoic acids (HETEs) and oxoeicosatetraenoic acids (oxo-ETEs) derived from arachidonic acid[J]. Biochim Biophys Acta,2015, 1851 (4) : 340 –355. DOI:10.1016/j.bbalip.2014.10.008 |
| [6] | 陈旭, 朱莉, 郝青青, 等. 血管紧张素转化酶2基因转染对动脉硬化血管内皮细胞的保护作用[J]. 上海交通大学学报: 医学版,2014, 34 (4) : 496 –500. DOI:10.3969/j.issn.1674-8115.2014.04.019 |
| [7] | 常静, 芦玲巧, 曾翔俊, 等. 细胞色素2J3基因转染减轻大鼠胸主动脉球囊损伤后血管狭窄程度的初步机制[J]. 微循环学杂志,2013, 23 (4) : 24 –26. DOI:10.3969/j.issn.1005-1740.2013.04.007 |
| [8] | 王敬祥, 张月兰, 田文, 等. 阿托伐他汀在大鼠颈总动脉球囊损伤模型中对NF-κB及其相关炎性因子的影响[J]. 中国动脉硬化杂志,2012, 20 (2) : 135 –139. DOI:10.7666/d.y1892466 |
| [9] | Kronke G, Katzenbeisser J, Uderhardt S, et al. 12/15-lipoxygenase counteracts inflammation and tissue damage in arthritis[J]. J Immunol,2009, 183 (5) : 3383 –3389. DOI:10.4049/jimmunol.0900327 |
| [10] | 韩晶, 孙莉, 梁浩, 等. 12/15-脂氧酶反义寡核苷酸对氧糖剥夺损伤皮质神经元中PPARγ核移位的影响[J]. 中华医学杂志,2014, 94 (15) : 1179 –1183. DOI:10.3760/cma.j.issn.0376-2491.2014.15.016 |
| [11] | Sun L, Xu Y W, Han J, et al. 12/15-Lipoxygenase metabolites of arachidonic acid activate PPARgamma: a possible neuroprotective effect in ischemic brain[J]. J Lipid Res,2015, 56 (3) : 502 –514. DOI:10.1194/jlr.M053058 |
| [12] | Ibrahim A S, Elshafey S, Sellak H, et al. A lipidomic screen of hyperglycemia-treated HRECs links 12/15-Lipoxygenase to microvascular dysfunction during diabetic retinopathy via NADPH oxidase[J]. J Lipid Res,2015, 56 (3) : 599 –611. DOI:10.1194/jlr.M056069 |
| [13] | Anning P B, Coles B, Bermudez-Fajardo A, et al. Elevated endothelial nitric oxide bioactivity and resistance to angiotensin-dependent hypertension in 12/15-lipoxygenase knockout mice[J]. Am J Pathol,2005, 166 (3) : 653 –662. DOI:10.1016/S0002-9440(10)62287-0 |



