2. 063000 河北 唐山,华北理工大学:附属医院胸心外科 ;
3. 063000 河北 唐山,华北理工大学:基础医学院组织学与胚胎学教研室 ;
4. 063000 河北 唐山,华北理工大学:基础医学院河北省慢性疾病重点实验室,唐山市慢性病临床基础研究重点实验室
2. Department of Chest Cardiac Surgery, Affiliated Hospital, North China University of Science and Technology, Tangshan, Hebei Province, 063000, China ;
3. Department of Histology and Embryology, Affiliated Hospital, North China University of Science and Technology, Tangshan, Hebei Province, 063000, China ;
4. Department of Hebei Key Laboratory for Chronic Diseases, Tangshan Key Laboratory for Preclinical and Basic Research on Chronic Diseases, School of Basic Medical Sciences, Affiliated Hospital, North China University of Science and Technology, Tangshan, Hebei Province, 063000, China
肝细胞癌(hepatocellular carcinoma, HCC)是世界上最常见的恶性肿瘤之一,其发病率在男性中居第5位,在女性中居第9位[1],严重威胁人类的身体健康。由于肝癌的发病隐匿、复发率高、侵袭性强等特点给临床治疗带来了极大困难,往往在诊断时肿瘤已无法根治切除[2-3]。miRNA影响肿瘤发生与发展的病理学机制已经很清晰,即其可在肿瘤发生与发展的过程中表现为抑癌基因或癌基因,而这有赖于其所调控靶基因的生物学功能。miR-148b可以通过靶定DUSP1抑制肝癌细胞的生长、侵袭和迁移[4-5]。研究表明miR-185在人肝癌细胞中呈低表达,且其高表达能诱导肝癌细胞凋亡、抑制细胞增殖及侵袭[6]。肝脏是维持机体代谢平衡的中枢器官,在肝细胞中NR1D1(又名Rev-erbα或EAR-1)调节核心时钟基因BMAL1(brain and muscle arnt-like protein 1)的表达[7]。NR1D1是一大类转录调节因子之一。涉及遗传、基因组、生物化学和药理技术的研究表明,NR1D1在昼夜节律调节中扮演着非常重要的角色[8],其可直接将细胞外激素信号和核内基因转录联系起来,也可调节机体各种生理代谢过程[9-11]。本研究旨在探讨miR-185过表达对人肝癌细胞中NR1D1蛋白表达的调控作用及对HCC侵袭行为的影响。
1 材料与方法 1.1 细胞、主要试剂和仪器人肝癌细胞系HepG2和SMMC-7721、人正常肝细胞系(LO2)购自上海复祥生物公司,pcDNA3购自美国Clontech公司,pcDNA3/EGFP本室构建,胎牛血清购自美国BI公司,DMEM培养基、青霉素和链霉素购自美国Gibco公司,CCK-8试剂盒购自日本同仁公司,Lipofectamine 2000转染试剂购自美国Invitrogen公司,Transwell小室(8 μm孔径聚碳酸酯膜)和Matrigel购自美国Corning Costar公司,miRNA第1链cDNA合成试剂盒购自上海生工生物工程有限公司,
兔抗人NR1D1单克隆抗体由Abcam公司提供,兔抗人GAPDH单克隆抗体和抗兔二抗由美国KPL公司提供,BX63全自动显微镜扫描系统购自日本Olympus公司,CO2细胞培养箱和1300 SERIES A2超净工作台购自美国Thermo公司,SpectraMax190全波长读数仪购自美国Molecular Devices公司,伯乐电泳转印系统、凝胶成像系统购自美国Bio-Rad公司,实时荧光定量PCR仪Mastercycler ep Realplex4购自德国Eppendorf公司。
1.2 HepG2、SMMC-7721和LO2细胞培养用含10%胎牛血清的DMEM培养基于37 ℃、5% CO2饱和湿度条件下培养细胞,每2~3天消化传代。实验分组:miR-185组,转染pcDNA3/pri-miR-185质粒;pcDNA3组,转染pcDNA3空载质粒;反义寡聚核苷酸(antisense oligonucleotide, ASO)-185组,转染miR-185 ASO寡聚核苷酸;ASO-NC组,转染乱序寡聚核苷酸。转染前1 d将细胞按需接种于细胞培养板,次日按Lipofectamine 2000转染试剂说明书进行质粒的转染,转染时细胞达到70%~90%的板底面积。ASO-185是miR-185的反义寡聚苷酸序列,可以经脂质体转染肝癌细胞,通过碱基互补配对与miR-185结合封闭其功能。用CCK-8和Transwell小室检测方法确定miR-185对肝癌细胞增殖、侵袭和迁移能力的影响,确定miR-185在肝癌细胞中起到的作用。
1.3 miR-185对HepG2和SMMC-7721细胞增殖的影响用CCK-8试剂盒检测miR-185对HepG2和SMMC-7721细胞增殖的影响。将两种细胞分别接种于96孔板,次日进行转染。实验分为4组:miR-185组、pcDNA3组、ASO-185组和ASO-NC组,每组重复3次。分别于24、48 h和72 h加CCK-8试剂10 μL/孔,孵育3 h后用酶标仪测定波长为450 nm的光密度值[D(450)]。
1.4 miR-185对SMMC-7721细胞侵袭的影响在Transwell小室中进行,在聚碳酸酯膜上室面铺Matrigel胶,整个操作在冰上和无菌条件下进行,37 ℃固化1 h备用。实验分为miR-185组、pcDNA3组、ASO-185组和ASO-NC组,每组重复3次。48 h后用含1%血清的DMEM培养基洗涤SMMC-7721细胞,调整细胞浓度,在上室接种5×104/100 μL,下室加入含10%血清的完全培养基作为趋化剂。37 ℃、5% CO2条件下培养24 h后,擦掉上室的细胞,用4%多聚甲醛固定30 min,0.1%结晶紫染色20 min,PBS洗3次,然后在显微镜下计数5个不重复视野的穿膜细胞数。细胞侵袭抑制率=[(对照组侵袭细胞数-实验组侵袭细胞数)/对照组侵袭细胞数]×100%。
1.5 miR-185对SMMC-7721细胞迁移的影响方法同1.4,但Transwell小室的聚碳酸酯膜上不铺Matrigel胶,细胞迁移抑制率=[(对照组迁移细胞数-实验组迁移细胞数)/对照组迁移细胞数]×100%。
1.6 生物信息学预测结合基因芯片结果确定miR-185的功能靶基因TargetScan和PicTar数据库预测结合基因芯片结果确定miR-185的候选靶基因NR1D1,数据库预测结果显示在NR1D1基因mRNA的3′端非翻译区(untranslated region,UTR)有与miR-185互补结合的位点(图 1)。

|
| 图 1 NR1D1 3′UTR区miR-185的结合位点 |
1.7 实时荧光定量PCR检测细胞中miR-185和NR1D1 mRNA水平
①检测过表达miR-185后HepG2细胞中miR-185 mRNA水平。将细胞接种于6孔板,实验分为miR-185组和pcDNA3组,重复3次。转染48 h时用TRIzol提取总RNA,检测浓度及纯度,并用琼脂糖凝胶电泳鉴定RNA的完整性,然后以总RNA为模板,miRNA第1链cDNA合成试剂盒进行第1链cDNA的合成,以cDNA为模板进行实时荧光定量PCR检测,以U6为阳性对照基因校正PCR模板的拷贝数,基因相对表达量采用2-ΔΔCt值计算。②检测人正常肝细胞LO2和人肝癌细胞HepG2、SMMC-7721中miR-185 mRNA水平,实验方法和计算方法同①。③检测过表达miR-185后HepG2细胞中NR1D1 mRNA水平,实验方法和计算方法同①,但逆转录时使用M-MLV逆转录酶试剂盒,以GAPDH为阳性对照基因。
1.8 miR-185对HepG2细胞中NR1D1基因蛋白表达水平的影响Western blot检测HepG2细胞中NR1D1蛋白表达水平。将HepG2细胞接种于6孔板,实验分为miR-185组、pcDNA3组、ASO-185组和ASO-NC组,每组重复3次,转染48 h后加入预冷的RIPA细胞裂解液裂解细胞,经超声机粉碎后离心取上清。提取的细胞蛋白经SDS-PAGE电泳后转移到硝酸纤维素膜上,5%脱脂奶粉封闭,加入一抗(抗NR1D1抗体,内参为抗GAPDH抗体),4℃孵育过夜,洗膜后加入HRP标记的二抗进行杂交,ECL试剂显色,采用成像仪拍照,以目的条带与内参GAPDH的光密度值比值表示蛋白的相对表达水平。
1.9 荧光报告载体实验验证NR1D1是miR-185的靶基因构建pcDNA3/EGFP-NR1D1 3′UTR载体,然后转染到HepG2细胞中,实验分为pcDNA3/EGFP组、pcDNA3/NR1D1 3′UTR组、NR1D1 3′UTR+miR-185组、NR1D1 3′UTR+pcDNA3组、NR1D1 3′UTR+ASO-185组和NR1D1 3′UTR+ASO-NC组。将HepG2细胞接种于96孔培养板,次日转染寡聚核苷酸和质粒,第3天转染EGFP表达质粒,第2次转染48 h后用荧光显微镜观察细胞内荧光基因的表达情况。实验重复3次。每个样品的3个数据取平均值,计算各组相对荧光值,比较各组间EGFP表达强度值的关系并绘制柱状图。
1.10 统计学分析计量资料数据以x±s表示,采用SPSS 17.0统计软件,方差齐性采用Levene’s检验,两两比较采用LSD法,检验水准为α=0.05。
2 结果 2.1 miR-185对HepG2和SMMC-7721细胞增殖的影响在HepG2和SMMC-7721细胞中分别转染pcDNA3/ pri-miR-185和对照pcDNA3质粒,或转染ASO-185和对照ASO-NC寡聚核苷酸,0、24、48、72 h分别测定每孔细胞D(450)值,CCK-8实验结果表明过表达miR-185可以抑制HepG2和SMMC-7721细胞的增殖,抑制细胞中的miR-185可以促进细胞增殖(图 2)。

|
|
A:HepG2细胞;B:SMMC-7721细胞 a:P < 0.01,与pcDNA3组比较;b:P < 0.01,与ASO-NC组比较 图 2 miR-185对HepG2和SMMC-7721细胞增殖的影响 |
2.2 miR-185对SMMC-7721细胞侵袭和迁移的影响
miR-185组细胞侵袭和迁移的能力明显低于pcDNA3对照组,而ASO-185组与ASO-NC组相比SMMC-7721细胞的侵袭和迁移能力均增强(表 1)。
| 组别 | 细胞侵袭(个) | 细胞迁移(个) | 侵袭抑制率(%) | 迁移抑制率(%) |
| miR-185组 | 74.1±3.6 | 80.9±5.8 | 33.0±5.3 | 40.7±4.8 |
| pcDNA3组 | 110.9±6.6 | 136.7±9.1 | 0 | 0 |
| ASO-185组 | 124.4±3.8 | 154.6±4.2 | -16.1±5.7 | -8.5±4.2 |
| ASO-NC组 | 107.4±5.7 | 142.6±4.5 | 0 | 0 |
2.3 实时荧光定量PCR检测细胞中miR-185和NR1D1的mRNA水平
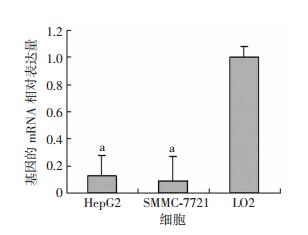
①实时荧光定量PCR检测过表达miR-185后HepG2细胞中miR-185 mRNA水平。转染pcDNA3/pri-miR-185质粒后,细胞中miR-185基因明显过表达,相对表达量是pcDNA3组的7.73倍,表明转染pcDNA3/pri-miR-185质粒能够使miR-185 mRNA表达量增加。②实时荧光定量PCR检测HepG2细胞、SMMC-7721细胞和LO2细胞中miR-185 mRNA水平,结果表明miR-185在肝癌细胞中低表达(P < 0.01,图 3)。③实时荧光定量PCR检测过表达miR-185后HepG2细胞中NR1D1 mRNA水平。转染pcDNA3/pri-miR-185质粒后,细胞中NR1D1 mRNA的相对表达量明显低于对照组,是对照组的0.21倍(P < 0.01),表明过表达miR-185可以降低NR1D1 mRNA表达量。
|
| a:P < 0.01,与LO2比较 图 3 肝癌细胞和正常肝细胞中miR-185 mRNA的相对表达量 |
2.4 miR-185对HepG2细胞中NR1D1基因蛋白表达水平的影响
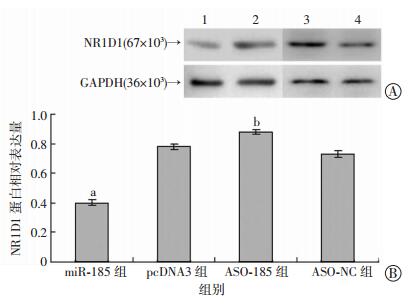
Western blot检测HepG2细胞中NR1D1蛋白的表达水平,结果显示,miR-185组HepG2细胞中NR1D1蛋白表达量较pcDNA3组明显减少(P < 0.01),ASO-185组HepG2细胞中NR1D1蛋白表达量较ASO-NC组明显增加(P < 0.01,图 4)。这表明过表达miR-185可以下调肝癌细胞中NR1D1蛋白表达,而抑制miR-185的表达使NR1D1的蛋白表达量增加。
|
| A:Western blot检测结果 1:miR-185组;2:pcDNA3组;3:ASO-185组;4:ASO-NC组;B:半定量分析结果 a:P < 0.01,与pcDNA3组比较;b:P < 0.01,与ASO-NC组比较 图 4 miR-185对HepG2细胞中NR1D1蛋白表达水平的影响 |
2.5 荧光报告载体实验验证NR1D1是miR-185的靶基因
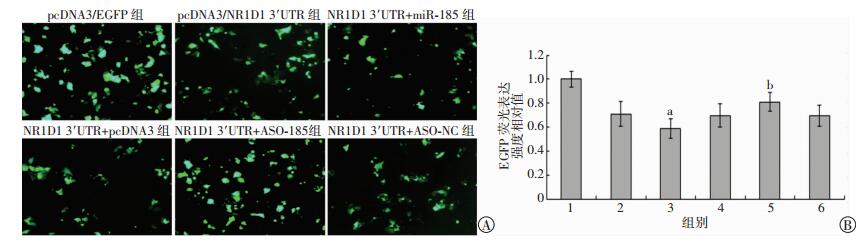
将pcDNA3/EGFP-NR1D1 3′UTR质粒与miR-185 ASO共转染HepG2细胞,所得的EGFP荧光强度与共转染pcDNA3/EGFP-NR1D1 3′UTR质粒和ASO-NC组相比明显升高,表明内源miR-185的功能被其反义寡聚核苷酸miR-185 ASO封闭后,对NR1D1 3′UTR的抑制作用减低,导致EGFP表达升高。相反,将pcDNA3/EGFP-NR1D1 3′UTR质粒与pcDNA3/pri-miR-185共转染HepG2细胞,所得的EGFP荧光强度与共转染pcDNA3/EGFP-NR1D1 3′UTR质粒和pcDNA3组相比明显降低,表明过表达miR-185后,对NR1D1 3′UTR的抑制作用加强,导致EGFP表达量减少。此外,单转染pcDNA3/EGFP-NR1D1 3′UTR质粒组比单转染pcDNA3/EGFP质粒组的EGFP荧光表达强度低,是由于HepG2细胞内源性的miR-185发挥了抑制NR1D1 3′UTR的作用,导致EGFP表达减少(图 5)。
|
| A:荧光显微镜观察EGFP荧光表达强度(×200);B:EGFP荧光表达强度统计结果 1:pcDNA3/EGFP组;2:pcDNA3/NR1D1 3′UTR组;3:NR1D1 3′UTR+miR-185组;4:NR1D1 3′UTR+pcDNA3组;5:NR1D1 3′UTR+ASO-185组;6:NR1D1 3′UTR+ASO-NC组;a:P < 0.05,与pcDNA3/NR1D1 3′UTR组比较;b:P < 0.05,与NR1D1 3′UTR+ASO-NC组比较 图 5 pcDNA3/EGFP-NR1D1 3′UTR荧光报告载体验证NR1D1是miR-185的直接靶基因 |
3 讨论
miRNAs是一类内源性非编码、长度为18~22个核苷酸的小RNA分子,其通过结合目标mRNA的3′UTR区,引起靶mRNA降解或抑制其翻译,在转录后沉默目的基因,从而对生物的发育、分化、增殖以及细胞凋亡等生物活动进行精确调节,miRNA基因约占人类基因的1%,是最大的基因表达调控家族之一,调节人类近30%的基因表达[12]。miR-185是一个长度为22个核苷酸的非编码小分子RNA,定位于人染色体22q11.21,在肿瘤的发生、发展过程中扮演着非常重要的角色,对于肿瘤细胞的生长、侵袭迁移和耐药性等多种生物学行为具有非常重要的作用[13]。Liu等[14]对人结肠癌细胞SW1116、Lovo研究发现,miR-185能下调RhoA/Cdc42表达,抑制细胞周期G1/S期的转变、诱导细胞凋亡和抑制细胞侵袭。在肝癌组织和肝癌细胞中miR-185呈低表达状态,可作为肿瘤抑制因子,在HCC发生、发展中起重要作用[6]。Zhi等[15]研究发现,miR-185的低表达使早期肝癌患者生存率更低且复发时间更短,因此上调miR-185可能是一个潜在的肝癌分子治疗策略。
NR1D1是重要的转录调节因子,可直接将胞外刺激信号和核内基因转录联系起来,在生物体中广泛调节机体的各种生理代谢过程。NR1D1通过识别并结合靶基因启动子上ROR应答元件而抑制基因BMAL1转录,是昼夜节律时钟核心转录因子CLOCK和BMAL1的负调节因子[16]。BMAL1/CLOCK异质二聚体可以在细胞周期G1早期下调癌基因MYC的转录,激活WEEL基因表达从而活化G2/M检查点阻止细胞进入M期[17-18]。所以NR1D1可通过抑制BMAL1基因的转录而促进细胞分裂增殖。癌症是机体在各种致瘤因素的作用下,局部组织细胞在基因水平上失去对其生长的正常调控导致异常增生与分化而形成的,在体内一个或几个癌变前的细胞逃脱凋亡的监管就可能会发展成癌症。
miR-185能够明显抑制肝癌细胞的生长、侵袭和迁移。生物信息学数据库资料结合基因芯片结果表明:NR1D1可能是miR-185的靶基因,其3′UTR区有与miR-185结合的保守位点;采用荧光报告载体实验证明NR1D1是miR-185的直接靶基因。在miR-185的功能受到抑制或过表达miR-185的肝癌细胞中,NR1D1在mRNA和蛋白水平上的表达都有明显升高或降低,也证明NR1D1受到miR-185的负性调控。这说明miR-185可能是通过下调NR1D1的表达,抑制肝癌细胞的生长。
miR-185作为一个关键性的调节miRNA,可下调NR1D1蛋白表达抑制肝癌细胞的生长增殖、侵袭迁移行为,为进一步研究肝癌的诊断和治疗提供新的思路和方向。
| [1] | DeSano J T, Xu L. MicroRNA regulation of cancer stem cells and therapeutic implications[J]. AAPS J,2009, 11 (4) : 682 –692. DOI:10.1208/s12248-009-9147-7 |
| [2] | Xu X, Jiang C, Wang S, et al. HPIP is upregulated in liver cancer and promotes hepatoma cell proliferation via activation of G2/M transition[J]. IUBMB Life,2013, 65 (10) : 873 –882. DOI:10.1002/iub.1202 |
| [3] | Cao L, Zhou Y, Zhai B, et al. Sphere-forming cell subpopulations with cancer stem cell properties in human hepatoma cell lines[J]. BMC Gastroenterol,2011, 11 : 71 . DOI:10.1186/1471-230x-11-71 |
| [4] | Huang Y H, Lin K H, Chen H C, et al. Identification of postoperative prognostic microRNA predictors in hepatocellular carcinoma[J]. PLoS One,2012, 7 (5) : e37188 . DOI:10.1371/journal.pone.0037188 |
| [5] | 谭翠, 莫春容. miR-148b/DUSP1调节巨噬细胞分泌细胞因子CD206促进肝癌的发生[J]. 第三军医大学学报,2016, 38 (3) : 270 –275. DOI:10.16016/j.1000-5404.201506030 |
| [6] | Qadir X V, Han C, Lu D, et al. miR-185 inhibits hepatocellular carcinoma growth by targeting the DNMT1/PTEN/Akt pathway[J]. Am J Pathol,2014, 184 (8) : 2355 –2364. DOI:10.1016/j.ajpath.2014.05.004 |
| [7] | Feng D, Liu T, Sun Z, et al. A circadian rhythm orchestrated by histone deacetylase 3 controls hepatic lipid metabolism[J]. Science,2011, 331 (6022) : 1315 –1319. DOI:10.1126/science.1198125 |
| [8] | Cho H, Zhao X, Hatori M, et al. Regulation of circadian behaviour and metabolism by REV-ERB-α and REV-ERB-β[J]. Nature,2012, 485 (7396) : 123 –127. DOI:10.1038/nature11048 |
| [9] | Woldt E, Sebti Y, Solt L A, et al. Rev-erb-α modulates skeletal muscle oxidative capacity by regulating mitochondrial biogenesis and autophagy[J]. Nat Med,2013, 19 (8) : 1039 –1046. DOI:10.1038/nm.3213 |
| [10] | Gerhart-Hines Z, Feng D, Emmett M J, et al. The nuclear receptor Rev-erbα controls circadian thermogenic plasticity[J]. Nature,2013, 503 (7476) : 410 –413. DOI:10.1038/nature12642 |
| [11] | Jager J, O'Brien W T, Manlove J, et al. Behavioral changes and dopaminergic dysregulation in mice lacking the nuclear receptor Rev-erbα[J]. Mol Endocrinol,2014, 28 (4) : 490 –498. DOI:10.1210/me.2013-1351 |
| [12] | Berezikov E, Guryev V, van-de-Belt J, et al. Phylogenetic shadowing and computational identification of human microRNA genes[J]. Cell,2005, 120 (1) : 21 –24. DOI:10.1016/j.cell.2004.12.031 |
| [13] | Tang H, Wang Z, Liu X, et al. LRRC4 inhibits glioma cell growth and invasion through a miR-185-dependent pathway[J]. Curr Cancer Drug Targ,2012, 12 (8) : 1032 –1042. DOI:10.2174/156800912803251180 |
| [14] | Liu M, Lang N, Chen X, et al. miR-185 targets Rho A and Cdc42 expression and inhibits the proliferation potential of human colorectal cells[J]. Cancer Lett,2011, 301 (2) : 151 –160. DOI:10.1016/j.canlet.2010.11.009 |
| [15] | Zhi Q, Zhu J, Guo X, et al. Metastasis-related miR-185 is a potential prognostic biomarker for hepatocellular carcinoma in early stage[J]. Biomed Pharmacother,2013, 67 (5) : 393 –398. DOI:10.1016/j.biopha.2013.03.022 |
| [16] | Sadacca L A, Lamia K A, deLemos A S, et al. An intrinsic circadian clock of the pancreas is required for normal insulin release and glucose homeostasis in mice[J]. Diabetologia,2011, 54 (1) : 120 –124. DOI:10.1007/s00125-010-1920-8 |
| [17] | Lee S, Donehower L A, Herron A J, et al. Disrupting circadian homeostasis of sympathetic signaling promotes tumor development in mice[J]. PLoS One,2010, 5 (6) : e10995 . DOI:10.1371/journal.pone.0010995 |
| [18] | Fu L, Patel M S, Bradley A, et al. The molecular clock mediates leptin-regulated bone formation[J]. Cell,2005, 122 (5) : 803 –815. DOI:10.1016/j.cell.2005.06.028 |



