在世界范围内,结肠癌(colorectal cancer,CRC)的发病率在所有恶性肿瘤中居第3位,每年可新增140余万患者,约70万患者因结肠癌而死亡[1]。结肠癌的高发病率和不良预后给人类健康带来了极大威胁,严重影响了患者健康及生活质量。流行病学调查发现,东亚国家结肠癌的发病与食用腌肉、肥胖、吸烟等因素有关[2];但是,有关结肠癌发生、发展的具体分子机制仍未得到阐明。
口腔癌过表达蛋白1(oral cancer overexpressed protein 1,ORAOV1)是编码基因定位于11号染色体的一种蛋白,最初在口腔上皮肿瘤中发现,在体内广泛表达,以肝、胰腺、肾组织中含量相对较高[3]。口腔与结肠均属消化系统中的空腔结构,口腔癌与结肠癌的发病均与饮食密切相关,在发病机制上也有如APC基因失活等一些共性[4, 5];且在另一消化系统空腔脏器恶性肿瘤--胃癌中,ORAOV1的蛋白表达水平也同样发生了上调[6]。故我们推测在结肠癌组织中ORAOV1的表达也可能发生变化,并可能参与调控结肠癌细胞的生物学行为。为验证上述假设,本研究拟在结肠癌及癌旁组织中检测ORAOV1的表达变化,并初步探讨其对结肠癌细胞增殖能力的影响及可能原因,以期为结肠癌的发生发展机制及潜在治疗靶点的寻找提供实验依据。
1 资料与方法 1.1 材料结肠癌及癌旁组织来源于第三军医大学大坪医院野战外科研 究所内镜中心2013年10月至2014年3月 经病理检查证实为结肠癌的患者,均为男性,平均年龄65岁,均获患者知情同意及伦理委员会批准。结肠癌细胞株LoVo、SW480均购于中科院上海细胞库。干扰ORAOV1所用pGPU6/GFP/Neo-sh-ORAOV1质粒及对照空质粒购于上海吉玛公司。Leibovitz’s L-15及Ham’s F12K培养基购于Gibco公司,青链霉素、胎牛血清、0.25%胰酶均购于HyClone公司。反转录试剂盒及SYBR Green荧光定量PCR试剂盒购于TaKaRa公司。蛋白浓度测定试剂盒、SDS-PAGE上样缓冲液及凝胶配制试剂盒购于碧云天公司。兔抗人ORAOV1抗体购于Abcam公司,鼠抗人β-actin抗体、HRP标记的山羊抗鼠及抗兔抗体均购自中杉金桥公司。RIPA裂解液及TRIzol试剂、脂质体Lipofectamine2000购买于Life techologies公司。CCK-8细胞增殖活性检测试剂盒购于Dojindo公司。细胞周期检测试剂盒及细胞凋亡检测试剂盒均购于贝博公司。ECL化学发光试剂盒及PVDF膜购自Millipore公司。
1.2 方法 1.2.1 细胞培养LoVo细胞培养于Ham’s F12K培养基中,SW480培养于Leibovitz’s L-15培养基中,各含1%青链霉素、10%胎牛血清。细胞培养于37 ℃恒温孵箱中,湿度为95%。根据细胞生长情况,培养每3~4天传代1次,取状态良好的对数生长期细胞进行实验。
1.2.2 质粒转染本实验所用shRNA序列为:TTC-GTTACTCAATGTTCAGCCAGACTTTA。转染操作前,将培养的LoVo细胞及SW480细胞以3×104/孔的密度铺于12孔板中,待其生长至汇合度60%左右,按Life techologies公司脂质体Lipofectamine2000说明书进行转染操作,于转染后48 h提取细胞蛋白进行转染效果鉴定。并将转染成功的细胞以G418低浓度持续培养。
1.2.3 总RNA提取、逆转录与荧光定量PCR反应提取组织总RNA前,先在液氮中取出组织并称质量后,迅速放入预冷研钵中,加入液氮充分研磨,并转移至EP管中;提取培养细胞总RNA前,先弃去培养基,以PBS清洗细胞3次。在准备工作完成后,向已磨碎组织或已清洗细胞中加入TRIzol试剂,随后按照TRIzol 试剂说明书进行氯仿抽提、异丙醇沉淀、 乙醇洗涤等后续提取步骤。按逆转录试剂盒说明书,以30 μL 体系将1 μg RNA逆转录为cDNA。再按照SYBR GREEN定量PCR试剂盒说明书以25 μL体系荧光进行定量PCR反应。反应步骤为:95 ℃ 5 min→40×(95 ℃ 5 s→60 ℃ 30 s) →72 ℃ 2 min。引物序列:ORAOV1正向引物:5′- GTTTGGGTGTGATGGAGGGA-AG-3′,反向引物:5′- CCTTCTCAGTGGTGCAACTGTG-3′,产物长度132bp;β-actin正向引物:5′- CACCATTGGCAATGAGCGGTTC-3′,反向引物:5′- AGGTCTTTGCGGATGTCCACGT-3′,产物长度129 bp。定量结果以Ct值表示,以β-actin为内参,每组设置3个复孔,以2-ΔΔCt计算基因相对表达量。
1.2.4 蛋白提取及Western blot检测组织蛋白提取时,将组织取出并称质量后,迅速置于研钵中并加入液氮充分研磨;细胞蛋白提取时,首先倒去培养基并以PBS清洗。随后向预处理好的组织样本或细胞中加入RIPA裂解液冰上裂解1 h,最后4 ℃高速离心并取上清。测定蛋白浓度后,将蛋白以每孔50 μg 的量在SDS-PAGE凝胶中进行电泳,上层胶电压为70V,下层胶电压为120 V。电泳结束后,在冰上以100V的电压转膜1.5 h,封闭后4 ℃一抗孵育过夜(ORAOV1抗体稀释比为1 :1 000,β-actin为1 :400),翌日取出后室温二抗孵育2 h(山羊抗兔及抗鼠抗体稀释比均为1 :10 000),最后以ECL法进行显影,β-actin为内参。
1.2.5 CCK-8法检测细胞增殖将细胞以2×103/孔 的密度接种在96孔板上,每孔含100 μL全培养基,并设置细胞空白孔及试剂空白孔,每组设置3个复孔。孵箱培养24 h后各孔加入10 μL的CCK-8溶液,混匀并除去气泡;37 ℃孵育2 h后使用酶标仪测定450 nm处的光密度,用标准曲线及细胞空白孔、试剂空白孔读数标化所测定的光密度[D(450)]。
1.2.6 流式细胞术检测细胞周期首先以1×106/孔的量在6孔板上铺入细胞,24 h后收集贴壁细胞,并以75%乙醇4 ℃固定过夜。第2天去除固定液后,加入RNA酶以除去RNA对结果的干扰,并加入PI染液、上机检测。实验设3次重复。
1.2.7 流式细胞术检测细胞凋亡将各组细胞以的数量铺于6孔板,待细胞贴壁后,收集孔中所有细胞,加入400 μL Annexin V后再加入5 μL Annexin V-FITC染液,避光孵育15 min,最后再加入10 μL PI染液、上机检测。实验设3次重复。
1.3 统计学处理使用SPSS 18.0统计软件对数据进行处理和分析,结果以x±s表示,采用单因素方差分析进行多组计量资料间均数的比较,采用χ2检验对计数资料(率)进行比较。
2 结果 2.1 ORAOV1在结肠癌组织及癌旁组织中的mRNA表达变化为分析ORAOV1的mRNA水平,我们对6例患者的结肠癌及癌旁组织标本进行了实时荧光定量PCR检 测。结果显示:结肠癌组织中ORAOV1的mRNA水平较癌旁组织明显升高(P<0.05),差异有统计学意义(图 1)。
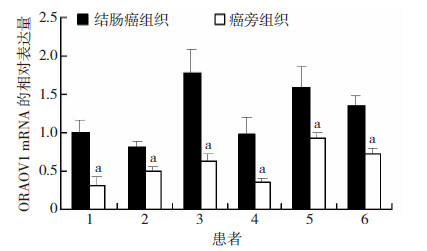 |
| 1-6: 分别代表6例结肠癌与相对应的癌旁组织 a: P<0.05,与结肠癌组织比较 图 1 ORAOV1在结肠癌组织及癌旁组织中的mRNA表达变化 |
为进一步了解ORAOV1在结肠癌及癌旁组织的蛋白表达情况,我们分别提取了6例患者的结肠癌及癌旁组织标本的总蛋白进行Western blot检测。结果 显示:在6例患者中,相比于癌旁组织,同一患者的结肠癌组织中ORAOV1的蛋白表达含量明显增加(图 2)。
 |
| 1、3、5、7、9、11:结肠癌组织; 2、4、6、8、10、12:癌旁组织;1与2、3与4、5与6、7与8、9与10、11与12分属6例患者 图 2 ORAOV1在结肠癌组织及癌旁组织中的蛋白表达变化 |
在结肠癌组织中,ORAOV1的mRNA及蛋白水平均高于癌旁组织。为研究ORAOV1是否参与结肠癌的发生、发展过程、寻找其相应的表型,我们通过质粒转染,在LoVo及SW480两种结肠癌细胞株中进行了RNAi并以Western blot进行了干扰效果鉴定。结果显示:在LoVo细胞中,相比于未转染的野生型细胞(LoVo-WT组),转染空质粒时(LoVo-ctrl组)的ORAOV1蛋白表达水平并无明显变化;而转染sh-ORAOV1干扰质粒时(LoVo-sh-ORAOV1组),ORAOV1的表达水平较LoVo-WT组及LoVo-ctrl组细胞明显降低(图 3A)。
 |
| A:LoVo细胞中ORAOV1的干扰效果鉴定 1:未转染质粒的野生型细胞(LoVo-WT);2:转染空质粒的对照细胞(LoVo-ctrl);3:转染sh-ORAOV1干扰质粒的LoVo细胞(LoVo-sh-ORAOV1);B:SW480细胞中ORAOV1的干扰效果鉴定 1:未转染质粒的野生型细胞(SW480-WT);2:转染空质粒的对照细胞(SW480-ctrl);3:转染sh-ORAOV1干扰质粒的SW480细胞(SW480-sh-ORAOV1) 图 3 LoVo细胞及SW480细胞中ORAOV1的干扰效果鉴定 |
在另一种结肠癌细胞株SW480细胞中,SW480-sh-ORAOV1组细胞的ORAOV1蛋白表达同样明显低 于SW480-WT组及SW480-ctrl组(图 3B)。上述结果共同说明质粒转染及RNAi成功,所获得的ORAOV1低表达LoVo及SW480结肠癌细胞株可用于后续实验。
2.4 干扰ORAOV1对结肠癌细胞LoVo及SW480增殖能力的影响为研究ORAOV1对结肠癌细胞增殖能力的影响,我们使用CCK-8法检测了ORAOV1正常表达与低表达时LoVo细胞及SW480细胞增殖能力的变化。可见在为期5d的培养中,LoVo-WT组与LoVo-ctrl组的增殖能力并无明显差别(P>0.05)。ORAOV1低表达的LoVo-sh-ORAOV1组细胞增殖能力在第2天之间与前两组差异无统计学意义(P>0.05),但在培养第2天之后则明显低于另两组,结果差异有统计学意义(P<0.05,图 4A)。
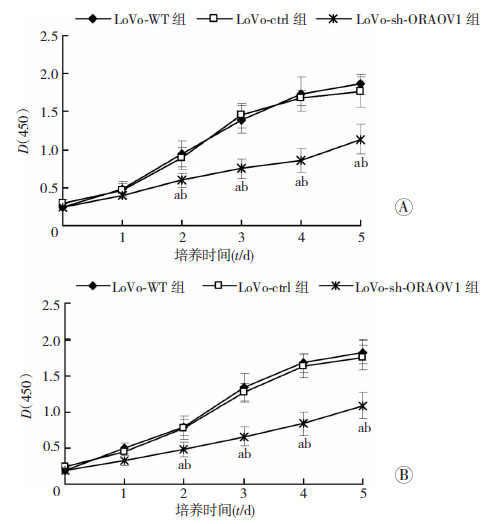 |
| A:干扰ORAOV1对LoVo细胞增殖能力的影响 a: P<0.05, 与SW480-WT组比较;b: P<0.05,与SW480-ctrl组比较;B:干扰ORAOV1对SW480细胞增殖能力的影响 a: P<0.05,与LoVo-WT组比较;b: P<0.05,与LoVo-ctrl组比较 图 4 CCK-8法检测各组细胞培养不同时间的增殖变化 |
在对SW480细胞的CCK-8检测中,同样可见SW480-sh-ORAOV1组细胞增殖能力明显低于SW480-WT组及SW480-ctrl组(P<0.05,图 4B)。以上结果说明ORAOV1的表达受到干扰时,将明显影响结肠癌细胞株LoVo及SW480的增殖能力。
2.5 干扰ORAOV1对结肠癌细胞株LoVo及SW480细胞周期的影响细胞的增殖能力与细胞周期密切相关,为了解ORAOV1是否通过影响细胞周期进而改变了结肠癌细胞株LoVo及SW480的增殖能力,我们利用流式细胞 术对细胞周期进行了检测。结果显示:在LoVo细胞中,LoVo-sh-ORAOV1组细胞处于S期的比例要明显高于LoVo-ctrl组[(45.25±3.17)%,(33.93±2.23)%,P<0.05],也高于LoVo-WT组[(45.25±3.17)%,(34.56±2.20)%,P<0.05],结果具有统计学意义。而LoVo-ctrl组与LoVo-WT组之间无明显差别 [(33.93±2.23)%,(34.56±2.20)%,P>0.05,图 5A]。
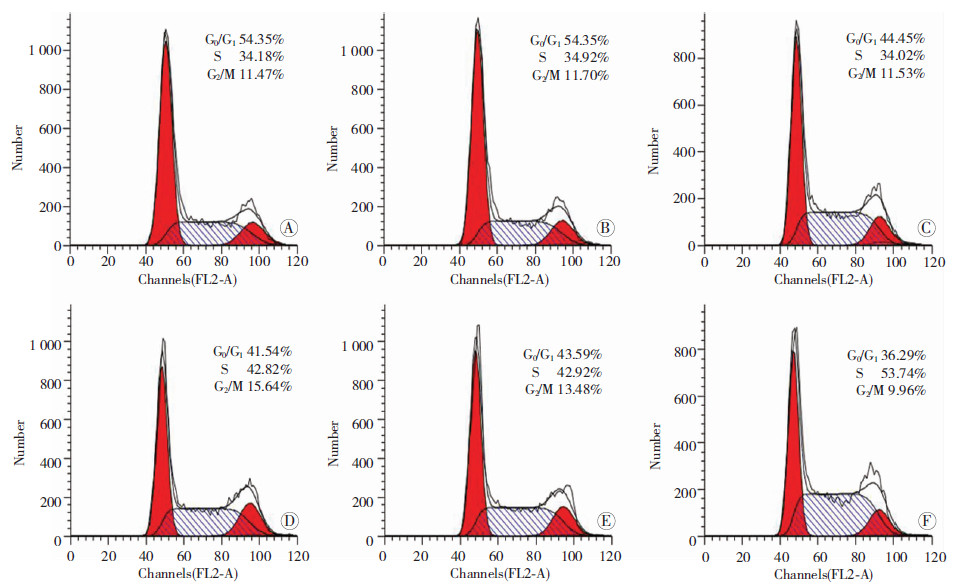 |
| A:LoVo-WT组; B:LoVo-ctrl组;C: LoVo-sh-ORAOV1组;D:SW480-WT组;E:SW480-ctrl组;F:SW480-sh-ORAOV1组 图 5 流式细胞术检测各组细胞周期的变化 |
在SW480细胞中,流式细胞术检测的S期比例变化趋势与LoVo细胞相似,SW480-sh-ORAOV1组明显高于SW480-ctrl组[(54.49±2.57)%,(40.08± 2.36)%,P<0.05],结果差异有统计学意义(图 5B)。 LoVo及SW480中的结果均提示:干扰ORAOV1可引起这两种结肠癌细胞发生S期阻滞,使增殖能力减弱。
2.6 干扰ORAOV1对LoVo细胞及SW480早期凋亡的影响细胞的增殖能力也与凋亡关系密切,为研究ORAOV1对结肠癌细胞凋亡的影响,进一步解释干扰OAROV1降低结肠癌细胞增殖能力的原因,我们采用流式细胞仪对LoVo及SW480两种结肠癌细胞株的早期凋亡情况进行了检测。在LoVo细胞中,LoVo-sh-ORAOV1组细胞的早期凋亡比例高于LoVo-ctrl组[(9.13±1.39)%,(4.71±0.65)%,P<0.05]及LoVo-WT组[(9.13±1.39)%,(3.68±0.36)%,P<0.05],差异均具有统计学意义;而LoVo-ctrl组与LoVo-WT组之间的早期凋亡则无明显变化[(4.71±0.65)%,(3.68±0.36)%,P>0.05,图 6A]。
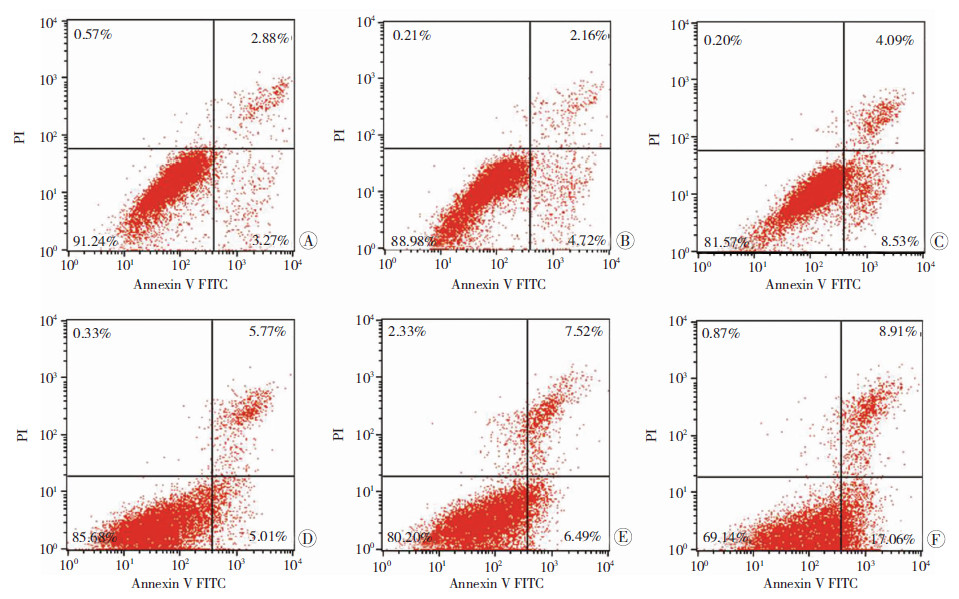 |
| A:LoVo-WT组; B:LoVo-ctrl组;C: LoVo-sh-ORAOV1组;D:SW480-WT组;E:SW480-ctrl组;F:SW480-sh-ORAOV1组 图 6 流式细胞术检测各组细胞的早期凋亡情况 |
对于SW480细胞,同样可观察到与LoVo细胞相似的结果。即:SW480-sh-ORAOV1组的早期凋亡细胞比例高于SW480-ctrl组[(15.76±1.76)%,(6.74±0.58)%,P<0.05,图 6B],差异均具有统计学意义。以上结果提示:干扰ORAOV1可增加结肠癌细胞LoVo及SW480的早期凋亡,可能是影响结肠癌细胞增殖能力的又一原因。
3 讨论结肠癌已成为人类面临的第3大恶性肿瘤,虽然结肠癌的诊断和治疗水平都取得了较大进步,但整体治疗效果仍不容乐观,发生转移的结肠癌患者5年生存率仅有11.7%[7]。结肠癌的高发病率及低生存率,很大一部分的原因在于其发病机制及发展因素尚未得到充分阐明。因此,探索结肠癌的发生、发展机制,具有较大的理论意义。
Zhai等[8]利用人ORAOV1在酿酒酵母中的同源蛋白YNL260c进行研究,发现YNL260c对于酵母核糖体60S亚基的成熟至关重要,YNL260c缺失的酵母核糖体不能形成转录起始复合物,进而生物合成功能丧失。这提示在生物合成旺盛的肿瘤组织中,ORAOV1也可能通过维持或增加核糖体的功能,促进一系列参与DNA复制、能量代谢等重要细胞活动的蛋白合成,最终促进肿瘤的发生、发展。这可能是我们发现ORAOV1在结肠癌组织中高表达的原因之一。
本研究还发现,使用RNAi技术分别干扰LoVo、SW480两种结肠癌细胞株中ORAOV1的表达后,可明显抑制结肠癌细胞株的增殖活性,并可引起细胞分裂阻滞于S期。细胞的增殖与细胞周期的关系非常紧密,细胞周期则是一个由细胞周期蛋白(Cyclins)-细胞周期蛋白依赖激酶(cyclin-dependent kinases,CDKs)复合物严密调控的过程。在细胞进入周期的每个阶段前,Cyclins-CDKs复合物可起到“检查点”的作用,从而保证染色体能以高保真度进行复制与子代细胞之间的分配。有研究表明,在HeLa细胞及口腔鳞癌细胞中干扰ORAOV1可通过降低Cyclin A、Cyclin B1、Cyclin D1及Cdc2的表达,进而改变Cyclins-CDKs复合物的功能,使细胞发生DNA合成受抑及S期阻滞[9, 10],但在结肠癌细胞中是否也存在相同的机制,仍需我们在后续实验中探索。此外,Cyclin D1是调控细胞周期的重要分子,在多种肿瘤细胞中高表达,也是肿瘤细胞增殖活跃的标志之一[11]。令人感兴趣的是,ORAOV1与细胞周期蛋白Cyclin D1的编码基因序列之间的距离仅为8kb左右,提示这两个分子之间可能存在共有的转录调控序列或相互调控机制。本研究发现,干扰ORAOV1可造成S期阻滞;前人研究发现,干扰ORAOV1蛋白的表达时,Cyclin D1的蛋白表达水平也 可出现明显下降[9],两个分子表达水平之间似乎呈正相关的关系。故干扰结肠癌细胞中ORAOV1所产生的细胞周期阻滞的改变,不仅可能是ORAOV1通过抑制核糖体合成能力造成的非特异性的改变,更有可能是ORAOV1通过某种机制调节而Cyclin D1表达状态的结果,这也是我们在后续研究中需要继续探索的方向。
此外,细胞的增殖速度也与凋亡关系密切。凋亡是真核生物中普遍存在的重要生长调控机制,不仅参与组织、器官的发育过程,也与肿瘤等疾病紧密相关。经典的凋亡途径是一系列酶促反应,P53在凋亡的调控中发挥重要作用[12]。凋亡的增加,必然导致细胞增殖能力的降低。有学者发现,干扰ORAOV1可通过上调P53、下调Bcl-2表达以及激活Caspase3、8、9达到增加细胞凋亡的作用[9]。我们在实验中也发现了干扰ORAOV1可使结肠癌细胞株LoVo及SW480的早期凋亡增加;但大部分肿瘤组织,尤其是结肠癌组织中的P53往往已发生突变,失去了在正常组织中发挥的促凋亡功能[13]。故我们考虑P53可能并不参与干扰ORAOV1所致的促凋亡效应,ORAOV1的这种作用可能与其他机制有关。
综上所述,在本研究中发现,结肠癌组织中的ORAOV1 mRNA及蛋白水平均较癌旁组织表达上调;并在两种结肠癌细胞株中发现干扰ORAOV1可通过增加细胞周期阻滞及早期凋亡,从而调控结肠癌细胞的增殖能力。我们推测,在结肠癌发生、发展过程中,ORAOV1表达上调,继而通过减少细胞周期阻滞、减少凋亡等方式促进了肿瘤细胞的增殖能力,参与了结肠癌的发生、发展过程。
| [1] | Torre L A, Bray F, Siegel R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [2] | Center M M, Jemal A, Smith R A, et al. Worldwide variations in colorectal cancer[J]. CA Cancer J Clin, 2009, 59(6): 366-378. DOI:10.3322/caac.20038 |
| [3] | Huang X, Gollin S M, Raja S, et al. High-resolution mapping of the 11q13 amplicon and identification of a gene, TAOS1, that is amplified and overexpressed in oral cancer cells[J]. Proc Natl Acad Sci USA, 2002, 99(17): 11369-11374. DOI:10.1073/pnas.172285799 |
| [4] | Sikdar N, Paul R R, Panda C K, et al. Loss of heterozygosity at APC and MCC genes of oral cancer and leukoplakia tissues from Indian tobacco chewers[J]. J Oral Pathol Med, 2003, 32(8): 450-454. |
| [5] | Dow L E, O’Rourke K P, Simon J, et al. Apc Restoration Promotes Cellular Differentiation and Reestablishes Crypt Homeostasis in Colorectal Cancer[J]. Cell, 2015, 161(7): 1539-1552. DOI:10.1016/j.cell.2015.05.033 |
| [6] | Kang J U, Koo S H. ORAOV1 is a probable target within the 11q13.3 amplicon in lymph node metastases from gastric adenocarcinoma[J]. Int J Mol Med, 2012, 29(1): 81-87. DOI:10.3892/ijmm.2011.811 |
| [7] | Markowitz S D, Bertagnolli M M. Molecular origins of cancer: Molecular basis of colorectal cancer[J]. N Engl J Med, 2009, 361(25): 2449-2460. DOI:10.1056/ NEJMra0804588 |
| [8] | Zhai C, Li Y, Mascarenhas C, et al. The function of ORAOV1/LTO1, a gene that is overexpressed frequently in cancer: essential roles in the function and biogenesis of the ribosome[J]. Oncogene, 2014, 33(4): 484-494. DOI:10. 1038/ onc. 2012.604 |
| [9] | Jiang L, Zeng X, Wang Z, et al. Oral cancer overexpressed 1 (ORAOV1) regulates cell cycle and apoptosis in cervical cancer HeLa cells[J]. Mol Cancer, 2010, 9: 20. DOI: 10.1186/1476-4598-9-20 |
| [10] | 任吉华, 冉龙宽, 李宛蔚, 等. 细胞周期蛋白D2对HBV复制的影响[J]. 第三军医大学学报, 2015, 37(15): 1550-1554. DOI:10.16016/j.1000-5404.201411228 |
| [11] | 张翀, 李梦侠, 程燚, 等. APE1和p53蛋白在A549细胞和HeLa细胞中的结合作用[J]. 第三军医大学学报, 2013, 35(21): 2314-2319. |
| [12] | Prives C, Lowe S W. Cancer: Mutant p53 and chromatin regulation[J]. Nature, 2015, 525(7568): 199-200. DOI:10.1038/nature15212 |



