目前临床上应用的合成骨替代材料,如羟基磷灰石、陶瓷材料等,存在不利于细胞粘附以及生物相容性差等缺点[1]。为了解决上述的问题,需要新的材料来对其表面进行修饰或是替换,水凝胶材料是很好的选择。RADA16-Ⅰ由16肽氨基酸组成,是自组装多肽水凝胶的代表,其能在水相离子或生理盐溶液触发下,分子水平组装成β折叠,并往复形成互补离子键,最终组装成纳米纤维,其纤维直径10~20 nm,孔径5~200 nm,含水量大于99%[2, 3, 4]。研究表明,水凝胶结构能够模拟细胞外基质(extracellular matrix,ECM)及其微环境,为细胞提供良好的体外生长环境,有利于细胞的粘附、增殖和分化[5];但是,目前作为支架材料的水凝胶缺乏促进成骨分化的能力。Osteostatin(Thr-Arg-Ser-Ala-Trp)是甲状旁腺类激素相关蛋白(PTHrP)C末端结构域PTHrP(107~111)五肽片段,能够介导PTH/PTHrP受体非相关性受体,在体外促进成骨细胞生长和分化[6, 7, 8]。此外,Osteostatin在骨缺损兔体内能促进骨再生[9, 10]。本研究通过利用Osteostatin片段对传统RADA16-Ⅰ进行修饰,期望得到兼顾粘附和促成骨相关性能的自组装多肽纳米水凝胶材料。
1 材料与方法 1.1 实验材料及主要试剂MC3T3-E1 Subclone 14小鼠成骨细胞前体细胞(ATCC),多肽RADA16-Ⅰ(AcN-RADARADARADA-RADA-CONH2,相对分子质量为1 671.76)、RADA16/TRSAW(相对分子质量为2 387.54)和TRASW(相对分子质量为619.58)购自上海强耀生物科技有限公司(纯度≥99%),α-MEM培养基,胎牛血清、0.25%胰蛋白酶-0.04% EDTA (Gibco公司),14 mm圆形盖玻片(NEST公司),CCK-8检测试剂盒(同仁公司),碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒(南京建成),茜素红-S(Sigma公司),罗丹明鬼笔环肽(Sigma公司),DAPI(碧云天公司),反转录试剂盒及实时荧光定量PCR试剂盒(TaKaRa公司)。
1.2 实验方法 1.2.1 通过肽固相合成法[11]将Osteostatin与 RADA16-Ⅰ C末端相连,合成自组装多肽RADA16-TRSAW (AcN-RADARADARADARADA-GG-TRSAW-CONH2) 肽粉。自组装多肽母液的制备向肽粉(每10 毫克分装)内加入1 mL无菌超纯水,移液枪吹打混匀后,超声波清洗机室温超声处理30 min去除溶液粘性,得到1%(质量体积分数)的多肽母液。取RADA16-Ⅰ和RADA16-TRSAW母液等体积混合,得到1%(质量体积分数)TRSAWmx母液。
1.2.2 原子力显微镜(AFM)观察自组装多肽的纤维结构用超纯水分别稀释TRSAW、RADA16-Ⅰ、RADA16-TRSAW和TRSAWmx母液,得到0.5‰(质量体积分数)的稀释液,超声波清洗机室温超声处理30 min。取不同多肽稀释液各5 μL分别滴加到清洁的圆形云母片上,静置15 s后,用100 μL超纯水沿液滴边缘冲洗3次。30 ℃室温静置,待云母片自然干燥 后,AFM进行观察。AFM参数设置为轻敲模式,扫描区域为2 μm×2 μm,扫描频率是1.0 Hz;扫描探针(Model:Arrow UHFAuD)参数:弹性系数(k)为6(1.5~21.0)N/m,材质Si,无涂层,尖端半径为(10±2)nm。
1.2.3 自组装多肽水凝胶的制作和MC3T3-E1细胞接种分别将1%(质量体积分数)RADA16-Ⅰ和TRSAWmx母液与20%(质量体积分数)无菌蔗糖溶液按体积比1 ∶1混合,制成0.5%水凝胶工作液。取14 mm 圆形清洁盖玻片置于24孔培养板内,向每张盖玻片上分别滴加100 μL工作液。沿每孔内壁,缓慢加入含10%胎牛血清+1%双抗+50 μg/mL抗败血酸+ 10 mmol/L β-甘油磷酸钠的α-MEM成骨培养液,培养板置于37 ℃、5%CO2的孵箱中静置1 h。MC3T3-E1细胞常规消化离心后,成骨培养液制成5×104个/mL的单细胞悬液,待凝胶固化成型后,吸净孔内培养基,每孔接种1 mL MC3T3-E1细胞悬液于37 ℃、5%CO2孵箱中培养,隔天换液。
1.2.4 MC3T3-E1细胞在自组装多肽水凝胶的粘附性能分别向24孔板中放入14 mm圆形盖玻片,并滴加RADA16-Ⅰ和TRSAWmx工作液并使其成胶。在空白盖玻片、RADA16-Ⅰ水凝胶、TRSAWmx水凝胶上滴加1 mL MC3T3-E1细胞悬液,分别在第10、30、60、90分钟吸净孔内培养基,PBS清洗1次,以除去未粘附的细胞,随机选取视野对细胞进行计数。
1.2.5 CCK-8检测细胞增殖情况在96孔板内,滴加RADA16-Ⅰ和TRSAWmx工作液各50 μL/孔,培养板置于37 ℃、5% CO2的孵箱中静置1 h成胶后,分别在空白孔、RADA16-Ⅰ水凝胶、TRSAWmx水凝胶上滴加100 μL 密度为5×104/mL 的MC3T3-E1细胞悬液。每天换液,在培养的1、3、5、7 d,吸去孔中培养基,按每10 ∶1的比例混合成骨培养液和CCK-8试剂,每孔加入100 μL CCK-8混合液,培养板置于37 ℃、5% CO2的孵箱中孵育1 h后,以酶标仪在450 nm处测D(450)值。
1.2.6 激光共聚焦显微镜观察MC3T3-E1细胞在水凝胶表面的生长细胞在水凝胶中培养3、7、14 d后,吸净孔内培养基,PBS清洗3次,4%多聚甲醛固定30 min,用PBS清洗3次,0.2%Triton X-100室温通透10 min,PBS清洗3次,加入5% BSA封闭1 h,随后PBS清洗3次,加入配置好的罗丹明 -鬼笔环肽(5 U/mL) 工作液,室温避光孵育30 min。用PBS清洗3次, 10 μg/mL的DAPI染液浸没样本,室温避光孵育10 min。 PBS清洗3次,封片后,激光共聚焦荧光显微镜拍照。
1.2.7 ALP活性检测细胞在水凝胶中培养3、7 d和14 d后,吸净孔内的培养基,PBS清洗2次,每孔加入1%Triton X-100(100 μL)反复吹打,显微镜观察细胞破碎。严格按照碱性磷酸酶试剂盒说明在96孔板内进行加样,以酶联免疫检测仪在520 nm处测定D(520),同时用BCA法测定蛋白浓度,并计算ALP的活力。
1.2.8 茜素红-S染色细胞在水凝胶中诱导培养14 d后,吸净孔内的培养基,PBS清洗2次,4%多聚甲 醛固定20 min后,PBS清洗3次,加入茜素红-S染液室温下染色10 min,PBS清洗残留染液,随机取视野拍照。
1.2.9 RT-PCR在6孔细胞培养板中分别用RADA16-Ⅰ和TRSAWmx工作液成胶,在空白孔、RADA16-Ⅰ水凝胶、TRSAWmx水凝胶上加入3 mL 1×105/mL的MC3T3-E1细胞悬液。培养板置于37 ℃、5%CO2的孵箱中,在培养第14天后,吸净培养基,PBS清洗3次,随后加入TRIzol提取RNA,各取1 μL mRNA逆转录获得cDNA。随后根据TaKaRa公司逆转录反应步骤,进行RT-PCR反应。β-actin、ALP、 骨钙蛋白(osteocalcin,OCN)、血管内皮生长因子(vascular endothelial growth factor,VEGF)引物序列见表 1。使用2-△△Ct对基因相对表达量进行计算。
| 基因 | 引物序列(5′→3′) |
| β-actin | 上游 CATTGCTGACAGGATGCAGA; |
| 下游 CTGCTGGAAGGTGGACAGTGA | |
| ALP | 上游 AGATGATGACTCTGAGCCTCCTT; |
| 下游 GATGGGACAGCCTAAACTTGG | |
| VEGF | 上游 GCTACTGCCGTCCGATTGAG; |
| 下游 GCTGGCTTTGGTGAGGTTTG | |
| OCN | 上游 GGACCATCTTTCTGCTCACTC; |
| 下游 CACTACCTTATTGCCCTCCTG |
使用SPSS 14.0 统计软件进行单因素方差分析,结果以x±s表示。
2 结果 2.1 原子力显微镜观察不同材料的纳米结构原子力显微镜下分别观察RADA16-Ⅰ 、RADA16-TRSAW、TRSAW和TRASWmx 4组短肽的纳米结构,TRSAW呈云絮状,无法形成纳米纤维状结构。RADA16-TRSAW自组装成粗细不规则的斑片状纳米纤维,长径为(523.7±142.9)nm,纤维之间未连接搭载,表明功能片段的加入会影响RADA16-Ⅰ β折叠形成,从而影响多肽自组装成长的纳米纤维。但是,将RADA16-Ⅰ与RADA16-TRSAW按1 ∶1比例混合后得到的TRSAWmx纤维长径为(810.2±96.7)nm,直径为(17.6±2.1)nm;RADA16-Ⅰ纤维长径为(847.7±87.8)nm,直径为(12.8±1.7)nm。TRSAWmx纳米纤维直径大于RADA16-Ⅰ(P<0.05)。两者均能形成长的纳米纤维(图 1)。
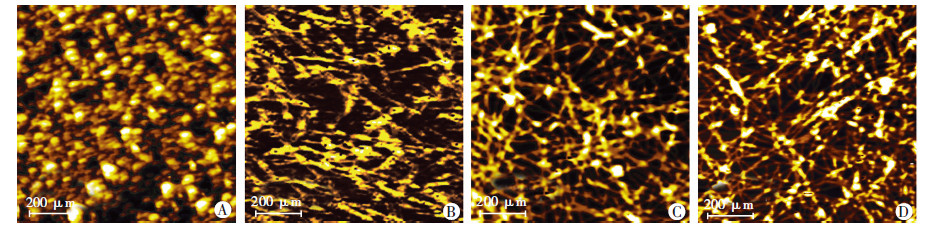 |
| A: TRSAW组;B: RADA16-TRSAW组;C: RADA16-Ⅰ组; D: TRSAWmx组 图 1 原子力显微镜观察不同材料的纳米结构 |
计数后得到的细胞个数,各组数据经过统计学处理10 min时,空白组与RADA16-Ⅰ组比较,差异有统计学意义(P<0.05,图 2);30、60 min和90 min时,空白组分别与RADA16-Ⅰ组和TRSAWmx组比较,差异有统计学意义(P<0.05),RADA16-Ⅰ组与TRSAWmx组比较,差异无统计学意义(P>0.05)。
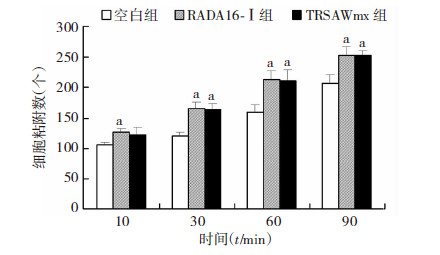 |
| a: P<0.05,与空白组比较 图 2 细胞计数法检测不同时相点MC3T3-E1细胞在不同材料的粘附情况 |
CCK-8检测细胞增殖结果如图 3所示,培养1 d时,空白组与RADA16-Ⅰ和TRSAWmx组比较,差异有统计学意义(P<0.05),RADA16-Ⅰ组与TRSAWmx组差异无统计学意义(P>0.05);第3、5、7天各组间差异有统计学意义(P<0.05)。
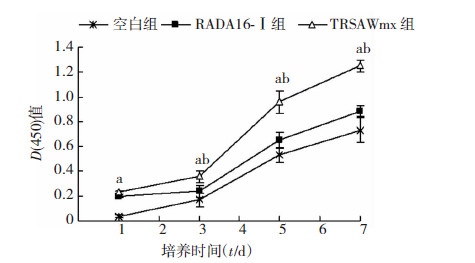 |
| a: P<0.05,与空白组比较;b: P<0.05,与RADA16-Ⅰ组比较 图 3 CCK-8检测MC3T3-E1细胞不同时间点在材料表面的增殖变化 |
激光共聚焦显微镜观察细胞生长形态如图 4所示,MC3T3-E1细胞分别接种于不同材料表面诱导分化培养3、7 d和14 d后,各组中细胞骨架纤维沿细胞长轴分布,连续排列,各时间点TRSAWmx组细胞数目较空白组和RADA16-Ⅰ组均有明显增加(P<0.05)。
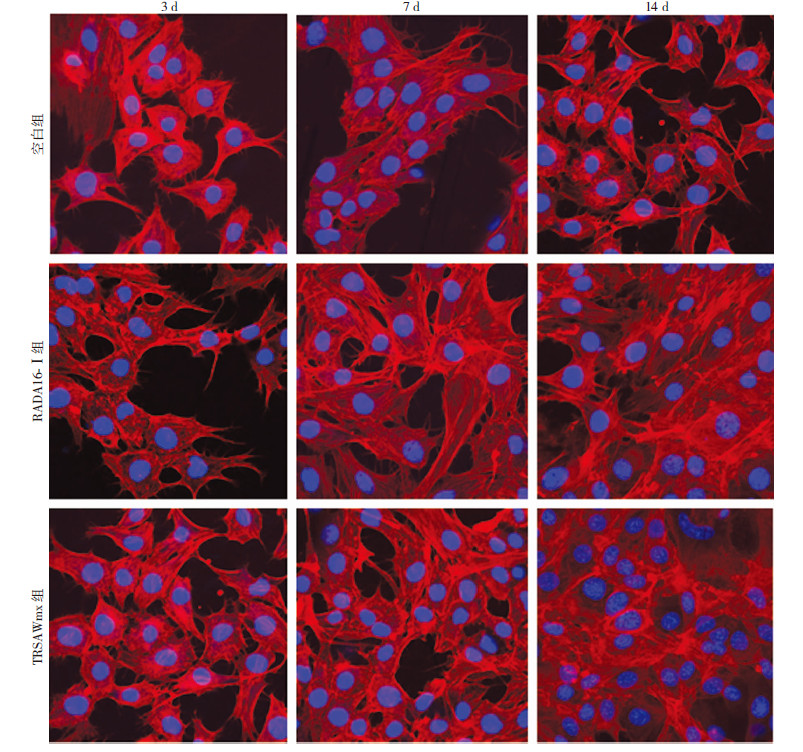 |
| 图 4 激光共聚焦显微镜观察MC3T3-E1细胞在材料表面不同时相点的生长形态 (×400) |
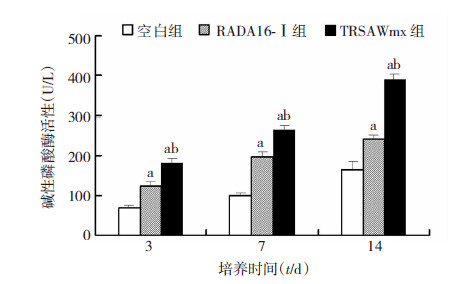
ALP试剂盒检测各时间点ALP活性,在3、7、14 d时各组间差异有统计学意义(P<0.05,图 5)。这提示TRSAWmx上培 养的MC3T3-E1细胞能够表达更高的碱性磷酸酶活性,成骨分化效果优于RADA16-Ⅰ 水凝胶。
通过14 d诱导培养后茜素红-S染色观察钙结节的生成情况结果如图 6所示,空白组细胞密度较小,仅有少量钙结节形成;RADA16-Ⅰ组细胞密度较大,可见数个钙结节形成;TRSAWmx组可见大量橘红色钙结节着色。
 |
| a: P<0.05,与空白组比较; b: P<0.05,与RADA16-Ⅰ组比较 图 5 MC3T3-E1细胞不同时间点在材料表面的ALP活性检测结果 |
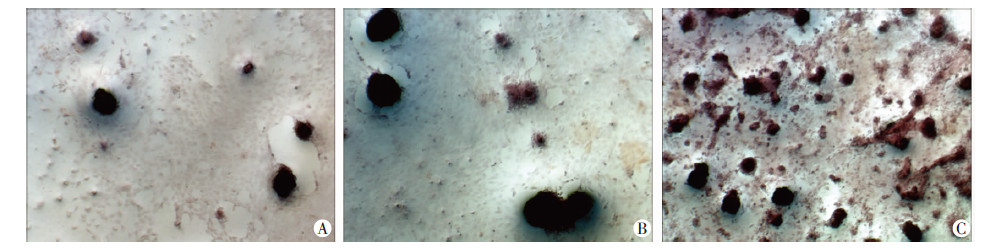 |
| A:空白组,细胞密度较小,仅有少量钙结节形成;B:RADA16-Ⅰ组,细胞密度较大,可见数个钙结节形成;C:TRSAWmx组,可见大量橘红色钙结节着色 图 6 MC3T3-E1细胞在材料表面培养14 d后的茜素红-S染色结果 (×40) |
根据Real-time PCR检测结果,将空白组表达量定义为1,每组的相对表达量如图 7所示。TRSAWmx组培养细胞的ALP、OCN和VEGF基因表达明显高于空白组和RADA16-Ⅰ组(P<0.05)。
 |
| a: P<0.05,与空白组比较;b: P<0.05,与RADA16-Ⅰ组比较 图 7 Real-time PCR检测MC3T3-E1细胞在不同材料上培养14 d时 ALP、OCN和VEGF基因的表达 |
自组装纳米多肽水凝胶RADA16-Ⅰ能够在水相离子或生理盐溶液触发下,形成含水量可超过99%的纳米纤维立体网状结构。研究证明,这种含水量高的空间网状结构能够模拟天然细胞外基质及微环境[12],为细胞提供三维的培养系统,对细胞的粘附、增殖、分化和相关生长因子的分泌有良好的促进作用[13, 14, 15, 16]。同时,其纳米级的直径10~20 nm及形成的微小孔径 5~200 nm[2, 3, 4]可用于骨髓中干细胞的富集,以提高成骨活性[5]。
目前,大量研究表明,通过向RADA16-Ⅰ 肽的C末端连接功能短肽片段,能够提高肽支架的相关生物组织特异性功能[3, 17, 18]。运用此种方法得到的新 型肽水凝胶能够在形成纳米纤维网状结构的同时,功能基团并未参与纳米丝纤维的β折叠形成,而是作为侧链突出于β折 叠之外,以此种方式发挥作用[14, 17, 18]。Pan等[19] 证明将BMP-2相关蛋白(P24) 修饰RADA16-Ⅰ 后能增强材料促BMSCs增殖、黏附和异位成骨的能力。Tao等[20]采用BMP-7相关功能序列SNV和KPS改装RADA16-Ⅰ所合成的水凝胶材料是一种较好的髓核组织工程材料。在课题组前期研究中,我们已经将在细胞粘附过程中起重要作用的DGEA序列同RADA16-Ⅰ多肽C末端相接,成功地构建了自组装多肽纳米水凝胶支架材料DGEAmx[21],提高了细胞的粘附性。在成骨修复过程中,研究者更关注如何诱导细胞成骨分化。
PTHrP基因编码翻译后加工主要产生3个具有很高活性的氨基酸末端PTHrP(1~36)PTHrP(38~94)以及PTHrP(107~139)[22],能通过调节成骨细胞作用,在新骨形成和骨塑形过程中起到重要调节作用[23]。Osteostatin是PTHrP C末端结构域PTHrP(107~111)五肽片段,能够介导PTH/PTHrP受体非相关性受体,在体外促进成骨细胞生长和分化[24]。
本研究中,我们通过肽固相合成法在RADA16-Ⅰ的C端与PTHrP(107~111)五肽连接得到RADA16-TRSAW,并将其与RADA16-Ⅰ等体积混合得到TRSAWmx混合液,创新设计并构建出兼顾粘附和促成骨相关性能的自组装多肽纳米水凝胶TRSAWmx。TRSAWmx水凝胶纤维直径大于RADA16-Ⅰ水凝胶纤维(P<0.05),但其仍具有纳米级的直径,能自组装成长的纳米纤维。TRSAWmx的细胞粘附能力较RADA16-Ⅰ无明显差异,说明功能片段的加入不影响细胞在水凝胶上的粘附。细胞在TRSAWmx水凝胶上培养有着更佳的生长活力和骨诱导分化性能。以上实验结果表明,自组装水凝胶TRSAWmx促进MC3T3-E1细胞粘附、增殖和分化效果优于单纯的自组装水凝胶RADA16-Ⅰ。
本研究初步证明,通过将RADA16-Ⅰ的C末端与PTHrP(107~111)氨基酸活性末端相接,构建的新型自组装纳米水凝胶TRSAWmx在体外能够兼顾细胞粘附和促成骨相关性能。这为后期可与脱钙骨基质、羟基磷灰石等相复合,进一步研究复合后材料的体内相关生物学性,以及进一步运用于临床个体化治疗[24]奠定了良好理论基础。
| [1] | 秦蕴豪, 张长青. 间充质干细胞促进骨再生的生物学基础及应用[J]. 中华创伤骨科杂志, 2014, 16(6): 533-536. DOI: 10.3760/cma.j.issn.1671-7600.2014.06 .016 |
| [2] | Zhang S, Holmes T, Lockshin C, et al. Spontaneous assembly of a self-complementary oligopeptide to form a stable macroscopic membrane[J]. Proc Natl Acad Sci U S A, 1993, 90(8): 3334-3338. |
| [3] | Holmes T C, de-Lacalle S, Su X, et al. Extensive neurite outgrowth and active synapse formation on self-assembling peptide scaffolds[J]. Proc Natl Acad Sci U S A, 2000, 97(12): 6728-6733. |
| [4] | Zhang S. Fabrication of novel biomaterials through molecular self-assembly[J]. Nat Biotechnol, 2003, 21(10): 1171-1178. DOI: 10.1038/nbt874 |
| [5] | 李志强, 侯天勇, 罗飞, 等. 自组装肽复合脱钙骨基质作为骨髓富集支架材料的实验研究[J]. 第三军医大学学报, 2011, 33(5): 441-444. DOI:10.16016/j.1000-5404.2011.05.032 |
| [6] | Lozano D, Manzano M, Doadrio J C, et al. Osteostatin-loaded bioceramics stimulate osteoblastic growth and differentiation[J]. Acta Biomater, 2010, 6(3): 797-803. DOI: 10.1016/j.actbio.2009.08.033 |
| [7] | Manzano M, Lozano D, Arcos D, et al. Comparison of the osteoblastic activity conferred on Si-doped hydroxyapatite scaffolds by different osteostatin coatings[J]. Acta Biomater, 2011, 7(10): 3555-3562. DOI:10.1016/j.actbio.2011.06.004 |
| [8] | Stern P H, Alvares K. Antitumor agent cabozantinib decreases RANKL expression in osteoblastic cells and inhibits osteoclastogenesis and PTHrP-stimulated bone resorption[J]. J Cell Biochem, 2014, 115(11): 2033-2038. DOI: 10. 1002/jcb.24879 |
| [9] | Trejo C G, Lozano D, Manzano M, et al. The osteoinductive properties of mesoporous silicate coated with osteostatin in a rabbit femur cavity defect model[J]. Biomaterials, 2010, 31(33): 8564-8573. DOI:10.1016/j.biomaterials.2010.07.103 |
| [10] | Lozano D, Trejo C G, Gomez-Barrena E, et al. Osteostatin-loaded onto mesoporous ceramics improves the early phase of bone regeneration in a rabbit osteopenia model. [J]Acta Biomater, 2012, 8(6): 2317-2323. DOI:10.1016/j.actbio. 2012.03.014 |
| [11] | Eskandari S, Stephenson R J, Fuaad A A, et al. Synthesis and characterisation of self-assembled and self-adjuvanting asymmetric multi-epitope lipopeptides of ovalbumin. [J]Chemistry, 2015, 21(3): 1251-1261. DOI: 10.1002/chem.201404997 |
| [12] | Weinand C, Pomerantseva I, Neville C M, et al. Hydrogel-beta-TCP scaffolds and stem cells for tissue engineering bone[J]. Bone, 2006, 38(4): 555-563. DOI: 10.1016/j.bone.2005.10.016 |
| [13] | Mi K, Wang G, Liu Z, et al. Influence of a self-assembling peptide, RADA16, compared with collagen Ⅰ and Matrigel on the malignant phenotype of human breast-cancer cells in 3D cultures and in vivo[J]. Macromol Biosci, 2009, 9(5): 437-443. DOI:10.1002/mabi.200800262 |
| [14] | Tang C, Shao X, Sun B, et al. The effect of self-assembling peptide RADA16-Ⅰ on the growth of human leukemia cells in vitro and in nude mice[J]. Int J Mol Sci, 2009, 10(5): 2136-2145. DOI:10.3390/ijms10052136 |
| [15] | Hamada K, Hirose M, Yamashita T, et al. Spatial distribution of mineralized bone matrix produced by marrow mesenchymal stem cells in self-assembling peptide hydrogel scaffold[J]. J Biomed Mater Res A, 2008, 84(1): 128-136. DOI:10.1002/jbm.a.31439 |
| [16] | Kuo S M, Tsai S W, Huang L H, et al. Plasma-modified nylon meshes as supports for cell culturing[J]. Artif Cells Blood Substit Immobil Biotechnol, 1997, 25(6): 551-562. |
| [17] | Wang J, Zheng J, Zheng Q, et al. FGL-functionalized self-assembling nanofiber hydrogel as a scaffold for spinal cord-derived neural stem cells[J]. Mater Sci Eng C Mater Biol Appl, 2015, 46: 140-147. DOI:10.1016/j.msec.2014.10.019 |
| [18] | Tao H, Zhang Y, Wang C F, et al. Biological evaluation of human degenerated nucleus pulposus cells in functionalized self-assembling peptide nanofiber hydrogel scaffold[J]. Tissue Eng Part A, 2014, 20(11/12): 1621-1631. DOI: 10.1089/ten.TEA.2013.0279 |
| [19] | Pan H, Hao S, Zheng Q, et al. Bone induction by biomimetic PLGA copolymer loaded with a novel synthetic RADA16-P24 peptide in vivo[J]. Mater Sci Eng C Mater Biol Appl, 2013, 33(6): 3336-3345. DOI:10.1016/j.msec.2013.04.019 |
| [20] | Tao H, Wu Y, Li H, et al. BMP7-Based Functionalized Self-Assembling Peptides for Nucleus Pulposus Tissue Engineering[J]. ACS Appl Mater Interfaces, 2015, 7(31): 17076-17087. DOI:10.1021/acsami.5b03605 |
| [21] | 刘健, 侯天勇, 李志强, 等. 功能化自组装多肽水凝胶支架促进小鼠骨髓间充质干细胞的粘附、增殖及成骨[J]. 第三军医大学学报, 2015, 37(10): 945-951. DOI: 10.16016/ j.1000-5404.201412261 |
| [22] | Casado-Diaz A, Santiago-Mora R, Quesada J M. The N- and C-terminal domains of parathyroid hormone-related protein affect differently the osteogenic and adipogenic potential of human mesenchymal stem cells[J]. Exp Mol Med, 2010, 42(2): 87-98. DOI:10.3858/emm.2010.42.2.010 |
| [23] | Lozano D, Feito M J, Portal-Nunez S, et al. Osteostatin improves the osteogenic activity of fibroblast growth factor-2 immobilized in Si-doped hydroxyapatite in osteoblastic cells[J]. Acta Biomater, 2012, 8(7): 2770-2777. DOI:10.1016/ j.actbio.2012.04.002 |
| [24] | 吴治林, 侯天勇, 刘杰, 等. 个体化组织工程骨与同种异体骨修复骨纤维异常增殖症术后骨缺损的对比研究[J]. 第三军医大学学报, 2014, 36(9): 945-949.DOI:10.16016/j.1000-5404.2014.09.035 |



