2. 400067 重庆,重庆工商大学环境与生物工程学院应用化学系
2. Department of Applied Chemistry, College of Environment and Biology, Chongqing Technology and Business University, Chongqing, 400067, China
脑甾醇(cerebrosterol)主要以微量存在于人[1]和动物脑中[2-3]。由于胆固醇不能突破血脑屏障,大脑中的胆固醇只能在大脑合成。脑甾醇是脑内唯一能突破血-脑屏障而进入血液循环系统的氧化胆固醇,不仅对大脑内保持胆固醇的内环境平衡有重要意义,而且脑甾醇在血液中含量的高低与年龄、发育状况和神经退行性疾病有密切关系[4],如老年痴呆[5-6]、帕金森综合征[7]和亨廷顿舞蹈病[8]等。除此之外,脑甾醇可以作为在血液中检测到的能表征大脑发育及病变的器官特异性生物标记物[9]。控制脑甾醇在血液中的含量,对于预防神经退行疾病具有重要意义[10]。
脑甾醇是LXRs 受体的激动剂。动物中LXR基因敲除导致伴随脂质在神经元、星形胶质细胞和脑膜积累的年龄相关性神经退行性病变[11-12]。LXR缺损的老鼠被发现出现动脉粥样硬化、糖尿病、生殖障碍以及癌症、神经退行性疾病[13]和青光眼[14]。因此,LXRs受体成为治疗动脉粥样硬化、糖尿病、男性和女性的生殖障碍、癌症、神经退行性疾病[14]和胆结石等疾病[15]新药的分子靶。
1975年,Koizumi等[16]从已知构型的24S,25-环氧胆固醇苯甲酸酯经锂铝氢还原合成脑甾醇,确定了脑甾醇24S-羟基的绝对构型。大豆固醇为原料,Patrick等[17]以非天然的D-缬氨酸为手性源、Moriarty等[18]以天然的L-构型缬氨酸为手性源合成脑甾醇(总收率分别为37%、42%)。但需降解大豆固醇侧链,而未充分利用其侧链,不符合原子经济性。随后,开展了以胆烷酸及其衍生物为原料,以手性试剂的不对称合成脑甾醇的研究。Koizumi等[19]以△5-3β-羟基胆烷酸为原料,用手性Noyori试剂立体选择性合成脑甾醇(总收率37%、94%de)。Okamota等[20]以△5-3β-乙酰氧基-胆烷-24-醛作底物,以(+)-DBNE[(+)-N,N-二丁基胺-1-苯基丙烷-1-醇]作手性配体,与2.2当量异丙基锌反应,以得3β-乙酰脑甾醇(收率63%,87%de),其立体选择性不高。在研究脑甾醇的高效不对称合成方法中,我们曾用3,6-二甲氧基甲基猪去氧胆酸为原料以(DHQ)2PHAL为配体Sharpless双羟化反应为关键步骤[21]和以1,2-O-异丙基-5-去氧-5-吗啉基-α-D-呋喃木糖为配体,二异丙基锌试剂加成[22]两种方法合成脑甾醇(总收率40%,99%de;总收率53%,99.9%de)。尽管立体选择性高,但是大部分中间体为油状物不能用重结晶纯化,或用到易燃易爆手性锌试剂,不利于大量合成。
本研究报道新的合成方法以立体选择性合成脑甾醇,旨在为其生物医学研究和药学研究奠定物质基础。
1 材料与方法 1.1 主要试剂与仪器所有反应以薄层层析跟踪,使用烟台市芝罘黄务硅胶开发试验厂生产的高效薄层层析硅胶板(HF256),磷钼酸、钼酸铵高锰酸钾或碘显色。快速层析用烟台市芝罘黄务硅胶开发试验厂生产的层析硅胶(硅胶H,10~40 μm),层析用石油醚均为60~90 ℃。四氢呋喃均在氮气保护下以钠和二苯甲酮回流至蓝色蒸出待用。吡啶、二氯甲烷以氢化钙回流数小时后蒸出待用。化合物熔点用Buch 535熔点仪测定,所有熔点均未校正。所有波谱分析在中科院上海有机化学研究所测定。所有化合物旋光值由Perkin-Elmer241MC旋光仪测定。红外光谱由Shimadzu-440红外光谱仪测定,固体样品用KBr压片测定。1HNMR和13CNMR由Bruker AM300 (300 MHz)型核磁共振仪测定,四甲基硅烷(TMS)作内标,未经特别说明,均用氘代氯仿(CDCl3)作溶剂,化学位移δ值单位为ppm。质谱由HP5890A型质谱仪测定。元素分析由中科院上海有机化学研究所分析测试中心以ELEMENT ANALYZER-MOD.1106仪测定。
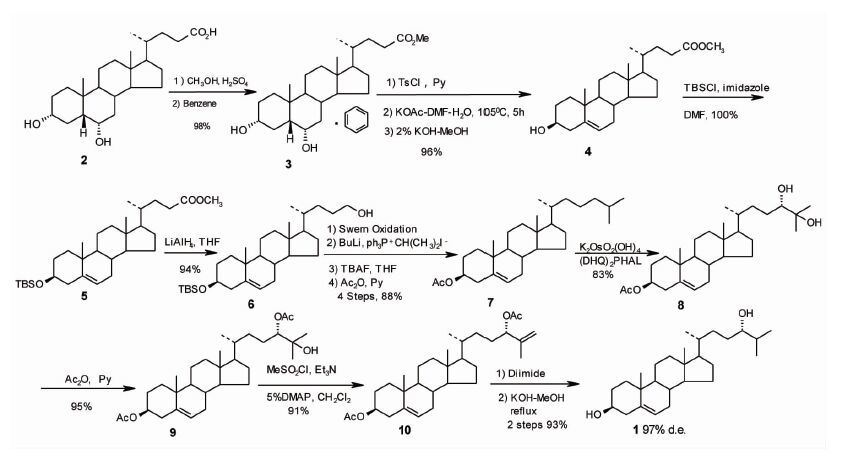
1.2 合成路线见图 1。
|
| 9步反应,总收率52%,立体选择性97% de 图 1 猪去氧胆酸合成脑甾醇路线 |
1.2.1 猪去氧胆酸甲酯-苯复合物(3)的合成
将100 g(245.9 mmol)猪去氧胆酸(2)置于500 mL蛋型瓶中,加入300 mL甲醇溶解后,滴加4 mL浓硫酸,回流4 h,TLC监测。至原料消失后,加入碳酸氢钠中和至中性,过滤,滤液减压蒸馏除去甲醇溶剂后得淡黄色油状液体,加入300 mL苯,加热蒸馏至馏分澄清透明,停止回流,冷却结晶,析出大量白色固体,减压过滤,用冷的苯和石油醚(1 ∶1)溶剂洗涤2~3次,得猪去氧胆酸甲酯-苯复合物无色颗粒晶体121 g,收率98%。
1.2.2 △5-3β-羟基胆烷酸甲酯(4)的合成12.858 g(37.67 mmol)猪去氧胆酸甲酯-苯复合物(3)溶于28 mL干吡啶中,冷至0 ℃,分批加入14.281 g(75 mmol) 对甲苯磺酰氯。逐渐升温至室温,静置1 d,有大量固体析出。将混合物倾入加有碎冰块的10%HCl溶液中,剧烈搅拌30 min,过滤,用大量水洗至中性,烘干。粗品经乙酸乙酯重结晶后得针状晶体22.20 g。
250 mL蛋形瓶中,加入14.6 g(149 mmol)醋酸钾,7.0 mL水和80 mL DMF,加热至105 ℃,加入10 g(14 mmol)原料,保温5 h,冷至室温。有大量沉淀析出,倾入500 mL含碎冰块的5%HCl溶液中,有大量白色沉淀析出。减压过滤,用水洗至中性,烘干得粗品5.538 g。取3.027 g上述粗品溶于30 mL 2% KOH- MeOH,室温搅拌2 h,倾入300 mL含碎冰的10%HCl溶液中,有大量沉淀析出,用水洗至中性,烘干重3.120 g,重结晶得化合物(4)2.853 g。两步收率96%。
1.2.3 △5-3β-(二甲基-叔丁基硅基)-3β-羟基胆烷酸甲酯(5)的合成100 mL干燥蛋形瓶中,加入13.375 g (34.47 mmol)原料,溶于40 mL DMF中,加入6.235 g(41.37 mmol)叔丁基二甲基氯硅烷和5.867 g(86.18 mmol)咪唑,室温搅拌过夜。用100 mL乙酸乙酯溶解,5×100 mL饱和NaHCO3和3×50 mL饱和NaCl洗至中性,无水NaSO4干燥,除去溶剂得粒状晶体17.305 g。收率定量。
1.2.4 △5-3β-(二甲基-叔丁基硅基)-3β,24-二羟基胆烷醇(6)的合成100 mL干燥蛋形瓶中,装上滴液漏斗,真空火焰干燥,氩气保护下冷至室温,加入1.960 g(51.58 mmol)LiAlH4和40 mL THF。滴加含17.305 g(34.47 mmol)原料的THF溶液20 mL。2 h后,TLC表明原料消失,加入Na2SO4·10H2O,有气体产生,搅拌2 h后,硅藻土过滤。3×20 mL乙酸乙酯洗涤,除去溶剂得针状晶体15.832 g,粗品Pet:EtOAc重结晶后得化合物(6)针状晶体15.321 g,收率94%。
1.2.5 乙酰链甾醇(7)的合成200 mL蛋形瓶中,装上滴液漏斗,真空火焰干燥,氩气保护下冷至室温,加入50 mL干燥的CH2Cl2,冷至-78 ℃,滴加2.52 mL (28.90 mmol)草酰氯,搅拌均匀后,滴加4.1 mL (57.80 mmol)DMSO,有气泡产生,搅拌20 min后,滴 加含原料11.415 g (24.08 mmol)的CH2Cl2 溶液30 mL,搅拌25 min后,加入30 mL乙酸乙酯,搅拌30 min后,升至室温,3×100 mL饱和NH4Cl溶液,3×100 mL半饱和NaCl溶液,3×100 mL饱和NaCl溶液洗涤,无水Na2SO4干燥后除去溶剂得粗品11.118 g。
250 mL蛋形瓶中,真空火焰干燥,氩气保护下,冷至室温,迅速加入20.352 g(47.116 8 mmol) Ph3PCH(CH3)2I,加入60 mL THF,滴加29.45 mL 1.6 mol/L (47.12 mmol)的丁基锂。室温搅拌1 h。加入含11.118 g(23.555 mmol)原料的THF溶液70 mL,室温搅拌2 h。滴加100 mL饱和NH4Cl溶液,有大量沉淀析出。加入100 mL乙酸乙酯,5×150 mL H2O,3×150 mL 5%HCl,3×100 mL饱和NaHCO3,3×150 mL饱和NaCl洗涤,无水Na2SO4干燥。除去溶剂得粗品12.500 g。
250 mL蛋形瓶中,真空火焰干燥,氩气保护下,冷至室温,迅速加入上述粗品原料12.500 g(23.555 mmol),抽气,通氩气,加入80 mL THF和28.27 mL 1 mol/L(28.27 mmol)的TBAF-THF溶液。室温搅拌2 h。加入80 mL乙酸乙酯,用3×100 mL饱和NaHCO3,3×100 mL饱和NaCl洗涤,无水Na2SO4干燥,除去溶剂得粗品11.700 g。
250 mL蛋形瓶中,加入11.700 g上述粗品,用75 mL 醋酐和75 mL吡啶溶解,静置过夜。加入50 mL乙酸乙酯,用大量水洗涤,3×50 mL 10%HCl,3×50 mL饱和NaHCO3,3×50 mL饱和NaCl洗涤,无水Na2SO4干燥,除去溶剂得粗品11.500 g。快速柱层析得(7)8.825 g,四步收率88%。
1.2.6 △5-3β-乙酰基-3β,24S,25-三羟基胆甾二醇(8)的合成100 mL蛋形瓶中,加入3.257 g(9.87 mmol)铁氰化钾,1.362 g碳酸钾(9.87 mmol),313 mg CH3SO2NH2,128 mg(5%mol)(DHQ)2PHAL,12 mg (1%mol) K2OsO2(OH)4,和33 mL叔丁醇和水(1 ∶1)的混合溶液,搅拌溶解至均匀黄绿色溶液,加入1.4 g原料,搅拌20 h,有大量沉淀析出,冷至0 ℃,加入4.93 g亚硫 酸钠搅拌1 h,3×25 mL乙酸乙酯萃取,分别用3×75 mL 2N KOH,10%盐酸,饱和碳酸氢钠和饱和食盐水洗至中性,无水硫酸钠干燥,除去溶剂得粗品1.553 g。快速柱层析得化合物(11)1.258 g,收率83%。
1.2.7 △5-3β,24S-二乙酰基-3β,24S,25-三羟基胆甾醇(9)的合成25 mL蛋形瓶中,加入336 mg 原料,4 mL醋酐,4 mL吡啶,室温搅拌9 h至原料消失,加入50 mL 乙酸乙酯,分别用5×75 mL 水、5%盐酸溶液、饱和碳酸氢钠溶液和饱和食盐水洗涤至中性,无水硫酸钠干燥,浓缩得粗品405 mg,快速柱层析得化合物(12)378 mg,收率95%。
1.2.8 △5,25-3β,24S-二乙酰氧基胆甾二烯(10)的合成10 mL蛋形瓶中,真空火焰干燥,氩气保护下冷至室温,快速加入110 mg原料,1.075 mg(5%mol)DMAP,抽气,氩气保护下加入2 mL CH2Cl2 和0.09 mL 三乙胺,冷至0℃,搅拌10 min,滴加0.0256 mL (0.33 mmol)MeSO2Cl,有沉淀析出,2 h后,加入20 mL 乙酸乙酯,分别用3×20 mL 水和饱和食盐水洗涤。无水硫酸钠干燥,浓缩得粗品115 mg,快速柱层析得化合物(10)64 mg,回收原料37 mg,收率91%。
1.2.9 脑甾醇(1)(24S-羟基胆固醇)的合成25 mL 蛋形瓶中,加入3.59 g盐酸羟氨和10 mL DMF,冰浴冷却下加入3.41 g 85%KOH,搅拌30 min过滤。用2~3 mL DMF 洗涤,滤液冷至0 ℃,滴加2.22 mL乙酸乙酯,搅拌30 min。20 min内于90~95 ℃下滴加上述滤液于含原料35 mg的50 mL蛋形瓶中,保温5 h。停止反应,冷至室温,加入15 mL水,3×15 mL乙酸乙酯提取,3×50 mL水,3×50 mL 5%HCl,3×50 mL饱和NaHCO3,3×50 mL饱和食盐水洗涤,无水Na2SO4干燥,得粗品40 mg。粗品用5 mL MeOH溶解,加水0.5 mL,30 mg KOH 回流5 h。减压除去甲醇,10 mL乙酸乙酯溶解,3×10 mL水洗,3×10mL饱和NaCl洗至中性。无水Na2SO4干燥。后除去溶剂,快速柱层析得脑甾醇(1)26 mg ,收率93%,97%de(HPLC)。
2 结果 2.1 猪去氧胆酸甲酯-苯复合物(3)mp:122~124 ℃。
2.2 △5-3β-羟基胆烷酸甲酯(4)mp:143~144 ℃,与标准品混合熔点不降。
2.3 △5-3β-(二甲基-叔丁基硅基)-3β-羟基胆烷酸甲酯(5)mp:138~140 ℃,与标准品混合熔点不降。
2.4 △5-3β-(二甲基-叔丁基硅基)-3β,24-二羟基胆烷醇(6)mp:173~174 ℃,与标准品混合熔点不降。
2.5 乙酰链甾醇(7)mp:90~91 ℃,与标准品混合熔点不降。
2.6 △5-3β-乙酰基-3β,24S,25-三羟基胆甾二醇(8)mp:135~136℃;[α]D23-27.16°(C,0.928,CHCl3);MS-EI(m/z): 400(M-HOAc),382(M-HOAc-H2O);IR(film)cm-1: 3445(OH),1735(CH3CO2),1469,1376,1248,1035;1HNMR(300 MHz,CDCl3)δppm: 0.68(3H,s,18-H3),0.94(3H,d,J=6.54Hz,21-H3),1.02(3H,s,19-H3),1.18(3H,s,26-H3),1.22(3H,s,27-H3),2.04 (3H,s,CH3CO2),2.32(2H,d,J=8.23Hz,7-H2),3.28(1H,m,24β-H),4.61(1H,m,3α-H),5.38(1H,d,J=4.73,6-H);元素分析 (C29H48O4·1/4 H2O): 计算值:C,74.88%; H,10.51%;实测值:C,75.08%; H,10.70%。
2.7 △5-3β,24S-二乙酰基-3β,24S,25-三羟基胆甾醇(9)mp:175~176℃;[α]D22.5-31.13°(C,0.469,CHCl3);MS-EI(m/z):485(M+1- H2O),442(M-CH3COOH),425(M+1-CH3COOH-H2O);IR(film)cm-1: 3470(OH),2970,2938,2866,1734 (CH3CO2),1713 (CH3CO2),1438,1376,1246,1038;1HNMR(300 MHz,CDCl3)δppm: 0.67(3H,s,18-H3),0.93(3H,d,J=6.46Hz,21-H3) 1.02(3H,s,19-H3),1.198(3H,s,26-H3),1.204 (3H,s,27-H3),2.03(3H,s,3β-CH3CO2),2.11(3H,s,24α-CH3CO2),4.60(3β-H),4.72和4.76(1H,d,d,J1=2.42Hz,J2=10.145Hz,24β-H),5.37(1H,d,J=4.8Hz,6-H);元素分析(C31H50O5): 计算值:C,74.06%; H,10.02%;实测值:C,74.14%; H,10.06%。
2.8 △5,25-3β,24S-二乙酰氧基胆甾二烯(10)mp:95~96 ℃;[α]D24-43.3°(C,0.127,CHCl3);MS-EI(m/z): 424(M-CH3COOH),364(M-2CH3COOH),349(M+1-2CH3COOH-H2O);IR(KBr)cm-1: 3080 (C=CH2),2943,2889,1733(CH3CO2),1654(C=CH2),1374,1263,1239,904 (C=CH2);1HNMR(300MHz,CDCl3)δppm:0.67(3H,s,18-H3),0.93(3H,d,J=6.52Hz,21-H3),1.02(3H,s,19-H3),1.72(3H,s,27-H3),2.03(3H,s,3β-CH3CO2),2.06(3H,s,24β-CH3CO2),4.60(1H,m,3α-H),4.89(1H,t,J=1.42Hz,26-H),4.94(1H,s,26-H),5.12(1H,t,J=6.83Hz,24β-H),5.38(1H,d,J=4.86Hz,6-H);元素分析(C31H48O4):计算值:C,76.82%; H,9.98%;实测值:C,76.74%,H,10.01%。
2.9 脑甾醇(1)(24S-羟基胆固醇)mp:181.1~181.9℃;[α]D24-49.47°(C,0.028,CHCl3) ;MS-EI(m/e):402(M),384(M-H2O),369(M-H2O-Me),351(M-2H2O-Me);IR(cm-1):3369,2939,2869,1466,1377,1054;1HNMR(300 MHz,CHCl3)δppm:0.68(3H,S,18-CH3),0.89(3H,d,J=6.82Hz,21-CH3),1.01(3H,s,19-CH3),3.30(1H,m,24-H),3.53(1H,m,3α-H),5.35(1H,d,J=5.12Hz,6-H);13CNMR(300 MHz,CHCl3)δppm:140.848 (5-C),121.791(6-C),77.524(24S-C),77.302(24R-C),71.895(3-C),56.829 (14-C),56.021(17-C),50.199(9-C),42.422(13-C),42.393(4-C),39.857(12-C),37.342(1-C),36.590(10-C),36.030(20-C),33.234(25-C),32.292(22-C),2.145(2-C),31.989(8-C),31.761(7-C),30.807(23-C),28.296(16-C),24.374(15-C),21.169 (11-C),19.488 (19-C),19.156(21-C),18.906(27-C),16.787(26-C),11.968 (18-C);元素分析(C27H46O2·1/2 H2O):计算值:C,78.78%,H,11.5%;实测值:C,78.58%,H,11.67%;97%de (HPLC用 Inersil ODS-3柱,82% CH3CN-H2O 作洗脱液)。
3 讨论本研究合成脑甾醇的合成策略如图 1所示。我们曾在24S,25-环氧胆固醇的立体选择性合成中建立了从猪去氧胆酸合成关键中间体乙酰链甾醇的合成方法[23],现对此方法进一步改进和优化,规模量合成乙酰链甾醇。由于猪去氧胆酸甲酯为油状物,不易结晶,而形成猪去氧胆酸甲酯-苯复合物后易结晶纯化。猪去氧胆酸甲酯-苯复合物(3)溶于吡啶中,加入对甲苯磺酰氯,静置过夜,后处理后重结晶得3α,6α-二对甲苯磺酸酯猪去氧胆酸甲酯,3α,6α-二对甲苯磺酸酯猪去氧胆酸甲酯于105 ℃下,在DMF-H2O溶液中,与KOAc反应,两步一锅以96%收率得A,B-环构建产物△5-3β-羟基胆烷酸甲酯(4)。△5-3β-羟基胆烷酸甲酯(4)经二甲基叔丁基氯硅烷保护3β-位羟基定量得化合物(5)。(5)用锂铝氢还原以94%的收率得24-羟基化合物(6)。(6)用经Swern氧化后处理后得24-醛化合物粗品。24-醛化合物粗品与异丙基Wittig试剂反应后处理后得侧链构建产物△24-化合物粗品。△24-化合物粗品经四丁基氟化铵(TBAF)脱二甲基叔丁基氯硅基(TBS)保护后处理得链甾醇粗品。链甾醇粗品经乙酰化后处理,经快速柱层析纯化四步一锅以88% 的收率得关键中间体乙酰链甾醇(7),合成规模达10 g 以上。至此,我们从猪去氧胆酸出发,用6步反应,以78%的高收率合成乙酰链甾醇(7)。乙酰链甾醇(7)是昂贵的甾体重要中间体和生物活性物质。通过本合成方法可以以乙酰链甾醇(7)为原料,通过结构修饰引入各种官能团,合成大量的氧化胆固醇[23]和氧化链甾醇类似物,为建立结构多样化的LXRs配体库的合成和发现新的LXRs激动剂打下了物质基础。
获得关键中间体后,合成目标分子的关键步骤是对乙酰链甾醇(7)进行Sharpless不对称双羟化反应,以构建侧链24S-羟基手性结构后合成目标分子脑甾醇。通过对△24-甾体化合物的Sharpless 不对称双羟化反应的系统研究[24],以(DHQ)2PHAL为手性配体,对乙酰链甾醇(7)进行不对称双经化反应。3 mol铁氰化钾,3 mol碳酸钾,1 mol CH3SO2NH2,5% mol(DHQ)2PHAL,1% mol K2OsO2(OH)4和1.4~2倍标准Sharpless不对称双羟化反应体积的叔丁醇和水(1 ∶1)的混合溶液,于0 ℃下加入乙酰链甾醇(7),反应20 h,后处理后快速柱层析得预期24S,25-双羟化产物化合物(8),收率83%,立体选择性为98.6%de,优于文献[25]报道的88%de。(8)在醋酐-吡啶中选择性乙酰化以95%收率得24S-乙酰氧基化合物(9),(9)在甲磺酰氯-三乙胺和5%DMAP作用下脱水,以91%收率得Δ5,25-化合物(10),(10)经二酰亚胺还原反应,粗品在氢氧化钾-甲醇中回流,后处理后,快速柱层析分离,两步一锅以93%的收率、97%de立体选择性得目标分子脑甾醇(1),mp:181.1~181.9 ℃(文献[1]报道为175~176 ℃);[α]D24-49.47°(C,0.028,CHCl3)(文献[1]报道为[α]D-48.3 ℃ HCl3);质谱显示质荷比为402的分子离子峰;红外光谱显示波数为3 369 cm-1的羟基峰;核磁共振氢谱显示化学位移为3.30 ppm的含1个24质子多重峰;核磁共振碳谱显示化学位移为77.524 ppm的较(77.302 ppm的24R-羟基碳)为低场的24S-羟基构型的碳峰。并采用元素分析证实其结构。
本法采用猪去氧胆酸(2)为原料,以乙酰链甾醇(7)为关键中间体,以改良的Sharpless不对称双羟化反应为关键步骤,经9步反应高立体选择性合成脑甾醇,总收率为52%,立体选择性为97%de。本路线的特点是原料易得,具有原子经济性,各步反应条件温和,易于控制,各步所得化合物均为固体,易于重结晶纯化和放大。无论总收率和立体选择性,均优于以前报道[19-22]。此合成路线的建立,为脑甾醇的生物医学和药学研究奠定了物质基础,并为以胆固醇骨架为基础的结构多样化氧化甾醇类似物的设计合成打下了方法学基础。
| [1] | Ercoli A, de-Ruggieri P. The constitution of cerebrosterol, a hydroxycholesterol isolated from horse brain[J]. J Am Chem Soc,1953, 75 (13) : 3284 . DOI:10.1021/ja01109a515 |
| [2] | Di-Frisco S, De-Ruggieri P, Ercoli A. Isolation of cerebrosterol from human brain[J]. Boll Soc Ital Biol Sper,1953, 29 (7) : 1351 –1352. |
| [3] | Dhar A K, Teng J I, Smith L L. Biosynthesis of cholest-5-ene-3beta, 24-diol (cerebrosterol) by bovine cerebral cortical microsomes[J]. J Neurochem,1973, 21 (1) : 51 –60. DOI:10.1111/j.1471-4159.1973.tb04224.x |
| [4] | Bjorkhem I, Cedazo-Minguez A, Leoni V, et al. Oxysterols and neurodegenerative diseases[J]. Mol Aspects Med,2009, 30 (3) : 171 –179. DOI:10.1016/j.mam.2009.02.001 |
| [5] | Gosselet F, Saint-Pol J, Fenart L. Effects of oxysterols on the blood-brain barrier: implications for Alzheimer’s disease[J]. Biochem Biophys Res Commun,2014, 446 (3) : 687 –691. DOI:10.1016/j.bbrc.2013.11.059 |
| [6] | Schonknecht P, Lutjohann D, Pantel J, et al. Cerebrospinal fluid 24S-hydroxycholesterol is increased in patients with Alzheimer’s disease compared to healthy controls[J]. Neurosci Lett,2002, 324 (1) : 83 –85. DOI:10.1016/S0304-3940(02)00164-7 |
| [7] | Bjorkhem I, Lovgren-Sandblom A, Leoni V, et al. Oxysterols and Parkinson's disease: evidence that levels of 24S-hydroxycholesterol in cerebrospinal fluid correlates with the duration of the disease[J]. Neurosci Lett,2013, 555 : 102 –105. DOI:10.1016/j.neulet.2013.09.003 |
| [8] | Leoni V, Long J D, Mills J A, et al. Plasma 24S-hydroxycholesterol correlation with markers of Huntington disease progression[J]. Neurobiol Dis,2013, 55 : 37 –43. DOI:10.1016/j.nbd.2013.03.013 |
| [9] | Leoni V, Caccia C. 24S-hydroxycholesterol in plasma: a marker of cholesterol turnover in neurodegenerative diseases[J]. Biochimie,2013, 95 (3) : 595 –612. DOI:10.1016/j.biochi.2012.09.025 |
| [10] | Noguchi N, Saito Y, Urano Y. Diverse functions of 24(S)-hydroxycholesterol in the brain[J]. Biochem Biophys Res Commun,2014, 446 (3) : 692 –696. DOI:10.1016/j.bbrc.2014.02.010 |
| [11] | Noguchi N, Urano Y, Takabe W, et al. New aspects of 24(S)-hydroxycholesterol in modulating neuronal cell death[J]. Free Radic Biol Med,2015, 87 : 366 –372. DOI:10.1016/j.freeradbiomed.2015.06.036 |
| [12] | Sodhi R K, Singh N. Liver X receptors: emerging therapeutic targets for Alzheimer’s disease[J]. Pharmacol Res,2013, 72 : 45 –51. DOI:10.1016/j.phrs.2013.03.008 |
| [13] | Viennois E, Pommier A J, Mouzat K, et al. Targeting liver X receptors in human health: deadlock or promising trail?[J]. Expert Opin Ther Targets,2011, 15 (2) : 219 –232. DOI:10.1517/14728222.2011.547853 |
| [14] | Fourgeux C, Bron A, Acar N, et al. 24S-hydroxycholesterol and cholesterol-24S-hydroxylase (CYP46A1) in the retina: from cholesterol homeostasis to pathophysiology of glaucoma[J]. Chem Phys Lipids,2011, 164 (6) : 496 –499. DOI:10.1016/j.chemphyslip.2011.04.006 |
| [15] | Castro-Torres I G, de-Jesus-Cardenas-Vazquez R, Velazquez-Gonzalez C, et al. Future therapeutic targets for the treatment and prevention of cholesterol gallstones[J]. Eur J Pharmacol,2015, 765 : 366 –374. DOI:10.1016/j.ejphar.2015.08.045 |
| [16] | Koizumi N, Morisaki M, Ikekawa N, et al. Absolute configurations of 24-hydroxycholesterol and related compounds[J]. Tetrahedron Letters,1975, 16 (26) : 2203 –2206. DOI:10.1016/S0040-4039(00)72677-3 |
| [17] | Patrick K, Yoichi N, Bang L, et al. A stereoselective synthesis and a convenient synthesis of optically pure (24R)- and (24S)-24-hydroxycholesterols[J]. Bull Soc Chim Fr,1983 (Ⅱ) : 189 –194. |
| [18] | Moriarty R M, Enache L A, Kinney W A, et al. Stereoselective synthesis of squalamine dessulfate[J]. Tetrahedron Letters,1995, 36 (29) : 5139 –5142. DOI:10.1016/0040-4039(95)01011-6 |
| [19] | Koizumi N, Ishiguro M, Yasuda M, et al. Stereoselective introduction of hydroxy groups into the cholesterol side chain. Preparation of (24R)- and (24S)-24, 25-dihydroxy- and (25R)- and (25S)-25, 26-dihydroxyvitamin D3 by asymmetric synthesis[J]. J Chem Soc Perkin Trans I,1983 : 1401 –1410. DOI:10.1039/P19830001401 |
| [20] | Okamoto M, Tabe M, Fujii T, et al. Asymmetric isopropylation of steroidal 24-aldehydes for the synthesis of 24(R)-hydroxycholesterol[J]. Tetrahedron: Asymmetry,1995, 6 (3) : 767 –778. DOI:10.1016/0957-4166(95)00073-X |
| [21] | Zhou X D, Zhou W S. A new highly stereoselective synthesis of cerebrosterol, an agonist of the nuclear receptor LXRs[J]. Tetrohedron,2001, 57 (39) : 8291 –8296. DOI:10.1016/S0040-4020(01)00812-2 |
| [22] | Zhang D H, Zhou X D, Zhou W S. A Short and Highly Stereoselective Synthesis of Cerebrosterol[J]. Chin J Chem,2002, 20 (11) : 1145 –1148. DOI:10.1002/cjoc.20020201104 |
| [23] | 周向东, 郑辉, 周维善. 氧化甾醇受体(LXRs)配体的合成[J]. 科学通报,2002, 47 (24) : 1868 –1875. DOI:10.3321/j.issn:0023-074X.2002.24.007 |
| [24] |
周向东, 周维善. 高立体选择性的合成24R, 25-和24S, 25-二羟基甾体化合物: 中国, CN1254716[P]. [2000-05-31]. |
| [25] | Kolb H C, VanNieuwenhze M S, Barry-Sharpless K. Catalytic Asymmetric Dihydroxylation[J]. Chem Rev,1994, 94 : 2483 –2547. DOI:10.1021/cr00032a009 |



