2. 西南医院全军眼科中心,视觉损伤与再生修复重庆市重点实验室
2. Chongqing Key Laboratory of Visual Damage and Regeneration & Restoration,Department of Ophthalmology,Southwest Hospital,Third Military Medical University,Chongqing,400038,China
视网膜色素上皮(retinal pigment epithelial,RPE)细胞是位于视网膜神经层和脉络膜之间的单层细胞,主要参与视循环、形成血-视网膜屏障、分泌营养因子、吞噬感光细胞脱落的外节等[1]。RPE的损伤会导致如视网膜色素变性(retinitis pigmentosa,RP)和年龄相关性黄斑变性(age-related macular degeneration,AMD)等致盲性疾病,这类疾病尚无有效治疗措施。研究发现RPE细胞移植有望替代受损的RPE细胞[2],但RPE细胞的来源仍然是移植的最大瓶颈。
人胚胎干细胞 (human embryonic stem cell,hESC)由于具有无限的自我更新能力,并且能够分化成为体内的任何细胞类型,从而成为了治疗各类疾病的新希望。最近Schwartz等[3-4]报道利用hESC衍生的RPE细胞(hESC-RPE)治疗AMD和Stargart’s患者,证实了hESC-RPE细胞临床移植不仅是安全的,而且能显著改善视功能。但目前采用的是细胞悬液移植方式,使得RPE细胞在视网膜下腔聚集成团,不利于RPE细胞的存活,而且影响RPE细胞间的紧密连接,若在体内不能形成极性单层就不能很好发挥其全部功能,所以如何结合生物材料将RPE细胞形成单层成为了研究的热点。
石墨烯(graphene oxide,GO)是一种新型碳纳米材料,石墨烯薄膜具备独特的化学结构和优异的电学性质,对多种细胞具有很高的亲和性,可支持细胞的黏附、增殖及分化[5]。文献[6-7]报道石墨烯对细胞具有较大的毒性作用。目前尚不清楚石墨烯是否适合于构建组织工程化RPE细胞。为此我们初步探索了氧化 石墨烯对hESC-RPE细胞的毒性作用,并为今后制作石墨烯薄膜用于和RPE细胞复合形成单层结构打基础。
1 材料与方法 1.1 材料细胞来源:人胚胎干细胞株H1由协和医科大学基础医学研究所黄粤教授惠赠。GO来源:中科院高能物理研究所晏亮惠赠。主要试剂和仪器:H1 细胞培养基(steam cell公司),Y-27632(Sigma公司),基质胶Matrigel(BD公司),KSR(Gibco公司),CCK-8试剂盒(日本同仁公司),DCFH-DA(Sigma公司),共聚焦显微镜(Leica公司),酶标仪(Thermo公司),流式细胞仪(BD公司)。
1.2 方法 1.2.1 H1细胞培养与传代H1细胞每天换液,细胞至70%~80%融合后按1∶6比例单细胞传代,细胞悬液加入Y-27632(终浓度10 μmol/L),24 h后换液,以克隆聚集生长。
1.2.2 H1细胞向RPE细胞分化采用自发分化法[8]诱导hESC细胞分化为RPE细胞,具体方法为hESC细胞传代后,使大约1周的时间细胞生长至超级融合;去除BFGF生长因子,在20 d左右色素灶开始出现;继续培养2周,将色素灶单独挑出,移到铺有基质胶的培养皿里;接着培养4周后传代,可以看到清楚的RPE细胞从色素灶单层爬出。
1.2.3 hESC-RPE细胞免疫荧光鉴定将诱导的RPE细胞(P3)接种在细胞玻片上,4%多聚甲醛(PFA)4 ℃固定15 min,PBS漂洗3遍后加入0.25% Triton X-100,室温10 min,封闭液[5%山羊血清、1%牛血清蛋白 (BSA)]室温孵育1 h,吸干封闭液后分别加入一抗Pax6、MITF、Bestrophin、ZO-1(均为Abcam公司) 4 ℃孵育过夜。再加入对应的二抗(Life Technologies公司),37 ℃孵育1 h 后,DAPI 核染色,最后封片,共聚焦显微镜下观察。
1.2.4 hESC-RPE细胞吞噬实验将诱导的RPE细胞(P3)接种在24孔Transwell培养小室培养2周,取出大鼠视网膜剪成梅花状,展平后置于hESC-RPE细胞上方,使视网膜感光外节层直接接触hESC-RPE细胞,共培养48h后,取出视网膜,按上述细胞免疫荧光染色方法,一抗为rodopsin,hESC-RPE细胞轮廓用F-actin染色标记。
1.2.5 hESC-RPE细胞透射电镜观察将诱导的RPE细胞传至3代,用2.5%戊二醛固定后,PBS漂洗2次,30min/次,1%锇酸后固定2 h,PBS漂洗,丙酮梯度脱水,环氧树脂618包埋,半薄切片定位后,超薄切片,铀染,铅染,最后用TECNAI10透射电子显微镜观察。
1.2.6 GO制备及表征检测方法以石墨为原料,利用改进的Hummers法制备氧化石墨[9]。首先,分别取25 mL浓硫和0.500 0 g石墨于烧杯室温搅拌2 h,加入1.500 0 g高锰酸钾粉末,待混匀后37 ℃反应2 h后向反应液中缓慢加入20 mL去离子水搅拌30 min,依次加入50 mL去离子和双氧水(H2O2,30%),待产物由棕色变为亮黄色,离心,用5%的HCl溶液离心洗涤数次后,将沉淀转入透析袋,透析1周除去残留的金属离子和酸,最后得到黑色的氧化石墨溶液。取10 mL 氧化石墨溶液,超声剥离4 h,得到黄棕色的悬浮液,即为氧化石墨烯。最后得到的氧化石墨烯分别做原子力显微镜、紫外-可见吸收以及拉曼光谱测试。
1.2.7 hESC-RPE细胞与GO共培养24h后细胞毒性检测采用CCK-8试剂盒检测细胞活力,具体方法为将RPE细胞接种到96孔板(6×104/孔)中,24 h后用DMEM洗2遍,根据实验设计加入浓度分别为0、12.5、25、50和100 μg/mL的GO(用DMEM稀释),孵育24 h,DMEM洗2遍,按照100 ∶10(DMEM ∶CCK-8)的比例加入CCK-8,37 ℃孵育1 h后,分光光度仪检测(双波长法:450 nm+655 nm参考波长)。
1.2.8 hESC-RPE与GO共培养24h后凋亡检测RPE细胞接种到6孔板24 h后,待细胞密度达90%左右时,去上清,PBS洗3遍后,加入50 μg/mL的GO,并设空白组,孵育24 h后洗3遍,消化细胞用Binding Buffer重悬细胞,加入5 μL FITC Annexin V和5 μL PI室温避光孵育15 min,流式细胞仪检测(使用488 nm激发波长,525 nm发射波长)。
1.2.9 hESC-RPE与GO共培养24h后ROS检测RPE细胞接种到6孔板,待细胞密度达90%左右时,去上清,PBS洗3遍后,加入50 μg/mL的GO,孵育24 h后洗3遍,加入终浓度为10 μmol/L的DCFH-DA(PBS稀释)37 ℃孵育30 min后洗3遍,消化细胞后,用PBS重悬细胞,流式细胞仪检测(使用488 nm激发波长,525 nm发射波长)。
1.3 统计学方法采用SPSS 17.0统计软件,两组数据采用独立样本t检验,多组之间使用单因素方差分析。P<0.05被认为具有统计学差异。
2 结果 2.1 hESC及 RPE细胞的形态学观察hESC以单细胞传代后逐渐聚集生长,呈现典型的克隆样生长(图 1A)。ES超级融合后更换去除bFGF的培养基,20 d左右可出现肉眼可见的色素灶(图 1B),该色素灶呈棕褐色,随着培养时间增多增大,且色素颜色会不断加深,单独挑出色素灶后可贴壁伸展并有RPE细胞从边缘呈单层片状爬出(图 1C),形态较规则并富含色素颗粒,传代至3代后细胞呈典型的六角鹅卵石样上皮细胞形态,细胞间连接紧密(图 1D)。

|
| A:hESC呈克隆样生长;B~D:hESC向RPE细胞诱导生长,先出现色素灶(B),RPE细胞从色素灶爬出(C),经过传代细胞呈六角鹅卵石样,细胞间连接紧密(D) 图 1 hESC及hESC-RPE细胞生长形态观察 |
2.2 hESC-RPE细胞鉴定结果
将hESC-RPE细胞传至P3代行细胞免疫荧光染色和透射电镜观察:可见PAX6和MITF染色表达在细胞核,阳性率高达99%以上(图 2A、B);Bestrophin染色主要在胞膜和散在的胞浆里(图 2C);ZO-1是上皮细胞紧密连接的标记,可见较规则的紧密网状结构(图 2D);细胞内可见吞噬的红色标记的大鼠视网膜感光外节(图 2E);透射电镜中观察到RPE细胞的微绒毛只位于顶端,胞浆中富含色素颗粒,细胞呈单层,细胞与细胞之间出现紧密连接,与体内RPE细胞结构相似(图 2F)。

|
| A、B:荧光免疫细胞化学染色PAX6和MITF表达在细胞核;C、D:荧光免疫细胞化学染色Bestrophin和ZO-1主要表达在胞膜;E:细胞内可见吞噬的红色荧光外节;F:透射电镜可见与体内RPE细胞结构相似:微绒毛只位于顶端,胞浆中富含色素颗粒,细胞呈单层,细胞与细胞之间出现紧密连接 图 2 hESC-RPE细胞P3免疫荧光检测和透射电镜观察 |
2.3 GO的物理化学特征
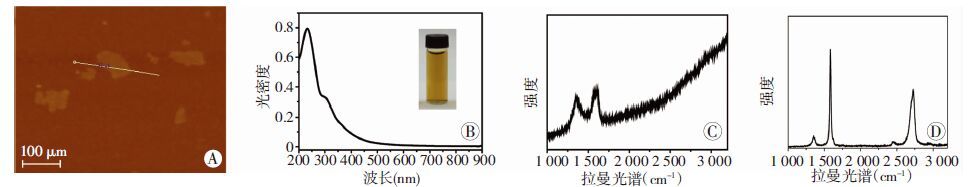
经原子力显微镜检测,氧化石墨烯的尺寸约为100 nm,厚度约为1.2 nm,且表面平整,说明制备的氧化石墨烯溶液以单层为主(图 3A)。经紫外-可见光谱分析,可见GO在约227 nm处有一显著的吸收峰(π→π*),并且在约300 nm处有一肩峰(π→σ)(图 3B)。经拉曼光谱分析,可知GO在1 355 cm-1和1 593 cm-1处出现两个特征峰(图 3C),其中1 355 cm-1处的特征峰表明石墨经过强氧化之后,其有序的结构遭到破坏,产生了许多缺陷和出现了大量的无序结构。Raman光谱显示天然石墨的表征(图 3D)。
|
| A:GO的原子力显微镜观察;B:GO的紫外-可见光谱检测,内置图片为GO溶解在ddH2O后的大体照片;C:GO的拉曼光谱检测;D:天然石墨的拉曼光谱表征 图 3 GO的物理化学特征 |
2.4 CCK-8细胞活性检测结果
将hESC-RPE细胞与浓度分别为0、12.5、25、50 μg/mL和100 μg/mL的GO共培养24 h后加入CCK-8检测,结果显示12.5~100 μg/mL的GO处理后与空白组(0 μg/mL)相比均无统计学差异(图 4)。

|
| 图 4 CCK-8检测不同浓度GO对hESC-RPE细胞活性的影响 |
2.5 细胞凋亡检测结果
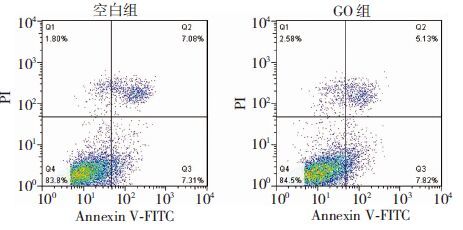
将hESC-RPE细胞与浓度为50 μg/mL的GO液共培养24 h后,通过细胞流式仪凋亡检测,可见空白组与GO组差异无统计学意义(图 5)。
|
| 图 5 流式细胞仪检测GO对hESC-RPE细胞凋亡的影响 |
2.6 氧化应激实验结果
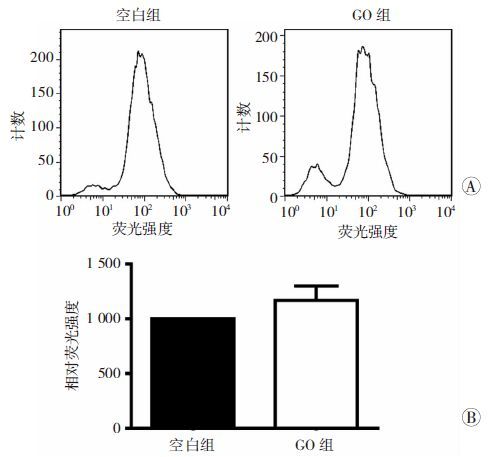
将hESC-RPE细胞与浓度为50 μg/mL的GO共培养24 h后检测两组的ROS水平,通过流式细胞仪检测结果显示GO处理后对hESC-RPE细胞的ROS水平没有显著影响(图 6)。
|
| A:两组细胞ROS荧光强度检测结果;B:两组细胞荧光强度统计结果 图 6 流式细胞仪检测GO对hESC-RPE细胞ROS水平的影响 |
3 讨论
Schwartz等[3-4]首次报道应用hESC分化而来的RPE细胞作临床移植取得了成功,这对人胚胎干细胞衍生的细胞运用于眼科临床具有非常重要的意义。由hESC分化为RPE细胞有自发分化和诱导分化两种,本实验采用让hESC过度融合生长后进行自发分化,经过20 d去除BFGF培养基的培养,可以观察到少量棕褐色的色素灶出现,随着继续的培养色素灶会增多增大,颜色会由浅至深,实验证明该方法是成熟稳定的。并且在促进RPE细胞形成中,未添加相关信号通路,这对于今后的临床应用提供了一定的安全保障。本实验发现由hESC分化的RPE细胞,呈六角鹅卵石样上皮细胞形态,细胞间连接紧密,胞浆中富含色素颗粒,具有吞噬功能,电镜观察到微绒毛只位于顶端,细胞呈单层,细胞与细胞之间出现紧密连接,这些表现都与体内RPE细胞结构非常相似。
目前RPE细胞移植主要为两种方法:一种是将细胞悬液直接注入视网膜下腔;另一种是将长有单层RPE细胞的载体放入视网膜下[10]。但是这种载体多为不降解的膜,进入体内势必影响移植效果。如果能结合组织工程材料,增加或携带神经营养因子的分泌[11],且具有高度降解功能[12],这些条件对于今后RPE细胞的移植是非常有益的。本实验中拟选用氧化石墨烯作为RPE细胞的培养基质,但它对RPE细胞的生物相容性是我们研究首先需要考虑的问题。Yan等[13]将人RPE细胞系(ARPE19)暴露于5~100μg/mL 的GO,研究GO的生物相容性。但这种细胞系与体内RPE细胞具有较大差异[13],并不能真实地反应出GO的生物毒性。而hESC-RPE细胞与体内RPE细胞十分接近[14],并且hESC-RPE细胞更接近临床实际需求,因此使用hESC-RPE细胞来研究GO的生物相容性更具有说服力。
石墨烯纳米材料在生物医学领域中具有巨大的潜在应用,它拥有独特的物理、化学和力学特性,可支持成纤维细胞、骨髓间充质干细胞和神经干细胞等多种细胞的生长[15-17],目前GO在生物医学领域的研究主要集中在功能化修饰、靶向治疗、药物缓释、生物传感器和生物监测等方面,有关GO对细胞毒性作用研究少见报道,对眼部细胞影响的相关报道甚少。本研究将hESC-RPE细胞暴露于12.5~100 μg/mL的GO来研究GO的生物相容性,发现该浓度的GO对于hESC-RPE细胞无显著细胞毒性,而既往研究发现50 μg/mL的 GO已诱发皮肤成纤维细胞、骨髓间充质干细胞等细胞的生物毒性,这可能与RPE细胞具有抗氧化应激能力有关[18],同时也提示GO诱发的细胞毒性具有细胞选择性。经过本研究的初步探索,可见GO对于hESC-RPE细胞具有较好的生物相容性,有望作为hESC-RPE细胞的移植载体,用于构建基于石墨烯薄膜的组织工程化RPE,使RPE细胞单层生长到载体上再移植入体内能发挥其最大的作用,从而挽救视功能。
| [1] | Marchese C, Felici A, Visco V, et al. Fibroblast growth factor 10 induces proliferation and differentiation of human primary cultured keratinocytes[J]. J Invest Dermatol,2001, 116 (4) : 623 –628. DOI:10.1046/j.0022-202x.2001.01280.x |
| [2] | Binder S, Stanzel B V, Krebs I, et al. Transplantation of RPE in AMD[J]. ProgRetin Eye Res,2007, 26 (5) : 516 –554. DOI:10.1016/j.preteyeres.2007.02.002 |
| [3] | Schwartz S D, Hubschman J P, Heilwell G, et al. Embryonic stem cell trials for macular degeneration: a preliminary report[J]. Lancet,2012, 379 (9817) : 713 –720. DOI:10.1016/S0140-6736(12)60028-2 |
| [4] | Schwartz S D, Regillo C D, Lam B L, et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt’s macular dystrophy: follow-up of two open-label phase 1/2 studies[J]. Lancet,2015, 385 (9967) : 509 –516. DOI:10.1016/S0140-6736(14)61376-3 |
| [5] | Aryaei A, Jayatissa A H, Jayasuriya A C. The effect of grapheme substrate on osteoblast cell adhesion and proliferation[J]. J Biomed Mater Res A,2014, 102 (9) : 3282 –3290. DOI:10.1002/jbm.a.34993 |
| [6] | 王洁, 刘加强, 房兵, 等. 氧化石墨烯对大鼠骨髓间充质干细胞生物活性的影响[J]. 组织工程与重建外科杂志,2013, 9 (6) : 306 –310. DOI:10.3969/j.issn.1673-0364.2013.06.002 |
| [7] | Wang K, Ruan J, Song H, et al. Biocompatibility of graphemeoxide[J]. Nanoscale Res Lett,2011, 6 (1) : 8 . DOI:10.1007/s11671-010-9751-6 |
| [8] | Vugler A, Carr A J, Lawrence J, et al. Elucidating the phenomenon of HESC-derived RPE: anatomy of cell genesis, expansion and retinal transplantation[J]. ExpNeurol,2008, 214 (2) : 347 –361. DOI:10.1016/j.expneurol.2008.09.007 |
| [9] | Zhang W, Yan L, Li M, et al. Deciphering the underlying mechanisms of oxidation-state dependent cytotoxicity of graphene oxide on mammalian cells[J]. ToxicolLett,2015, 237 (2) : 61 –71. DOI:10.1016/j.toxlet.2015.05.021 |
| [10] | Hu Y, Liu L, Lu B, et al. A novel approach for subretinal implantation of ultrathin substrates containing stem cell-derived retinal pigment epithelium monolayer[J]. Ophthalmic Res,2012, 48 (4) : 186 –191. DOI:10.1159/000338749 |
| [11] | Nishida E, Miyaji H, Takita H, et al. Graphene oxide coating facilitates the bioactivity of scaffold material for tissue engineering[J]. Jpn J Appl Phys,2014, 53 (6 Suppl) : 06JD04 . DOI:10.7567/JJAP.53.06JD04 |
| [12] | Yan L, Wang Y, Xu X, et al. Can graphene oxide cause damage to eyesight?[J]. Chem Res Toxicol,2012, 25 (6) : 1265 –1270. |
| [13] | Proulx S, Landreville S, Guerin S L, et al. Integrin alpha5 expression by the ARPE-19 cell line: comparison with primary RPE cultures and effect of growth medium on the alpha5 gene promoter strength[J]. ExpEye Res,2004, 79 (2) : 157 –165. DOI:10.1021/tx300129f |
| [14] | Klimanskaya I, Hipp J, Rezai K A, et al. Derivation and comparative assessment of retinal pigment epithelium from human embryonic stem cells using transcriptomics[J]. CloningStem Cells,2004, 6 (3) : 217 –245. DOI:10.1016/j.exer.2004.03.004 |
| [15] | Ryoo S R, Kim Y K, Kim M H, et al. Behaviors of NIH-3T3 fibroblasts on graphene/carbon nanotubes: proliferation, focal adhesion, and gene transfection studies[J]. ACS Nano,2010, 4 (11) : 6587 –6598. DOI:10.1089/clo.2004.6.217 |
| [16] | Akhavan O, Ghaderi E, Abouei E, et al. Accelerated differentiation of neural stem cells into neurons on ginseng-reduced graphene oxide sheets[J]. Carbon,2014, 66 : 395 –406. DOI:10.1021/nn1018279 |
| [17] | Kalbacova M, Broz A, Kong J, et al. Graphene substrates promote adherence of human osteoblasts and mesenchymal stromal cells[J]. Carbon,2010, 48 (15) : 4323 –4329. DOI:10.1016/j.carbon.2013.09.015 |
| [18] | Strauss O. The retinal pigment epithelium in visual function[J]. Physiol Rev,2005, 85 (3) : 845 –881. DOI:10.1016/j.carbon.2010.07.045 |



