2. 400016 重庆,重庆医科大学药学院药理学教研室,重庆市生物化学与分子药理学重点实验室
2. Department of Pharmacology, Chongqing Key Laboratory of Biochemistry and Molecular Pharmacology, School of Pharmacy, Chongqing Medical University, Chongqing, 400016, China
冬凌草甲素(oridonin,ORI)是一种贝壳杉烯二萜类天然有机化合物,可从唇形科香茶菜属植物中提取,目前主要从香茶菜、道孚香茶菜、冬凌草等天然植物中提取。作为传统中药提取物,ORI以其显著的抗肿瘤及低毒副作用等优势[1-2]展现了作为新型抗肿瘤或辅助抗肿瘤药物的良好潜力。目前ORI的抗肿瘤作用已成为研究热点,大量研究表明ORI能够抑制或杀灭多种肿瘤细胞[3-5],且毒副作用较低,尚少见对骨髓、肝、肾、心、脑等重要脏器有明显损伤作用的报道。但ORI抗肿瘤作用的具体机制目前尚不十分清楚。Wnt/β-catenin信号通路对动物的生长发育至关重要,在生物进化中极为保守。许多研究表明Wnt/β-catenin信号通路在各种癌症的发生、发展中有非常重要的作用[6-8]。许多骨及软组织肿瘤的发生与其异常激活有关。有研究表明,在骨肉瘤中Wnt/β-catenin的转导异常[9-12],提示其可能是治疗骨肉瘤的一个潜在靶点。本研究检测不同浓度ORI对143B细胞增殖和凋亡的影响,分析该作用与Wnt/β-catenin信号的关系,探索ORI调控Wnt/β-catenin信号转导的可能机制,以期为ORI作为抗肿瘤药物提供新的证据。
1 材料及方法 1.1 药物及试剂人骨肉瘤细胞株143B购自ATCC,冬凌草甲素购自西安昊轩生物科技有限公司,实验所用抗体购自Santa Cruz Biotechnology公司,重组腺病毒表达红色荧光蛋白(Ad-RFP)、沉默及过表达β-catenin(Si-β-catenin、 Ad-β-catenin)提前通过AdEasy系统制备。
1.2 实验方法 1.2.1 细胞培养143B细胞采用DMEM培养基(含10%胎牛血清、105 U/L青霉素和0.1 g/L链霉素)常规培养于5% CO2饱和湿度、37 ℃培养箱中,2 d换液传代1次,取对数生长期细胞用于实验。
1.2.2 实验设计及分组将143B细胞分为实验组和对照组,用DMSO溶解ORI,实验组用不同浓度的ORI处理,对照组用相同体积DMSO或者同体积Ad-RFP处理。
1.2.3 结晶紫染色检测细胞增殖将细胞接种于24孔板中,用不同浓度ORI(5、10、15、20、25 μmol/L)或者ORI、Si-β-catenin、Ad-β-catenin、 ORI+Si-β-catenin、ORI+Ad-β-catenin(ORI均为10 μmol/L)处理,分别于24、48、72 h进行结晶紫染色,检测细胞增殖情况。弃培养基,用PBS小心清洗孔板1次,弃PBS,每孔加入200 μL结晶紫饱和溶液,在室温下孵育20 min,弃结晶紫染色液,用PBS小心清洗3次,室温下将孔板晾干后扫描。每组实验重复3次。
1.2.4 结晶紫定量分析在进行过结晶紫染色的24孔板中每孔加入200 μL 20%的乙酸溶液,置于摇床上,室温孵育20 min以溶解结晶紫,每孔取100 μL溶液转移至96孔板,于酶标仪检测光密度值,波长定于570 nm。每组实验重复3次。
1.2.5 Annexin V-EGFP染色法检测细胞凋亡凋亡早期,细胞膜内侧的磷脂酰丝氨酸翻向外侧。Annexin V是一种磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,可与细胞外侧暴露的磷脂酰丝氨酸结合,可用于特异性检测早期凋亡细胞。将细胞接种于24孔板中,用不同浓度的ORI(5、10、15 μmol/L)处理,24 h后用PBS小心清洗孔板1次,弃PBS,加入染色工作液室温孵育5 min,工作液按结合缓冲液(binding buffer,BF)和染色液(Annexin V-EGFP)250 ∶1比例配制,于荧光显微镜下检测绿色荧光蛋白。每组实验重复3次。
1.2.6 Western blot实验将细胞接种于6孔板中,按实验设计加入不同浓度的ORI(5、10、15 μmol/L)处理,于24 h提取各组总蛋白于10%的聚丙烯酰胺凝胶进行电泳,按常规操作方法进行Western blot实验。最后采用ECL试剂盒显影成像。每组实验重复3次。
1.2.7 RNA提取及RT-PCR实验将细胞接种于T25培养瓶中,按实验设计加入不同浓度的ORI(5、10、15 μmol/L)处理,并用含1%胎牛血清的完全培养基培养细胞,于相应的时间点(24 h)采用TRIzol提取总RNA,逆转录制备cDNA,PCR检测目的基因mRNA表达水平。GAPDH上游引物5′-CAACGAATTTGGCTACAGCA-3′,下游引物5′-AGGGGAGATTCAGTGTGGTG-3′,片段长度为170 bp;β-catenin上游引物5′-CTGCAGGGGTCCTCTGTG-3′,下游引物5′-TGCATATGTC-GCCACACC-3′,片段长段343 bp。每组实验重复3次。
1.3 统计学分析应用SPSS 19.0统计软件,计量资料以x±s表示,组间比较行t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 ORI对143B细胞增殖的影响结晶紫染色(图 1A)及定量(图 1B)分析结果显示,与对照组相比,ORI处理组143B细胞的增殖受到明显抑制,ORI在10 μmol/L时已能明显抑制143B细胞的生长,差异有统计学意义(P < 0.05),并表现出浓度依赖性。Western blot检测结果显示,ORI能够明显下调增殖细胞核抗原(proliferatingcell nuclear antigen,PCNA)的表达(图 1C)。这提示ORI能抑制143B骨肉瘤细胞的增殖。
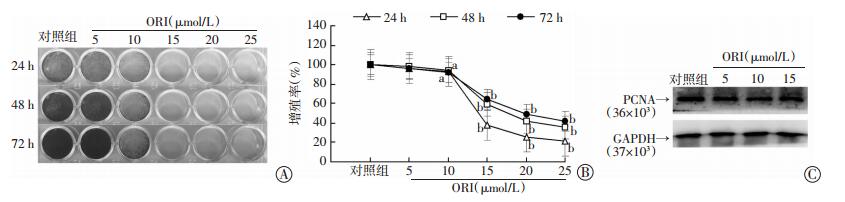
|
| A:结晶紫染色;B:定量分析 a:P < 0.05,b:P < 0.01,与对照组比较;c: Western blot检测 图 1 冬凌草甲素对143B细胞增殖的作用 |
2.2 ORI对143B细胞凋亡的影响
Annexin V-EGFP染色结果显示,与对照组相比,ORI处理组143B细胞凋亡显著增加,并随着药物浓度提高而增加(图 2A)。Caspase-3和Bad为重要的细胞凋亡相关蛋白。Western blot检测结果显示,ORI不同浓度处理组的Caspase-3及其活化型Caspase-3、Bad蛋白表达水平明显高于对照组,并呈浓度依赖性增加(图 2B)。这提示ORI有诱导143B细胞凋亡的作用。

|
| A: Annexin V-EGFP染色(×200);B: Western blot检测 图 2 冬凌草甲素对143B细胞凋亡的作用 |
2.3 ORI对143B细胞中Wnt/β-catenin信号转导的影响
β-catenin在Wnt/β-catenin信号转导过程中处于中心地位,与细胞内β-catenin水平及丝氨酸/苏氨酸激酶糖原合成酶激酶-3β(serin/threonine glycogen synthasekinase 3β,GSK-3β)的表达直接相关。经ORI处理后,与对照组相比,RT-PCR检测结果提示143B细胞β-catenin mRNA的表达水平并未出现显著变化(图 3A)。但是Western blot检测结果提示β-catenin蛋白水平随着药物浓度的增加显著降低(图 3B),GSK-3β随ORI浓度增高而增高(图 3C),而p-GSK-3β则呈相反趋势,随药物浓度增加降低(图 3D)。这提示ORI能抑制143B细胞中β-catenin的表达,该抑制作用可能主要通过调控Axin/腺瘤性结肠息肉病基因(adenomatous polyposis coli,APC)/GSK-3β复合物实现,而不是通过直接抑制β-catenin基因的表达实现。

|
| A: RT-PCR检测ORI对143B细胞中β-catenin mRNA表达水平的影响;B: Western blot检测ORI对143B细胞中β-catenin蛋白表达水平的影响;C: Western blot检测ORI对143B细胞中GSK-3β蛋白表达水平的影响;D: Western blot检测ORI对143B细胞中p-GSK-3β蛋白表达水平的影响 图 3 冬凌草甲素对143B细胞中Wnt/β-catenin信号的作用 |
2.4 沉默或过表达143B细胞中β-catenin对ORI诱导143B凋亡作用的影响
结晶紫染色(图 4A)及定量(图 4B)分析结果显示,与对照组相比,ORI及Si-β-catenin处理组143B细胞的增殖受到明显抑制,且Si-β-catenin后能促进ORI对143B细胞增殖的抑制作用;Ad-β-catenin对143B细胞增殖的促进作用虽然仅在第1天较明显,但能在一定程度上逆转ORI对143B细胞增殖的抑制作用,差异有统计学意义(P < 0.05)。

|
| 1:对照组;2:ORI组;3:Si-β-catenin处理组;4:Ad-β-catenin组;5:ORI+Si-β-catenin组;6:ORI+Ad-β-catenin组A:结晶紫染色;B:定量分析a:P < 0.05,与对照组比较;b:P < 0.05,与ORI组比较 图 4 沉默和过表达β-catenin后冬凌草甲素对143B细胞增殖的作用 |
3 讨论
骨肉瘤好发于青少年,是小儿最常见的原发性恶性骨肿瘤,其致死率和致残率极高,随着手术和放、化疗的进展,其预后有了很大改善[13],但放、化疗的副作用严重影响患者生活质量。因此,寻找有效且低毒的抗骨肉瘤活性药物具有重要的临床意义。
近年研究表明,ORI对多种肿瘤细胞具有增殖抑制和凋亡诱导作用,如淋巴瘤细胞[3]、结肠癌细胞[4]和乳腺癌[5]细胞等。本研究表明,ORI能够明显下调PCNA[14],抑制143B细胞增殖。Caspase和B细胞淋巴瘤白血病-2(B-cell leukemia-2, Bcl-2)家族的细胞因子均直接参与调控细胞凋亡过程,Bad可通过细胞信号通路以及与天冬氨酸特异的半胱氨酸蛋白家族成员作用促进凋亡[15-16],而ORI能够促进Caspase-3及Bad的表达。因此,我们认为ORI能够促进143B细胞凋亡。
Wnt/β-catenin信号通路在生物进化过程中高度保守,在个体的生长发育过程中具有至关重要的作用,和许多肿瘤的发生、发展有紧密联系[6-8]。在经典Wnt信号通路中,β-catenin发挥着最为关键的作用,而细胞内β-catenin水平受到Axin、APC和GSK-3β复合物调控[17-18]。其中GSK-3β水平与β-catenin密切相关,磷酸化后该复合物便无法降解β-catenin[19-20]。当β-catenin进入细胞后被该复合物降解而失去活性,Wnt信号通路被抑制;而当GSK-3β磷酸化,β-catenin不能被降解,在胞浆内积聚,进而转移至核内与转录因子TCF/LEF结合,调节下游靶基因[21]。这些靶基因包括Survivin、C-myc、Cyclin、Caspase等,通过这些靶基因Wnt信号即可参与调控细胞的增殖、分化、凋亡及癌变等过程。研究表明,Wnt/β-catenin信号通路与骨肉瘤密切相关[10-12],β-catenin可作为骨肉瘤治疗的潜在靶点之一。本研究表明,ORI能够抑制143B细胞中β-catenin的表达,而过表达β-catenin能在一定程度上逆转ORI对143B增殖的抑制作用,沉默β-catenin则进一步促进该作用。
本研究表明,ORI能够抑制人骨肉瘤细胞株143B增殖,诱导其凋亡;该作用可能与其抑制Wnt/β-catenin信号转导相关;而ORI对Wnt信号的抑制作用很可能通过促进Axin/APC/GSK-3β复合物降解β-catenin实现。
| [1] | Liu Z, Ouyang L, Peng H, et al. Oridonin: targeting programmed cell death pathways as an anti-tumour agent[J]. Cell Prolif,2012, 45 (6) : 499 –507. DOI:10.1111/j.1365-2184.2012.00849.x |
| [2] | Li C Y, Wang E Q, Cheng Y, et al. Oridonin: An active diterpenoid targeting cell cycle arrest, apoptotic and autophagic pathways for cancer therapeutics[J]. Int J Biochem Cell Biol,2011, 43 (5) : 701 –704. DOI:10.1016/j.biocel.2011.01.020 |
| [3] | Xu Z Z, Fu W B, Jin Z, et al. Reactive oxygen species mediate oridonin-induced apoptosis through DNA damage response and activation of JNK pathway in diffuse large B cell lymphoma[J]. Leuk Lymphoma,2016, 57 (4) : 888 –898. DOI:10.3109/10428194.2015.1061127 |
| [4] | Gao F H, Liu F, Wei W, et al. Oridonin induces apoptosis and senescence by increasing hydrogen peroxide and glutathione depletion in colorectal cancer cells[J]. Int J Mol Med,2012, 29 (4) : 649 –655. DOI:10.3892/ijmm.2012.895 |
| [5] | Li Y, Wang Y, Wang S, et al. Oridonin phosphate-induced autophagy effectively enhances cell apoptosis of human breast cancer cells[J]. Med Oncol,2015, 32 (1) : 365 . DOI:10.1007/s12032-014-0365-1 |
| [6] | Duraiswamy A J, Lee M A, Madan B, et al. Discovery and optimization of a porcupine inhibitor[J]. J Med Chem,2015, 58 (15) : 5889 –5899. DOI:10.1021/acs.jmedchem.5b00507 |
| [7] | Rasmussen N R, Debebe Z, Wright T M, et al. Expression of Ror2 mediates invasive phenotypes in renal cell carcinoma[J]. PLoS One,2014, 9 (12) : e116101 . DOI:10.1371/journal.pone.0116101 |
| [8] | Anitha P, Priyadarsini R V, Kavitha K, et al. Ellagic acid coordinately attenuates Wnt/β-catenin and NF-κB signaling pathways to induce intrinsic apoptosis in an animal model of oral oncogenesis[J]. Eur J Nutr,2013, 52 (1) : 75 –84. DOI:10.1007/s00394-011-0288-y |
| [9] | Basu-Roy U, Seo E, Ramanathapuram L, et al. Sox2 maintains self renewal of tumor-initiating cells in osteosarcomas[J]. Oncogene,2011, 31 (18) : 2270 –2282. DOI:10.1038/onc.2011.405 |
| [10] | Piskun C M, Muthuswamy A, Huelsmeyer M K, et al. Wnt/β-catenin expression does not correlate with serum alkaline phosphatase concentration in canine osteosarcoma patients[J]. PLoS One,2011, 6 (10) : e26106 . DOI:10.1371/journal.pone.0026106 |
| [11] | Dieudonne F X, Marion A, Marie P J, et al. Targeted inhibition of T-cell factor activity promotes syndecan-2 expression and sensitization to doxorubicin in osteosarcoma cells and bone tumors in mice[J]. J Bone Miner Res,2012, 27 (10) : 2118 –2129. DOI:10.1002/jbmr.1650 |
| [12] | Basu-Roy U, Basilico C, Mansukhani A. Perspectives on cancer stem cells in osteosarcoma[J]. Cancer Lett,2013, 338 (1) : 158 –167. DOI:10.1016/j.canlet.2012.05.028 |
| [13] | Ando K, Heymann M F, Stresing V, et al. Current therapeutic strategies and novel approaches in osteosarcoma[J]. Cancers (Basel),2013, 5 (2) : 591 –616. DOI:10.3390/cancers5020591 |
| [14] | Darzynkiewicz Z, Zhao H, Zhang S, et al. Initiation and termination of DNA replication during S phase in relation to cyclins D1, E and A, p21WAF1, Cdt1 and the p12 subunit of DNA polymerase δ revealed in individual cells by cytometry[J]. Oncotarget,2015, 6 (14) : 11735 –11750. DOI:10.18632/oncotarget.4149 |
| [15] | Shahinian H, Tholen S, Schilling O. Proteomic identification of protease cleavage sites: cell-biological and biomedical applications[J]. Expert Rev Proteomics,2013, 10 (5) : 421 –433. DOI:10.1586/14789450.2013.841547 |
| [16] | Doerflinger M, Glab J A, Puthalakath H. BH3-only proteins: a 20-year stock-take[J]. FEBS J,2015, 282 (6) : 1006 –1016. DOI:10.1111/febs.13190 |
| [17] | Li S, Wang C, Liu X, et al. The roles of AXIN2 in tumorigenesis and epigenetic regulation[J]. Fam Cancer,2015, 14 (2) : 325 –331. DOI:10.1007/s10689-014-9775-7 |
| [18] | Song X, Wang S, Li L. New insights into the regulation of Axin function in canonical Wnt signaling pathway[J]. Protein Cell,2014, 5 (3) : 186 –193. DOI:10.1007/s13238-014-0019-2 |
| [19] | McCubrey J A, Steelman L S, Bertrand F E, et al. GSK-3 as potential target for therapeutic intervention in cancer[J]. Oncotarget,2014, 5 (10) : 2881 –2911. DOI:10.18632/oncotarget.2037 |
| [20] | McCubrey J A, Davis N M, Abrams S L, et al. Diverse roles of GSK-3: tumor promoter-tumor suppressor, target in cancer therapy[J]. Adv Biol Regul,2014, 54 : 176 –196. DOI:10.1016/j.jbior.2013.09.013 |
| [21] | Baron R, Kneissel M. WNT signaling in bone homeostasis and disease: from human mutations to treatments[J]. Nat Med,2013, 19 (2) : 179 –192. DOI:10.1038/nm.3074 |



