脂多糖/内毒素(lipopolysacchride/endotoxin,LPS)是革兰阴性菌外膜的主要成分,是介导脓毒症(sepsis)发生、发展的主要病原体相关分子模式(pathogen-associated molecular patterns,PAMPs),LPS与其模式识别受体 (toll-like receptor 4,TLR4)结合后,通过MyD88依赖和TRAM-TRIF依赖的两条信号转导通路,介导核转录因子NF-κB和IRF3的活化,引起TNF及IL-6等细胞因子的表达[1, 2, 3]。
泛素蛋白酶体系统(ubiquitin-proteasome system,UPS)是真核细胞中主要溶酶体非依赖的蛋白降解途径,参与炎症、信号转导、转录调控、细胞凋亡和DNA损伤修复等生物学活动[4]。UPS由泛素活化酶E1、泛素结合酶E2、泛素连接酶E3、去泛素化酶DUB和26S蛋白酶体组成。蛋白质的泛素化是一种酶催化的可逆反应,在E1、E2和E3的协同作用下使底物蛋白连接泛素分子而发生泛素化修饰,相反,DUB的作用则是使靶蛋白上连接的泛素分子与底物蛋白解离。现已研究证实,在LPS-TLR4信号通路中,TRAF6及IKKγ/NF-κB essential modulator(NEMO)等信号蛋白的泛素化参与NF-κB的活化过程[5, 6],因此UPS相关分子可能对这些信号蛋白进行泛素化修饰降解或失活下调炎症介质的释放,参与NF-κB的调控。近年来该系统在LPS-TLR4信号通路中的调控作用日益受到关注,但具体的调控机制仍有待进一步的研究。
氯喹(chloroquine,CQ) 是弱碱性药物,最早作为一线抗疟药应用于临床。后续相关研究显示,CQ还具有阻断内体和溶酶体的酸化成熟、抑制自噬以及体内外拮抗炎症反应等诸多药理学效应[7]。特别是大量研究发现,CQ具有广谱的抗炎活性,对多种炎症介质的释放有显著的抑制作用。但目前有关氯喹抗炎作用的具体机制尚不明确,本课题组前期研究发现,CQ对LPS诱导MyD88依赖和TRAM-TRIF依赖的两条信号通路的活化均有抑制作用,并可下调TLR4两条信号转导通路核转录因子NF-κB和AP-1的活性,抑制TNF-α等细胞因子的释放[8, 9]。我们还发现,CQ可通过减少microRNA-669n的表达,上调小泛素相关修饰物特异性蛋白酶6 (small ubiquitin-related modifier,SUMO)-specific protease 6,SENP6)的表达,从而下调
促炎细胞因子TNF-α和IL-6等的释放[10]。该结果提示泛素化和类泛素化过程可能也参与了氯喹对LPS介导的NF-κB活化以及炎症介质表达的调控过程。为此我们采用组学研究方法对参与此过程的相关分子进行筛选研究,发现UPS及其相关分子可能参与了上述的炎症抑制过程。因此,我们推测CQ可能通过调控UPS及其相关分子的表达及活性,进而发挥对LPS-TLR4信号通路的抑制作用。本研究拟通过研究氯喹对LPS诱导巨噬细胞中UPS相关分子的表达情况及其与炎症介质表达的相关性研究,探讨氯喹抑制LPS炎症反应的可能的作用机制。
氯喹(CQ)、大肠埃希菌LPS(O55 ∶B5)均购自美国Sigma公司;小鼠Raw264.7购自美国ATCC公司;RT-PCR引物由上海生物工程技术服务有限公司合成;A20和TRIM33抗体购自美国CST公司;A20 siRNA由广州锐博生物合成;A20、TRIM33、USP28、TNF-α和内参β-actin引物由上海生工合成;酶联分析仪、半干转印仪、凝胶分析仪均为美国Bio-Rad公司产品。
1.2 细胞培养小鼠巨噬细胞系Raw264.7加入10%胎牛血清的DMEM培养液传代至6孔板,置CO2培养箱中孵育过夜。根据实验设计将细胞分为4组:空白对照组、LPS刺激组、CQ处理组和LPS+CQ组(20 μg/mL CQ预处理1 h再加100 ng/mL LPS共同处理),各组细胞分别在LPS加样4 h后收集细胞进行下一步处理。
1.3 RT-PCR检测A20、TRIM33和USP28的mRNA表达取对数生长期Raw264.7细胞,用TRIzol试剂提取总RNA,以总RNA为模板逆转录为cDNA,并以cDNA为模板进行PCR,引物序列如下表所示。PCR反应条件:94 ℃预变性30 s;94 ℃ 5 s,59 ℃ 10 s,72 ℃ 15 s,共40次循环;经熔解曲线分析后,通过Bio-Rad CFX Manager分析软件进行分析处理,采用2-△△Ct法分析A20、TRIM33、USP28的mRNA表达[11]。
1.4 Western blot检测A20、TRIM33的蛋白表达取对数生长期Raw264.7细胞,CQ和LPS共处理后,弃上清,PBS洗3次,加预冷的细胞裂解液84 μL,冰浴30 min,12 000 r/min离心10 min,取上清。蛋白定量后取10~20 μg总蛋白进行SDS-PAGE并转PVDF膜,5% BSA室温封闭90 min,一抗4 ℃过夜,PBST充分漂洗3~5次,每次10 min,二抗37 ℃孵育2 h,PBST充分漂洗3~5次,每次10 min,膜表面覆盖ECL显色液,置凝胶成像仪观察分析结果。
| 引物名称 | 引物序列 | 产物长度(bp) |
| mouse A20 | 上游序列 5′-TGTGGGGTGTTCAGGATACTG-3′ | 77 |
| 下游序列 5′-GTTCCGAGTGTCTGTCTCCTTA-3′ | ||
| mouse TNF-α | 上游序列 5′-CTGAACTTCGGGGTGATCGG-3′ | 122 |
| 下游序列 5′-GGCTTGTCACTCGAATTTTGAGA-3′ | ||
| mouse USP28 | 上游序列 5′-CTGCGAGAAATCACAGGCATC-3′ | 171 |
| 下游序列 5′-GCTGGTAGCACTCTCTTCTACTT-3′ | ||
| mouse TRIM33 | 上游序列 5′-AGATAATGCAAGTGCAGTTGGT-3′ | 224 |
| 下游序列 5′-ACGTCAATCTATCACACGTTTCA-3′ | ||
| mouse β-actin | 上游序列 5′- TGGAATCCTGTGGCATCCATGAAAC-3′ | 349 |
| 下游序列 5′- TCGCAGCTCAGTAACAGTCCG-3′ |
取对数生长期Raw264.7细胞,CO2培养箱中过夜,细胞融合60%~80%进行siRNA转染,按照Roche公司siRNA转染试剂说明书进行操作,转染24 h换液,CQ预处理1h,LPS刺激1 h,TRIzol试剂提取细胞总RNA,以总RNA为模板逆转录为cDNA,并以cDNA为模板进行PCR反应,采用2-△△Ct法分析TNF-α的mRNA表达及A20的干扰表达情况。
1.6 统计学分析计量资料以x±s表示,所有数据采用SPSS 13.0统计软件,应用单因素方差分析进行统计处理。
2 结果 2.1 CQ上调LPS诱导Raw264.7细胞中A20、TRIM33 和USP28的mRNA表达RT-PCR结果显示,细胞在基础状态下存在一定的A20、TRIM33和USP28基础表达,当LPS活化Raw264.7细胞,A20的mRNA表达水平较空白对照组有明显增加,TRIM33和USP28的mRNA表达水平低于空白对照组;而CQ处理再给予LPS刺激,A20、TRIM33和USP28的mRNA表达水平较LPS组均有明显上调(P<0.05,P<0.01,图 1),说明CQ显著增加LPS诱导的Raw264.7细胞中锌指蛋白A20、E3连接酶TRIM33和泛素特异性蛋白酶USP28的核酸表达水平。
 |
| 1:空白对照组;2:内毒素刺激组;3:氯喹处理组;4:内毒素+氯喹处理组 a: P<0.01, b: P<0.05 ,与内毒素刺激组比较 图 1 定量PCR检测CQ处理LPS活化Raw264.7细胞中A20(A)、TRIM33(B)和USP28(C)的mRNA表达 |
Western blot检测结果显示,Raw264.7细胞在未给予任何处理的基础状态下,A20和TRIM33有一定的基础表达量,CQ预处理Raw264.7细胞,再给予LPS 刺激,A20和TRIM33的蛋白表达水平较LPS组有明显上调(图 2),说明氯喹显著上调LPS刺激的Raw264.7细胞中锌指蛋白A20和E3连接酶TRIM33在蛋白水平的表达。
 |
| 1:空白对照组;2:内毒素刺激组;3:氯喹处理组;4:内毒素+ 氯喹处理组 图 2 Western blot检测A20(A)和TRIM33(B)的蛋白表达 |
RT-PCR结果显示,Raw264.7细胞在给予LPS刺激后,TNF-α的mRNA表达水平较阴性对照组有明显升高,CQ预处理Raw264.7细胞,再给予LPS刺激,其TNF-α的mRNA表达水平较LPS刺激组有显著减少 (P<0.01,图 3B),说明CQ预处理可显著抑制LPS诱导Raw264.7细胞中TNF-α的mRNA合成。空载siRNA转染Raw264.7细胞未改变细胞中A20的mRNA表达量 (P>0.05,图 3A),且空载siRNA不影响CQ预处理Raw264.7细胞中TNF-α的mRNA表达 (P>0.05,图 3B);siRNA干扰A20基因表达(P<0.01,图 3B),则增加CQ预处理细胞中TNF-α的核酸表达水平 (P<0.05,图 3B),提示A20参与CQ抑制LPS活化巨噬细胞中TNF-α的mRNA表达。
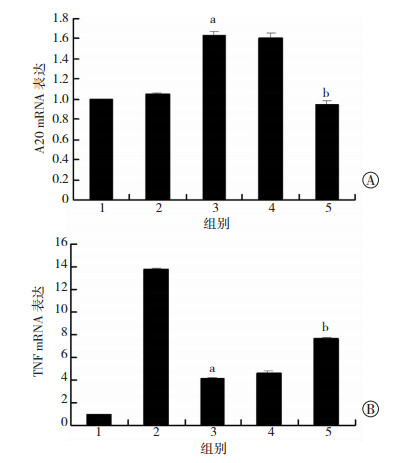 |
| 1:空白对照组;2:内毒素刺激组;3:内毒素+氯喹处理组;4:内毒素+氯喹+空载siRNA组;5:内毒素+氯喹+A20 siRNA组 a: P<0.01,与内毒素刺激组比较; b: P<0.05,与内毒素+氯喹+空载siRNA组比较 图 3 荧光定量PCR检测siRNA干扰A20表达对CQ及LPS诱导Raw264.7细胞中A20(A)和TNF(B)的mRNA表达 |
课题组前期研究发现,抗疟药CQ对LPS诱导MyD88依赖和TRAM-TRIF依赖的2条信号通路均有负反馈抑制作用,抑制TNF和IL-6等细胞因子的释放[9]。同时我们还发现,CQ上调SENP6的表达,从而下调TNF-α和IL-6等的释放[10],提示泛素化和类泛素化参与氯喹抑制NF-κB的活化过程。因此我们在前期工作基础上进行组学筛选,发现UPS及其相关分子可能参与了上述的炎症抑制过程。因此,我们推测CQ可能通过调控UPS及其相关分子的表达及活性,进而抑制LPS-TLR4信号通路。
TRIM33主要抑制TGF-β的信号级联反应[12],USP28主要参与DNA的损伤修复[13],TRIM33和USP28在TLR/IL-1R通路及CQ抑制LPS诱导巨噬细胞活化中的作用尚不明确。A20参与下调TLR/IL-1R诱导NF-κB的活化和促炎性细胞因子的释放[14, 15],因此选择A20进行后续siRNA干扰对CQ抗炎活性的影响。
锌指蛋白A20(zinc finger protein A20),又名TNF-α 诱导蛋白3(tumor necrosis factorainducing protein 3,TNFAIP3),是细胞凋亡研究中发现的一种肿瘤坏死因子应答基因的编码产物[16],属于卵巢肿瘤家族去泛素化酶,其N端含半胱氨酸蛋白酶的DUB结构域OTU,C端由具有E3泛素连接酶活性的锌指结构组成,因此A20既具有泛素化活性,又有去泛素化功能[17]。后来的研究表明A20不仅可抑制血管内皮细胞的NF-κB活性[18],抑制TNF/TNFR介导的细胞凋亡[18],而且可参与下调TLR/IL-1R诱导NF-κB的活化和促炎性细胞因子的释放[14, 15]。A20是NF-κB依赖性表达,当NF-κB被大量活化时,A20与NEMO(IKKγ)的结合可抑制IKK和IκB的磷酸化,从而减少NF-κB的进一步活化起到负反馈抑制作用[19, 20]。因此A20具有较明确的拮抗LPS-TLR4通路、下调TLR/IL-1R诱导NF-κB活化的活性,那么CQ是否通过A20抑制LPS诱导巨噬细胞的活化呢?我们研究发现抗疟药CQ可明显增加LPS刺激巨噬细胞中A20的mRNA和蛋白表达,而siRNA干扰A20基因表达,CQ抑制LPS诱导炎性因子TNF-α的mRNA表达不明显,因此A20参与CQ下调LPS刺激巨噬细胞中促炎细胞因子的mRNA表达,应用siRNA转染技术沉默A20基因表达,可增加CQ预处理细胞中TNF的mRNA表达,提示A20可能是CQ抑制LPS炎症反应的一个靶点。
同时,本研究还发现CQ不仅可显著上调TRIM33的mRNA和蛋白表达,而且可增加USP28的mRNA表达。TRIM33通过破坏SMAD复合物与TGF-β应答基因启动子的结合而负调控TGF-β通路[12],而USP28与细胞周期蛋白结合调节Myc基因的稳定性而参与DNA的损伤修复[13]。但TRIM33和USP28在炎症和LPS-TLR4通路的作用不明确,本研究我们发现CQ可增加LPS诱导Raw264.7细胞中TRIM33的mRNA和蛋白表达,及USP28的mRNA表达,因此TRIM33和USP28可能也参与CQ抑制LPS活化和TLR/IL-1R通路调控过程,但具体调控机制有待进一步研究。
本研究发现CQ可能通过UPS相关分子如A20、TRIM33和USP28的表达上调从而实现对LPS-TLR4通路活化的抑制,且A20参与CQ抑制LPS诱导巨噬细胞的活化过程,但TRIM33和USP28在CQ抑制LPS-TLR4通路中的具体调控机制及其相互联系仍有待进一步的研究。
| [1] | Munford R S, Pugin J. Normal responses to injury prevent systemic inflammation and can be immunosuppressive[J]. Am J Respir Crit Care Med, 2001, 163(2): 316-321. DOI:10.1164/ajrccm. 163.2. 2007102 |
| [2] | Lu Y C, Yeh W C, Ohashi P S. LPS/TLR4 signal transduction pathway[J]. Cytokine, 2008, 42(2): 145-151. DOI:10.1016/j.cyto.2008.01.006 |
| [3] | 郑江, 郑新川. 以细菌主要病原体相关分子为靶标的脓毒症防治策略[J]. 第三军医大学学报, 2016, 38(4): 323-329. |
| [4] | Wang J, Maldonado M A. The ubiquitin-proteasome system and its role in inflammatory and autoimmune diseases[J]. Cell Mol Immunol, 2006, 3(4): 255-261. |
| [5] | 许国莹. 信号分子TRAF6的研究讲展[J]. 细胞与分子免疫学杂志, 2010, 26(12): 1326-1328. |
| [6] | Wang G, Gao Y, Li L, et al . K63-linked ubiquitination in kinase activation and cancer[J]. Front Oncol, 2012, 2: 5. DOI:10.3389/fonc.2012. 00005 |
| [7] | Hong Z, Jiang Z, Liangxi W, et al . Chloroquine protects mice from challenge with CpG ODN and LPS by decreasing proinflammatory cytokine release[J]. Int Immunopharmacol, 2004, 4(2): 223-234. DOI:10.1016/j.intimp.2003.12.006 |
| [8] | 王艳艳, 郑江. LPS-TLR4复合物内化障碍与LPS介导巨噬细胞活化的实验研究[J]. 重庆医学, 2011, 40(23):2291-2293,2296. |
| [9] | 王艳艳, 刘鑫, 曹红卫, 等. 氯喹对脂多糖/内毒素诱导的RAW264.7细胞TLR4-MyD88非依赖信号转导途径的抑制作用[J]. 第三军医大学学报, 2010, 32(9): 869-873. |
| [10] | Long Y, Liu X, Wang N, et al . Chloroquine attenuates LPS-mediated macrophage activation through miR-669n-regulated SENP6 protein translation[J]. Am J Transl Res, 2015, 7(11): 2335-2345. |
| [11] | 李权, 王亚旭, 申海鹰, 等. 腺苷干预人结直肠癌SW480细胞RECK基因甲基化及其机制[J]. 第三军医大学学报, 2015, 37(1):46-50. DOI:10.16016/j. 1000-5404. 201408020 |
| [12] | Dupont S, Mamidi A, Cordenonsi M, et al . FAM/USP9x, a deubiquitinating enzyme essential for TGFbeta signaling, controls Smad4 monoubiquitination[J]. Cell, 2009, 136(1): 123-135. DOI:10.1016/j.cell. 2008.10.051 |
| [13] | Zhang D, Zaugg K, Mak T W, et al . A role for the deubiquitinating enzyme USP28 in control of the DNA-damage response[J]. Cell, 2006, 126(3): 529- 542. DOI:10.1016/j.cell.2006.06.039 |
| [14] | Boone D L, Turer E E, Lee E G, et al . The ubiquitin-modifying enzyme A20 is required for termination of Toll-like receptor responses[J]. Nat Immunol, 2004, 5(10): 1052-1060. DOI:10.1038/ ni1110 |
| [15] | 俞雯雯, 史丽云. 泛素化调控与中药抗炎[J]. 医学综述, 2014, 20(21): 3843-3846. DOI: 10.3969/j.issn.1006-2084.2014.21.002. |
| [16] | Dixit V M, Green S, Sarma V, et al . Tumor necrosis factor-alpha induction of novel gene products in human endothelial cells including a macrophage-specific chemotaxin[J]. J Biol Chem, 1990, 265(5): 2973-2978. |
| [17] | Wertz I E, O'Rourke K M, Zhou H, et al . De-ubiquitination and ubiquitin ligase domains of A20 downregulate NF-kappaB signalling[J]. Nature, 2004, 430(7000): 694-699. DOI:10.1038/nature02794 |
| [18] | 姚丹, 龚开政, 张振刚. 锌指蛋白A20与心血管疾病的研究进展[J]. 中华临床医师杂志:电子版, 2014, 8(13): 2494-2498. DOI:10.3877/cma.j.issn. 1674- 0785. 2014. 13.027 |
| [19] | 左云龙, 匡凤梧, 吴丽娟. A20的泛素修饰抑制NF-κB活性[J]. 重庆医科大学学报, 2007, 32(5): 552-553, 557. DOI:10.3969/j.issn. 0253-3626. 2007. 05.032 |
| [20] | Hutti J E, Turk B E, Asara J M, et al . IkappaB kinase beta phosphorylates the K63 deubiquitinase A20 to cause feedback inhibition of the NF-kappaB pathway[J]. Mol Cell Biol, 2007, 27(21): 7451-7461. DOI:10.1128/MCB.01101-07 |



