2. 高原军事医学系病理生理学与高原病理学教研室
2. Department of Pathophysiology and High Altitude Pathology, College of High Altitude Military Medicine, Third Military Medical University, Chongqing, 400038, China
Zhou Qiquan, E-mail: zhouQQ99@sohu.com
下丘脑是食欲调节中枢,调控机体的摄食行为[1]。Ⅰ型大麻素受体(cannabinoid receptor typeⅠ,CB1)是一种G蛋白耦联受体,在下丘脑表达并参与食欲的调节。研究[2-3]表明,激活下丘脑CB1受体可使动物摄食量增加;相反,抑制下丘脑CB1受体可使动物摄食量减少,体质量减轻。世居平原人群进入高原的早期,食欲降低,体质量和摄食量显著减少[4-9],这是否与高原缺氧影响下丘脑CB1受体有关尚不清楚。本研究将大鼠置模拟海拔5 000 m低压舱中,记录大鼠摄食量的变化,并对下丘脑CB1受体的表达进行观察,探讨高原缺氧影响食欲的机制。
1 材料与方法 1.1 主要材料和试剂成年雄性SD大鼠54只(第三军医大学实验动物中心提供),体质量(307.9±0.7)g。兔抗人CB1受体多克隆抗体购自美国Abcam公司,小鼠抗人c-Fos单克隆抗体和β-actin抗体购自Santa Cruz公司,辣根过氧化物酶标记山羊抗小鼠IgG和辣根过氧化物酶标记山羊抗兔IgG购自北京中杉金桥生物技术有限公司,组织裂解液、蛋白酶抑制剂PMSF、BCA蛋白浓度测定试剂盒以及Western blot试剂购自碧云天公司。冰冻切片机(Leica),凝胶成像分析系统(Bio Rad),Nikon eclipce 50i正置显微镜(Nikon)。
1.2 动物模型与取材大鼠适应性饲养1周后,按随机数字表法分为平原对照组、缺氧1 d组和缺氧7 d组,每组18只。大鼠均单只单笼喂养,自由饮水进食。缺氧大鼠置低压舱中,以200 m/min速度匀速“上升”至模拟海拔5 000 m高原,平原对照组大鼠在舱外平原环境饲养。实验者每天进入模拟海拔5 000 m的低压舱记录缺氧7 d组大鼠每24小时摄食量及体质量,同时记录平原对照组大鼠摄食量和体质量。平原对照组大鼠在平原取材,缺氧大鼠在模拟海拔5 000 m低压舱中取材。以5%水合氯醛麻醉,按随机数字表,一半大鼠直接断头,取出脑组织,剥离下丘脑,保存于液氮中,用于CB1受体、c-Fos Western blot检测;另一半大鼠自左心室穿刺,依次注入PBS液150 mL和4%多聚甲醛200 mL,取出全脑,保存于4%多聚甲醛中用于免疫组织化学染色。
1.3 Western blot检测CB1受体和c-Fos蛋白表达从液氮中取出下丘脑,称质量后,按组织质量(mg)、裂解液体积(μL)和蛋白酶抑制剂体积(μL)以1 ∶10 ∶0.1的比例加入匀浆器中,使其终浓度为10 mmol/L。将样本于冰上充分匀浆后,4 ℃ 12 000 r/min 离心20 min,取上清液用BCA法测定蛋白浓度。将上清液与5×上样缓冲液以4 ∶1体积比例混合后,100 ℃水浴变性5 min。变性后的样本经SDS-PAGE(10%分离胶和5%浓缩胶)电泳分离后,湿转至孔径0.45 μm的PVDF膜上。PVDF膜于含有5%牛奶TBST的封闭液中室温封闭1 h,分别以兔抗人CB1受体多克隆抗体(1 ∶200)、小鼠抗人c-Fos抗体(1 ∶500)和小鼠抗人β-actin抗体(1 ∶2 000)4 ℃孵育16 h,用辣根过氧化物酶标记山羊抗兔IgG(1 ∶1 600)和辣根过氧化物酶标记山羊抗小鼠IgG(1 ∶2 000)室温孵育 1 h,每次孵育完成后均用TBST液漂洗3次,每次10 min。将膜与化学发光试剂室温孵育1 min 后,在凝胶成像系统中曝光照片。用Quantity One 软件分析光密度,计算CB1受体、c-Fos蛋白条带与内参β-actin条带的光密度比值。
1.4 免疫组织化学染色观察CB1受体和c-Fos蛋白表达经4%多聚甲醛灌注的大鼠脑组织移入用0.1 mol/L PBS配制的30%蔗糖溶液(pH 7.4)中,4 ℃保存,待脑组织下沉后,用冰冻切片机沿大脑冠状面连续切片(厚50 μm),进行免疫组织化学染色。切片经PBS漂洗,3%双氧水封闭后,加入兔抗人CB1受体多克隆抗体、小鼠抗人c-Fos单克隆抗体4 ℃孵育过夜,PBS漂洗后,加入生物素化山羊抗兔/山羊抗小鼠IgG、辣根过氧化酶标记链亲合素,使用DAB工作液显色后脱水封闭,在显微镜下观察并拍照。用NIS-elements D 3.2软件处理图像,使用WCIF Image J软件对各组下丘脑不同核团CB1受体、c-Fos阳性细胞计数。
1.5 统计学方法采用SSPS 13.0统计软件,计量资料以x±s表示。体质量、摄食量比较采用双因素方差分析,组内、组间两两比较采用SNK-q检验。其他数据比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
2 结果 2.1 大鼠在平原和模拟海拔5 000 m低压舱中的摄食量和体质量大鼠在模拟海拔5 000 m高原环境中,第1天的摄食量降至平原对照组的31.5%,第2天为平原对照组的62.1%;至缺氧第3天,大鼠摄食量恢复至平原对照组水平。此后,大鼠摄食量保持在与平原对照组相似的水平。大鼠缺氧后,体质量显著减少;至缺氧第2天体质量降至最低;此后大鼠体质量呈逐日增加趋势,但始终低于平原对照组(图 1)。

|
| a:P<0.05,与缺氧组比较;b:P<0.05,与缺氧前比较 A:摄食量变化;B:体质量变化 图 1 平原和缺氧1~7 d大鼠摄食量和体质量变化 |
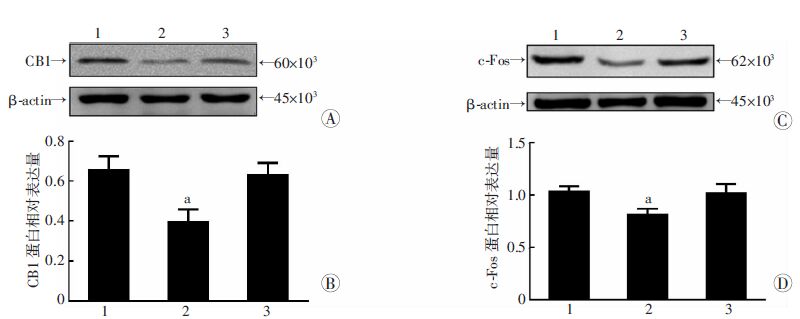
2.2 Western blot检测各组大鼠下丘脑CB1、c-Fos的表达
Western blot检测显示,缺氧1 d后,大鼠下丘脑内CB1、c-Fos表达较平原对照组减少,差异有统计学意义(P<0.05)。缺氧7 d后,大鼠下丘脑CB1、c-Fos表达较缺氧1 d组增加,差异有统计学意义(P<0.05),但与平原对照组比较差异无统计学意义(P>0.05)。见图 2。
|
| 1:平原对照组;2:缺氧1 d组;3:缺氧7 d组;A:Western blot检测下丘脑CB1表达;B:半定量分析下丘脑CB1表达 a:P<0.05,与平原对照组及缺氧7 d组比较;C: Western blot检测下丘脑c-Fos表达;D:半定量分析下丘脑c-Fos表达 a:P<0.05,与平原对照组及缺氧7 d组比较 图 2 Western blot 检测大鼠下丘脑CB1、c-Fos的表达 |
2.3 免疫组织化学观察大鼠下丘脑各核团中c-Fos表达
如图 3所示,缺氧1 d后,大鼠弓状核(arcuate nucleus,ARC)、下丘脑腹外侧区(later hypothalamic area,LH)和下丘脑腹内侧核(ventromedial hypothalamic nucleus,VMH)中c-Fos表达较平原对照组降低,差异有统计学意义(P<0.05)。但在缺氧第7天时,上述脑区c-Fos表达恢复至平原对照组水平(P>0.05)。平原对照组、缺氧1 d组和缺氧7 d组下丘脑背内侧核(dorsal medial nucleus of hypothalamus,DMH)中c-Fos表达差异无统计学意义(P>0.05)。

|
| 图 3 ABC 法染色观察各组大鼠下丘脑各核团中c-Fos表达变化 |
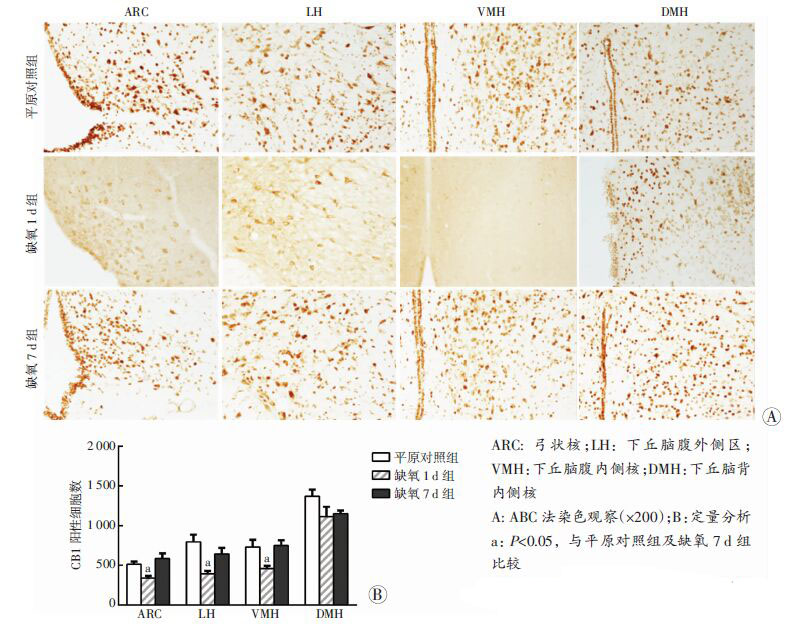
2.4 免疫组织化学观察大鼠下丘脑各核团中CB1受体表达
如图 4所示,缺氧1 d后,ARC、LH和VMH中CB1表达较平原对照组降低,差异有统计学意义(P<0.05);而DMH中CB1受体表达与平原对照组比较差异无统计学意义(P>0.05)。随着缺氧时间的延长,ARC、LH和VMH中CB1受体表达逐渐恢复,至缺氧第7天时下丘脑各核团CB1受体表达与平原组对照组相比差异无统计学意义(P>0.05)。
|
| 图 4 ABC 法染色观察各组大鼠下丘脑各核团中CBI表达变化 |
3 讨论
食欲减少、体质量减少是世居平原人群进入高原后劳动能力显著降低的重要原因,也可能是临床缺氧相关疾病患者进食量减少的重要原因。研究高原缺氧降低食欲的机制,对于这些疾病的治疗,特别是对于寻找提高急进高原人群劳动能力的措施提供可能的靶点。
下丘脑在调节日常摄食行为和能量代谢中起重要作用[1]。当机体需要补充能量时,下丘脑便产生“饥饿”信号,促使生物个体产生摄食行为;相应的,当机体已获得足够的能量后,下丘脑便产生“饱”信号,生物个体停止进食。下丘脑包含解剖学定义明确的,与食欲、摄食、体质量调节相关的核团:弓状核、下丘脑腹外侧区、下丘脑腹内侧核、下丘脑背内侧核和室旁核。其中弓状核被认为具有调节下丘脑其他与摄食相关核团的功能[1-10]。通常认为,下丘脑腹外侧区是摄食中枢,腹内侧核是饱中枢,而背内侧核不仅参与进食的昼夜节律调节,同时也参与应激、心血管、体温等生理活动的调节[11]。Wu等[12-13]研究发现,大鼠禁食后,弓状核等摄食相关核团c-Fos表达增加,饱食后,c-Fos表达下调,表明c-Fos表达与食欲调控密切相关。本研究Western blot检测结果显示,大鼠缺氧1 d时,下丘脑c-Fos表达显著减少,缺氧7 d后恢复。进一步应用免疫组织化学方法检测,发现缺氧1 d时下丘脑c-Fos 表达减少主要是弓状核、腹外侧区、腹内侧核区域的c-Fos表达减少,而下丘脑背内侧核c-Fos表达变化不大。以上结果表明,缺氧诱导的食欲下降与下丘脑摄食中枢c-Fos的表达减少有关。
研究[14-16]证明,CB1受体在摄食行为调节中起重要作用。激活动物下丘脑CB1受体[14]后,动物摄食量增加,即使是已经饱食的大鼠,使用CB1受体激动剂后,也会促进其进食。相反,采用基因敲除技术使CB1受体表达下降[15],或者给予CB1受体抑制剂SR141716后[16],动物摄食减少,体质量减轻。本研究免疫组化结果显示,CB1受体在下丘脑各核团上广泛表达。Western blot检测结果显示,缺氧1 d时,大鼠下丘脑内CB1受体表达显著减少,缺氧第7天时恢复。免疫组织化学结果显示,缺氧1 d时,大鼠下丘脑弓状核、腹外侧区和腹内侧核CB1受体表达显著减少,而背内侧核无明显变化;缺氧7 d时,弓状核、下丘脑腹外侧区和腹内侧核CB1受体表达恢复。Soria-Gomez等[17]报道,给予CB1受体激动剂后,大鼠摄食量显著增加,同时下丘脑与摄食相关核团中c-Fos表达上调,提示CB1受体可能通过影响摄食中枢c-Fos的表达调控大鼠食欲。此外,本研究显示,下丘脑背内侧核CB1受体和c-Fos的表达无显著变化,可能与背内侧核主要参与食欲的昼夜节律、心血管、体温调节,而较少参与即时食欲的调节有关。但缺氧抑制CB1受体表达的机制及缺氧时各核团间相互调节的机制尚不清楚。
综上所述,急性缺氧时,大鼠摄食量显著减少、体质量显著减轻,同时下丘脑CB1和c-Fos表达显著降低。随着缺氧时间的延长,大鼠摄食量逐渐恢复、体质量逐渐增加,下丘脑CB1受体和c-Fos的表达恢复。因此缺氧不同时段大鼠摄食量的变化与大鼠下丘脑CB1和c-Fos表达变化趋势是一致的,这表明急性缺氧大鼠摄食减少与下丘脑CB1及c-Fos表达减少有关。
| [1] | Rui L. Brain regulation of energy balance and body weight[J]. Rev Endocr Metab Disord,2013, 14 (4) : 387 –407. DOI:10.1007/s11154-013-9261-9 |
| [2] | Osei-Hyiaman D, Depetrillo M, Harvey-White J, et al. Cocaine- and amphetamine-related transcript is involved in the orexigenic effect of endogenous anandamide[J]. Neuroendocrinology,2005, 81 (4) : 273 –282. DOI:10.1159/000087925 |
| [3] | Gamber K M, Macarthur H, Westfall T C. Cannabinoids augment the release of neuropeptide Y in the rat hypothalamus[J]. Neuropharmacology,2005, 49 (5) : 646 –652. DOI:10.1016/j.neuropharm.2005.04.017 |
| [4] | Hamad N, Travis S P. Weight loss at high altitude: pathophysiology and practical implications[J]. Eur J Gastroenterol Hepatol,2006, 18 (1) : 5 –10. DOI:10.1097/00042737-200601000-00002 |
| [5] | Westerterp-Planteng M S, Westerterp K R, Rubbens M, et al. Appetite at “high altitude” : a simulated ascent of Mount Everes[J]. J Appl Physiol (1985),1999, 87 (1) : 391 –399. |
| [6] | Westerterp K R. Energy and water balance at high altitude[J]. News Physiol Sci,2001, 16 : 134 –137. |
| [7] | Rose M S, Houston C S, Fulco C S, et al. Operation Everest. II: Nutrition and body composition[J]. J Appl Physiol (1985),1988, 65 (6) : 2545 –2551. |
| [8] | Boyer S J, Blume F D. Weight loss and changes in body composition at high altitude[J]. J Appl Physiol Respir Environ Exerc Physiol,1984, 57 (5) : 1580 –1585. |
| [9] | Lippl F J, Neubauer S, Schipfer S, et al. Hypobaric hypoxia causes body weight reduction in obese subjects[J]. Obesity (Silver Spring),2010, 18 (4) : 675 –681. DOI:10.1038/oby.2009.509 |
| [10] | Williams G, Bing C, Cai X J, et al. The hypothalamus and the control of energy homeostasis: different circuits, different purposes[J]. Physiol Behav,2001, 74 (4/5) : 683 –701. |
| [11] | Fontes M A, Xavier C H, de-Menezes R C, et al. The dorsomedial hypothalamus and the central pathways involved in the cardiovascular response to emotional stress[J]. Neuroscience,2011, 184 : 64 –74. DOI:10.1016/j.neuroscience.2011.03.018 |
| [12] | Wu Q, Lemus M B, Stark R, et al. The temporal pattern of cfos activation in hypothalamic, cortical, and brainstem nuclei in response to fasting and refeeding in male mice[J]. Endocrinology,2014, 155 (3) : 840 –853. DOI:10.1210/en.2013-1831 |
| [13] | Olson B R, Freilino M, Hoffman G E, et al. c-Fos Expression in Rat Brain and Brainstem Nuclei in Response to Treatments That Alter Food Intake and Gastric Motility[J]. Mol Cell Neurosci,1993, 4 (1) : 93 –106. DOI:10.1006/mcne.1993.1011 |
| [14] | Jamshidi N, Taylor D A. Anandamide administration into the ventromedial hypothalamus stimulates appetite in rats[J]. Br J Pharmacol,2001, 134 (6) : 1151 –1154. DOI:10.1038/sj.bjp.0704379 |
| [15] | Di-Marzo V, Goparaj S K, Wang L, et al. Leptin-regulated endocannabinoids are involved in maintaining food intake[J]. Nature,2001, 410 (6830) : 822 –825. DOI:10.1038/35071088 |
| [16] | Colombo G, Agabio R, Diaz G, et al. Appetite suppression and weight loss after the cannabinoid antagonist SR 141716[J]. Life Sci,1998, 63 (8) : PL113 –PL117. DOI:10.1016/s0024-3205(98)00322-1 |
| [17] | Soria-Gomez E, Matias I, Rueda-Orozco P E, et al. Pharmacological enhancement of the endocannabinoid system in the nucleus accumbens shell stimulates food intake and increases c-Fos expression in the hypothalamus[J]. Br J Pharmacol,2007, 151 (7) : 1109 –1116. DOI:10.1038/sj.bjp.0707313 |



