2. 400038 重庆,第三军医大学西南医院医学检验系临床微生物及免疫学教研室
2. Department of Clinical Microbiology and Immunity, Faculty of Medical Laboratory Sciences, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
结肠癌是常见的消化道肿瘤,其发病率和死亡率均居恶性肿瘤前列,严重威胁人类健康[1],约1/3的结肠癌患者确诊时已处于进展期。肿瘤细胞的侵袭和转移能力与患者预后密切相关,上皮间质转化(epithelial to mesenchymal transition,EMT)是结直肠癌细胞获得转移能力的关键事件[2],因而研究结肠癌细胞EMT发生的分子机制具有重要意义。EMT是指具有极性的上皮细胞转换成能够在基质间自由移动的间质细胞的过程。EMT以上皮细胞特性的丧失和间质细胞特性的获得为关键特征[3]。大量研究证实结肠癌细胞一旦发生EMT,其侵袭和转移能力显著增强[4-6]。
干扰素调节因子4结合蛋白(interferon regulatory factor-4 binding protein,IBP)是具有鸟嘌呤核苷酸交换因子(guanine nucleotide exchange factors,GEFs)活性的Rho GTPase调控分子[7],GEF通过催化GDP的释放和GTP的结合激活Rho GTPase。Rho GTPase通过调节细胞骨架重构和钙粘蛋白的转录后调控,在EMT过程中发挥关键调控作用[8]。Rho GTPase家族中Rac1、RhoA和Cdc42异常与结肠癌的发生发展关系极为密切[5, 9]。目前对IBP功能的研究主要集中在免疫系统:参与TCR信号刺激下T细胞免疫突触的形成[10];对维持免疫内环境的稳定发挥重要作用,IBP 敲除小鼠表现出自身免疫性疾病症状[11]。我们前期研究证实IBP通过激活Rac1、RhoA和Cdc42调节乳腺癌细胞EMT过程,促进乳腺肿瘤细胞转移[12]。通过临床样本分析发现IBP与结肠癌细胞分化程度、淋巴结转移密切相关[13]。本研究拟通过干预结肠癌细胞HT-29和HCT116中IBP的表达,观察其对结肠癌细胞EMT、增殖和转移的影响,初步探讨IBP是否参与结肠癌细胞EMT过程进而影响肿瘤细胞的转移。
1 材料与方法 1.1 材料与试剂人结肠癌细胞株HT-29、HCT116、SW480、SW620引自美国ATCC标准细胞株。RPMI1640、高糖DMEM培养基、胎牛血清购自Gibco公司;RIPA裂解液、BCA蛋白定量试剂、SDS-PAGE试剂购自上海碧云天公司;兔抗GAPDH、E-cadherin、ZO-1、Snail、MMP2、MMP9购自CST公司;兔抗Fibronectin购自Sigma公司;IBP单克隆抗体为实验室制备[14];HRP标记山羊抗鼠/兔 IgG抗体购自北京中杉金桥;ECL试剂购自Millipore公司;胶片购自柯达公司;MTT、DMSO购自Sigma公司;Matrigel 购自BD公司;Transwell小室购自Costar公司。
1.2 IBP质粒、干扰慢病毒制备IBP全长ORF插入pcDNA3.1 (+)质粒构建表达质粒pcDNA3.1 (+)-IBP,pcDNA3.1 (+)质粒作为阴性对照,根据生物信息学分析针对IBP基因 (NM_022047)设计RNA干扰序列,靶点序列为:5′-GGAACAGTATGCTCTCCAATC-3′;干扰序列为:5′-TGGAACAGTATGCTCTCCAATCTTCAGAGATTGGAGAGCATA-CTGTTCCTT-3′。IBP干扰慢病毒由上海吉玛制药技术有限公司制备。穿梭质粒和包装质粒共转染入293T细胞,收集细胞培养上清,超速离心浓缩病毒,-80 ℃保存。
1.3 细胞培养与细胞株构建HCT116和HT-29细胞使用高糖DMEM培养基培养。HT-29细胞在6孔板中细胞汇合率90%左右开始转染,Opti-MEM培养基洗涤细胞2次,脂质体/质粒复合体作用细胞6 h后,更换为完全培养基。转染24 h后,按照1 ∶10的比例接种细胞于培养瓶,1 mg/mL G418筛选14 d,得到稳定转染细胞株。生长良好的HCT116肿瘤细胞按照每孔5×104个接种至24孔板,培养18 h待细胞贴壁。感染细胞采用MOI值10。用完全培养基稀释病毒液并添加终浓度为5 μg/mL的Polybrene。持续感染18 h时后更换新鲜的完全培养基。待细胞长满培养孔,做1 ∶10稀释后移入培养瓶培养,并加入1 μg/mL Puromycin进行筛选。筛选时间14 d,得到稳定感染细胞株。SW480和SW620细胞使用RPMI1640培养基培养。
1.4 Western blot 检测蛋白表达水平冰冷的PBS洗涤细胞2次,加入RIPA细胞裂解液,冰上充分裂解,15 000×g离心10 min,留上清。 BCA试剂盒测定样本蛋白浓度,加入适量5×蛋白上样 缓冲液,100 ℃处理5 min,-80 ℃保存备用。SDS-PAGE凝胶电泳分离样品蛋白,恒流0.25 A转印210 min,PVDF 膜用5%脱脂奶粉膜封闭1 h,一抗孵育4 ℃过夜(鼠抗IBP 1 ∶2 000,兔抗E-cadherin、ZO-1、Snail、Fibronectin、MMP2、MMP9、GAPDH 1 ∶10 000),TBST洗涤3×15 min,HRP标记山羊抗鼠/兔IgG(1 ∶10 000)室温孵育1 h,TBST洗涤6次×10 min,ECL试剂作用5 min,胶片曝光检测。
1.5 MTT细胞增殖实验对数期细胞加入96孔板,每孔2×103个细胞,过夜培养后细胞贴壁更换新鲜培养液,继续培养1~5 d。每孔加入20 μL MTT试剂(5 mg/mL),继续培养4 h后弃培养液,每孔加入150 μL DMSO终止反应并振荡 15 min让结晶充分溶解混匀,酶标仪490 nm读取光密度值[D(490)],每组实验设置3复孔,重复3次,绘制曲线。
1.6 Transwell细胞迁移实验细胞生长至对数期,无血清饥饿过夜。无血清培养液调整细胞浓度至5×106/mL,每个小室接种0.2 mL 细胞悬液,24孔板中每孔加入0.5 mL相应的含10%FBS的完全培养基,Transwell小室(8 μm)置于24孔板中,6或12 h后取出Transwell小室,棉签擦去内层细胞,4%多聚甲醛固定10 min,苏木精染色5 min。光镜下随机计数5个视野,计算平均细胞数,每组设置复孔3个。
1.7 Transwell细胞侵袭实验Transwell小室(8 μm)置于24孔板中,加入50 μL Matrigel (Matrigel ∶DMEM=1 ∶9),在小室底部铺均匀,37℃凝结1 h,24孔板中每孔加入0.5 mL相应的含10%FBS的完全培养基。对数期细胞以无血清培养基洗涤一次,调整细胞浓度至5×105/mL,每个小室接种0.2 mL细胞悬液,侵袭时间48 h。取出Transwell小室,计数方法同上。
1.8 统计学分析采用SPSS 13.0软件进行统计分析,两组间比较采用t检验,多组间比较采用单因素方差分析。检验水准α=0.05。
2 结果 2.1 IBP真核表达质粒与IBP干扰慢病毒构建重组质粒pcDNA3.1 (+)-IBP经酶切鉴定和测序确认插入的IBP基因完全正确。基于pGL V10/U6/RFP/Puro 穿梭质粒构建的IBP干扰慢病毒由上海吉玛制药技术有限公司鉴定并合成。
2.2 结肠癌细胞株IBP和E-cadherin表达水平分析Western blot检测人结肠癌细胞株HT-29、SW480、SW620、HCT116中IBP和E-cadherin的表达。结肠癌细胞中均有不同水平的IBP和E-cadherin表达。IBP表达水平由少到多依次为HT-29、SW480、SW620、HCT116,E-cadherin的表达水平由少到多依次为SW620、HCT116、SW480、HT-29,提示IBP表达水平可能与EMT的发生呈正相关。SW480和SW620细胞来源于同一患者,转移灶分离株SW620细胞中IBP表达水平明显高于原发灶分离株SW480(图 1),提示肿瘤发生转移的过程中IBP表达水平提高。

|
| 1:HT-29;2:SW480;3:SW620;4:HCT116 图 1 Western blot检测结肠癌细胞株IBP和E-cadherin表达 |
2.3 IBP对结肠癌细胞EMT标志物表达的影响
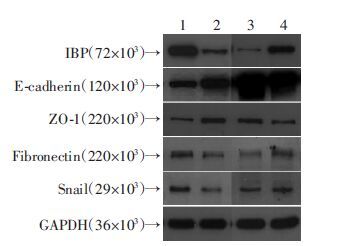
构建了IBP过表达细胞HT-29-IBP、IBP沉默细胞HCT116-shIBP作为实验组,对照组(NC)分别为HT-29-NC细胞和HCT116-NC细胞。 Western blot检测结果显示HCT116-shIBP细胞中IBP表达水平较HCT116-NC 细胞显著降低(抑制率大于80%),而且上皮标志物E-cadherin和ZO-1表达水平较对照组细胞明显提高,间质分子Fibronectin和转录因子Snail表达水平较对照组细胞明显降低;HT-29-IBP细胞的IBP表达水平较HT-29-NC细胞显著升高,其E-cadherin和ZO-1表达水平较对照组细胞降低,间质分子Fibronectin较对照组细胞表达水平升高(图 2)。这提示IBP的沉默与过表达可能分别在结肠癌细胞EMT的发生中会发挥抑制和促进的作用。
|
| 1:HCT116-NC;2:HCT116-shIBP;3:HT-29-NC;4:HT-29-IBP 图 2 Western blot检测IBP对结肠癌细胞EMT相关分子表达的影响 |
2.4 IBP对结肠癌细胞增殖的影响
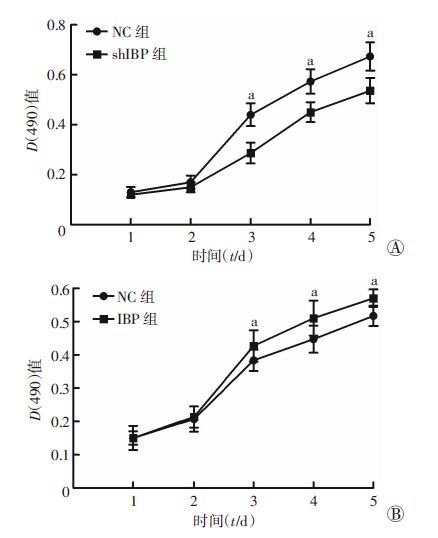
实验组HCT116-shIBP细胞增殖的速度较对照组细胞明显降低,实验组HT-29-IBP细胞增殖速度较对照组细胞明显增加(P <0.05,图 3)。
|
| A: HCT116; B: HT-29 a: P <0.05,与NC组比较 图 3 MTT检测IBP对结肠癌细胞增殖速度的影响 |
2.5 IBP对结肠癌细胞迁移和侵袭能力的影响
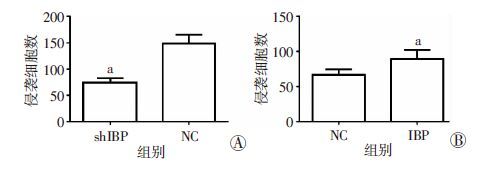
实验组HCT116-shIBP细胞穿过聚碳酸酯膜的数量明显低于对照组细胞(P <0.05),说明降低IBP的表达水平会降低细胞的迁移和侵袭能力。与之相对应的是,实验组HT-29-IBP细胞穿过聚碳酸酯膜的细胞 数量高于对照组细胞,差异具有统计学意义(P <0.05),见图 4、5。说明外源性的IBP提高了HT-29细胞的迁移和侵袭能力。

|
| A: HCT116; B: HT-29 a:P <0.05,与NC组比较 图 4 Transwell迁移实验检测IBP对结肠癌细胞迁移能力的影响 |
|
| A: HCT116; B: HT-29 a: P <0.05,与NC组比较 图 5 Transwell侵袭移实验检测IBP对结肠癌细胞侵袭能力的影响 |
2.6 IBP对结肠癌细胞MMP2和MMP9表达的影响
实验组HCT116-shIBP细胞中MMP2和MMP9的表达水平明显低于对照组细胞,实验组HT-29-IBP细胞MMP2蛋白表达较对照组细胞表达水平升高,但MMP9无明显变化(图 6)。

|
| 1:HCT116-NC;2:HCT116-shIBP;3:HT-29-NC;4:HT-29-IBP 图 6 Western blot检测IBP对结肠癌细胞MMP2和MMP9表达的影响 |
3 讨论
结肠癌的发病率在我国居第3位,且发病率仍在增长。由于早期症状不明显,很多患者确诊时已经属于中晚期,多已经出现远处转移[15]。因此,研究结肠癌发生和转移的机制具有重要意义。
IBP由人淋巴结cDNA文库中筛选出,分子量约75Kd,编码基因位于染色体6p21.31,与SWAP-70高度同源,SWAP-70在B细胞激活和Ig亚类转换中具有重要作用[16]。前期研究证明IBP在免疫系统中具有重要的功能,如:IBP参与T细胞分化和免疫突触形成的调控[10, 17];IBP参与免疫自稳的维系,IBP缺失小鼠表现出自身免疫性疾病症状[11, 18];IBP具有与其他GEF相似的DH结构域[7],能够激活Rho GTPase家族中Rac1、RhoA和Cdc42进而参与众多生理病理过程的调控[18-20]。但IBP与其他Rho-GEF分子(如Vav1、Tiam1)的DH结构域同源性极低,说明IBP可能代表一类新的GEF分子。Hotfilder等[21]发现IBP在软骨肉瘤中差异表达,提示IBP可能在肿瘤中具有重要作用。本课题组前期研究证实IBP通过激活Rac1、RhoA和Cdc42促进乳腺癌细胞EMT过程,并证实IBP与结肠癌分化程度和淋巴转移密切相关。本研究拟通过观察IBP表达水平对结直肠癌细胞EMT分子表达水平和转移能力的影响,探讨IBP在结直肠癌细胞EMT发生中的作用。
本研究中选取的结肠癌细胞株均有不同水平的IBP表达,同一来源的SW620细胞(淋巴结转移灶分离)IBP表达水平明显高于SW480细胞(原发灶分离株),提示IBP表达水平可能与结直肠癌的转移能力有关。通过检测结直肠癌细胞株中上皮标志物E-cadherin的表达,结果显示IBP表达水平高的细胞E-cadherin表达水平低,提示IBP与E-cadherin负相关。E-cadherin在细胞极性、细胞连接和上皮组织完整性的维持中具有重要作用,肿瘤发生发展常伴随着E-cadherin的缺失和异常;紧密连接蛋白ZO-1对维持上皮极性同样重要。间叶标志物Fibronectin在结肠癌细胞黏附、浸润和转移中发挥重要作用。本研究证实IBP抑制结肠癌细胞中E-cadherin和ZO-1表达,促进间叶标志物Fibronectin表达。Snail是含锌指结构的核转录因子,对E-cadherin的转录表达起到直接抑制作用,抑制IBP明显降低了结肠癌细胞中Snail的表达水平,说明IBP通过影响Snail参与E-cadherin的表达调控进而促进结肠癌细胞EMT的发生。增殖速度快是肿瘤细胞重要特点,本研究证实IBP具有促进结肠癌细胞增殖的作用。迁移和侵袭能力是肿瘤细胞发生远处转移的必要条件。胶原酶MMP2和明胶酶MMP9是基质金属蛋白酶(MMPs)家族成员,与肿瘤的侵袭和转移关系及其密切,MMPs能够降解肿瘤细胞外的基质和基底膜,帮助肿瘤细胞向邻近组织浸润、侵袭,促进肿瘤细胞发生转移[22-23]。本研究证实IBP通过调控MMP2和MMP9的表达促进结肠癌细胞的迁移和侵袭。具体的调控机制仍需进一步研究。
本研究结果初步提示了IBP可能通过促进结直肠癌细胞EMT,并显著增强结肠癌细胞的迁移和侵袭能力,进一步研究IBP促进结肠癌转移的具体作用机制,有可能为研究结肠肿瘤发生、发展提供新的思路。
| [1] | Torre L A, Bray F, Siegel R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin,2015, 65 (2) : 87 –108. DOI:10.3322/caac.21262 |
| [2] | Thiery J P. Epithelial-mesenchymal transitions in tumour progression[J]. Nat Rev Cancer,2002, 2 (6) : 442 –454. DOI:10.1038/nrc822 |
| [3] | Tiwari N, Gheldof A, Tatari M, et al. EMT as the ultimate survival mechanism of cancer cells[J]. Semin Cancer Biol,2012, 22 (3) : 194 –207. DOI:10.1016/j.semcancer.2012.02.013 |
| [4] | Bates R C, Goldsmith J D, Bachelder R E, et al. Flt-1- dependent survival characterizes the epithelial-mesenchymal transition of colonic organoids[J]. Curr Biol,2003, 13 (19) : 1721 –1727. |
| [5] | Gulhati P, Bowen K A, Liu J, et al. mTORC1 and mTORC2 regulate EMT, motility, and metastasis of colorectal cancer via RhoA and Rac1 signaling pathways[J]. Cancer Res,2011, 71 (9) : 3246 –3256. DOI:10.1158/0008-5472.CAN-10-4058 |
| [6] | Bowen K A, Doan H Q, Zhou B P, et al. PTEN loss induces epithelial--mesenchymal transition in human colon cancer cells[J]. Anticancer Res,2009, 29 (11) : 4439 –4449. |
| [7] | Mavrakis K J, McKinlay K J, Jones P, et al. DEF6, a novel PH-DH-like domain protein, is an upstream activator of the Rho GTPases Rac1, Cdc42, and RhoA[J]. Exp Cell Res,2004, 294 (2) : 335 –344. DOI:10.1016/j.yexcr.2003.12.004 |
| [8] | Yilmaz M, Christofori G. EMT, the cytoskeleton, and cancer cell invasion[J]. Cancer Metastasis Rev,2009, 28 (1/2) : 15 –33. DOI:10.1007/s10555-008-9169-0 |
| [9] | Vega F M, Ridley A J. Rho GTPases in cancer cell biology[J]. FEBS Lett,2008, 582 (14) : 2093 –2101. DOI:10.1016/j.febslet.2008.04.039 |
| [10] | Becart S, Charvet C, Canonigo-Balancio A J, et al. SLAT regulates Th1 and Th2 inflammatory responses by controlling Ca2+/NFAT signaling[J]. J Clin Invest,2007, 117 (8) : 2164 –2175. DOI:10.1172/JCI31640 |
| [11] | Fanzo J C, Yang W, Jang S Y, et al. Loss of IRF-4-binding protein leads to the spontaneous development of systemic autoimmunity[J]. J Clin Invest,2006, 116 (3) : 703 –714. DOI:10.1172/JCI24096 |
| [12] | Zhang Z, Yang M, Chen R, et al. IBP regulates epithelial- to-mesenchymal transition and the motility of breast cancer cells via Rac1, RhoA and Cdc42 signaling pathways[J]. Oncogene,2014, 33 (26) : 3374 –3382. DOI:10.1038/onc.2013.337 |
| [13] | Zhang Z, Wang Q, Li P, et al. Overexpression of the Interferon regulatory factor 4-binding protein in human colorectal cancer and its clinical significance[J]. Cancer Epidemiol,2009, 33 (2) : 130 –136. DOI:10.1016/j.canep.2009.05.004 |
| [14] | Li P, Zhang Z, Wang Q, et al. The ectopic expression of IFN regulatory factor 4-binding protein is correlated with the malignant behavior of human breast cancer cells[J]. Int Immunopharmacol,2009, 9 (7/8) : 1002 –1009. DOI:10.1016/j.intimp.2009.04.008 |
| [15] | Chalya P L, McHembe M D, Mabula J B, et al. Clinicopathological patterns and challenges of management of colorectal cancer in a resource-limited setting: a Tanzanian experience[J]. World J Surg Oncol,2013, 11 : 88 . DOI:10.1186/1477-7819-11-88 |
| [16] | Gupta S, Lee A, Hu C, et al. Molecular cloning of IBP, a SWAP-70 homologous GEF, which is highly expressed in the immune system[J]. Hum Immunol,2003, 64 (4) : 389 –401. |
| [17] | Tanaka Y, Bi K, Kitamura R, et al. SWAP-70-like adapter of T cells, an adapter protein that regulates early TCR-initiated signaling in Th2 lineage cells[J]. Immunity,2003, 18 (3) : 403 –414. |
| [18] | Canonigo-Balancio A J, Fos C, Prod’homme T, et al. SLAT/Def6 plays a critical role in the development of Th17 cell-mediated experimental autoimmune encephalomyelitis[J]. J Immunol,2009, 183 (11) : 7259 –7267. DOI:10.4049/jimmunol.0902573 |
| [19] | Goudevenou K, Martin P, Yeh Y J, et al. Def6 is required for convergent extension movements during zebrafish gastrulation downstream of Wnt5b signaling[J]. PLoS One,2011, 6 (10) : e26548 . DOI:10.1371/journal.pone.0026548 |
| [20] | Chen Q, Gupta S, Pernis A B. Regulation of TLR4- mediated signaling by IBP/Def6, a novel activator of Rho GTPases[J]. J Leukoc Biol,2009, 85 (3) : 539 –543. |
| [21] | Hotfilder M, Baxendale S, Cross M A, et al. Def-2, -3, -6 and -8, novel mouse genes differentially expressed in the haemopoietic system[J]. Br J Haematol,1999, 106 (2) : 335 –344. |
| [22] | Shuman-Moss L A, Jensen-Taubman S, Stetler-Stevenson W G. Matrix metalloproteinases: changing roles in tumor progression and metastasis[J]. Am J Pathol,2012, 181 (6) : 1895 –1899. DOI:10.1016/j.ajpath.2012.08.044 |
| [23] | Arvelo F, Cotte C. Metalloproteinases in tumor progression. Review[J]. Invest Clin,2006, 47 (2) : 185 –205. |



