树突状细胞(dendritic cell,DC)作为主要的专职抗原递呈细胞,是免疫反应中的信息交换中心。在处理入侵病原体和触发适应性免疫的过程中,树突状细胞组织复杂的膜转运事件[1, 2]。细胞内膜的动态转运包括囊泡出芽、运动、对接、融合等过程[3]。系统性整合这些过程的主要调节蛋白就是Rab GTP酶[4]。Rab GTP酶属于小GTP酶Ras超家族,现已知人类至少有60种Rab蛋白,定位于特殊的亚细胞囊泡区域参与特定的囊泡转运途径。
根据Rab GTP酶的序列和功能,可以将其分为10个亚家族,分别为Rab1、Rab3、Rab4、Rab5、Rab6、Rab8、Rab11、Rab22、Rab27、Rab40[5]。Rab40家族中的成员在结构上与其他Rab分子有着显著的不同,其中就包括C末端含有的SOCS结构域[6]。 有研究报道非洲爪蟾XRab40通过调节非经典Wnt通路影响胚胎发育[7]。Wnt信号通路对细胞命运、细胞迁移和细胞极性起到重要的调控作用[8] ,包括经典的Wnt/β-catenin依赖通路和非经典通路[9]。Wnt家族中的Wnt5a的过表达可以抑制浆细胞样树突状细胞(pDC)和经典树突状细胞(cDC)的分化,非经典Wnt通路对树突状细胞的分化进行负调节[10]。Notch通路可激活经典Wnt通路进而上调经典树突状细胞(cDC)的分化[11]。经典Wnt通路和非经典Wnt通路均对树突状细胞的分化有着重要的影响[10, 11]。因此,本研究拟通过在树突状细胞鉴定Rab40的相互作用蛋白,为阐述树突状细胞分化过程中Wnt通路的调控机制奠定基础。
串联亲和纯化是研究蛋白质相互作用的重要方法之一,传统的串联亲和纯化方法由于存在高的抗体蛋白背景以及纯化产物中会混入标签蛋白,会影响对纯化的蛋白质的质谱分析[12]。因而本研究建立基于eXact和6×His标签的新型串联亲和纯化方法,提高纯化效率及纯度。本研究在改进的串联亲和纯化技术的基础上,分析鉴定了树突状细胞中Rab40b和Rab40c的相互作用蛋白质,并通过免疫共沉淀验证了其相互作用,为进一步阐述Rab40在树突状细胞中的生物学功能提供依据。
1 材料与方法 1.1 材料及试剂FUGW-eXact-6×His质粒由本实验室保存,小鼠Rab40b和Rab40c的cDNA购自美国Openbiosystem公司;T4 DNA连接酶购自Promega公司,限制性内切酶(BamHⅠ、BsrGⅠ、EcoRⅠ)均购自New England Biolabs 公司;psPAX2和pMD2.G质粒由瑞士Trono实验室惠赠,DC2.4细胞由美国Dana Farber肿瘤研究所提供,胎牛血清、DMEM高糖培养基和RPMI1640培养基购自Gibco公司,DMSO购自Sigma公司;NP40购自Sigma公司,蛋白酶抑制剂购自Roche公司;蛋白裂解液和蛋白定量BCA试剂盒购自碧云天生物技术研究所,4%~12%预制凝胶购自Invitrogen公司,ElonginB、ElonginC和Cullin5抗体购自Santa Cruz Biotechnology公司,HRP标记的山羊抗兔IgG和HRP标记的驴抗山羊IgG,分别购自Cell Signaling和碧云天公司。
1.2 方法 1.2.1 构建融合蛋白基因eXact-6×His-EYFP-Rab40b和eXact-6×His-EYFP-Rab40c的表达载体上游引物5′-TATATATGTACATGAGCTCCCTGG-GCAGCC-3′,下游引物5′-CGGCGAATTCCTAAGAA-ATTTTGCAGCTGTTC-3′,扩增带有BsrGⅠ和EcoRⅠ 酶切位点的Rab40b;上游引物5′-TATATGTACA-TGGGCACCCAGGGCAGACCAG-3′,下游引物5′-CG-GCGAATTCCTAGGAGATCTTGCAGGGTCTC-3′,扩增带有BsrGⅠ/EcoRⅠ 酶切位点的Rab40c酶切后与FU-eXact-6×His-EYFP质粒连接,获得FUGW-eXact-6× His-EYFP-Rab40b和FUGW-eXact-6×His-EYFP-Rab40c 慢病毒表达载体。上游引物5′-GGATCCATGGTGTC-TAAGGGCGAAGA-3′,下游引物5′-GGTACCCTCGAG-ATCTGAGTCCGGAATT-3′,扩增带有BamHⅠ和Acc65Ⅰ酶切位点的TagRFP片段,酶切后与FUGW-eXact-6×His-EYFP-Rab40b连接,获得FUGW-eXact-6×His-RFP-Rab40b。
1.2.2 构建融合蛋白eXact-6×His-EYFP-Rab40b和eXact-6×His-EYFP-Rab40稳定表达的树突状细胞系通过磷酸钙沉淀转染293FT细胞的方法包装FUGW-eXact-6×His-EYFP-Rab40b、FUGW-eXact-6×His-EYFP-Rab40c和FUGW-eXact-6×His-RFP-Rab40b慢病毒。病毒感染DC2.4细胞,经流式细胞仪分选获得稳定表达eXact-6×His-EYFP-Rab40b和eXact-6× His-EYFP-Rab40c融合蛋白的细胞系。FUGW-eXact- 6×His-RFP-Rab40b和FUGW-eXact-6×His-EYFP-Rab40c 共转染DC2.4细胞系,获得共表达RFP-Rab40b和EYFP-Rab40c融合蛋白的DC2.4细胞系。共聚焦显微镜观察Rab40b和Rab40c的共定位。
1.2.3 串联亲和纯化质谱鉴定Rab40b和Rab40c的相互作用蛋白复合物eXact-6×His-EYFP-Rab40b和eXact-6×His-EYFP-Rab40c稳定表达的DC2.4细胞(3×107)经反复冻融裂解,10 000×g 离心15 min,收集上清,经eXact柱纯化,洗脱上清加入Ni-NTA柱纯化,将结合的Rab40b/c相互作用蛋白复合物酶解后,经纳米级液相色谱-串联质谱仪检测,质谱设定为:1 800 V毛细管电压,MS/MS扫描模式,50~1 500 m/z 范围内用4 Hz速率扫描。采用MASCOT 2.0软件鉴定蛋白,采用无偏比较指标算法(CompPASS)分析Rab40b/c的相互作用蛋白,并进行权重打分[13, 14]。经过统计学分析,设定高可信蛋白阈值为56.02,蛋白权重分值与高可信蛋白阈值的比值 (DN-Score)≥1的蛋白被认定为高可信的相互作用蛋白。
1.2.4 免疫共沉淀验证蛋白质相互作用提取 eXact-6×His-EYFP-Rab40b、eXact-6×His-EYFP-Rab40c 和eXact-6×His-EYFP的DC2.4细胞总蛋白,采用BCA法测定蛋白浓度。加入SDS上样缓冲液,95 ℃ 5 min 加热变性处理。取30 μg/孔蛋白样品上样,经4%~12%梯度预制凝胶电泳后将蛋白转移到PVDF膜上,5%脱脂奶粉封闭1 h,与ElonginB、ElonginC、Cullin5抗体4 ℃摇床孵育过夜,TBST洗3次,每次15 min,室温孵育HRP标记的抗体1 h,TBST洗3次,每次15 min,ECL化学发光显影。
2 结果 2.1 融合蛋白eXact-6×His-EYFP-Rab40b和eXact-6×His-EYFP-Rab40c稳定表达的树突状细胞系的构建构建的FUGW-eXact-6×His-EYFP-Rab40b和FUGW-eXact-6×His-EYFP-Rab40c质粒中,融合蛋白表达框如图 1A所示,经Acc65Ⅰ酶切鉴定,琼脂糖凝胶电泳显示质粒被切割成2kb和9kb两个片段(图 1B)。FUGW-eXact-6×His-EYFP-Rab40b/c质粒和psPAX2和pMD2.G质粒经CaCl2转染293FT细胞得到慢病毒,转染DC2.4细胞系,获得eXact-6×His标签分别和Rab40b、Rab40c融合蛋白稳定表达的树突状细胞系。以DC2.4细胞作为对照,检测分选后Rab40b和Rab40c表达的细胞系阳性率分别为99.8%和86.3%(图 1C)。
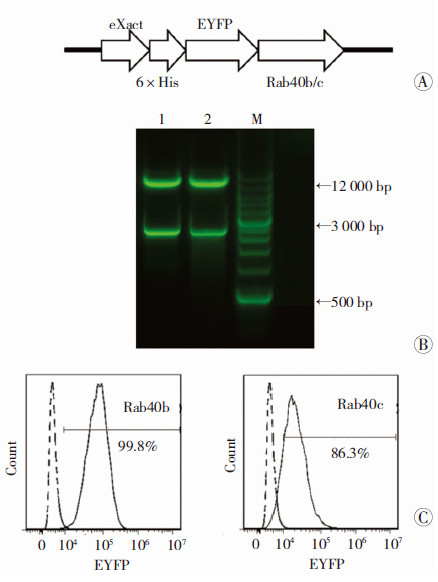 |
| A:融合蛋白表达框;B:质粒酶切鉴定电泳结果 1:Rab40b; 2:Rab40c; M:标准;C:流式细胞仪鉴定Rab40b(左)和Rab40c(右)表达 图 1 稳定表达Rab40b/c标签的树突状细胞系的构建 |
串联亲和纯化(图 2A)有20%的相互作用蛋白被捕获,经MASCOT 2.0软件分析和 CompPASS打分筛选后,获得26个Rab40b高可信相互作用蛋白和16个Rab40c高可信相互作用蛋。采用DAVID在线分析系统进行基因注释(Gene Ontology,GO)分析,根据生物学途径注释聚类分析显示Rab40b和Rab40c高可信相互作用蛋白富集在蛋白质和大分子降解代谢过程(富集打分3.23,图 2B)。
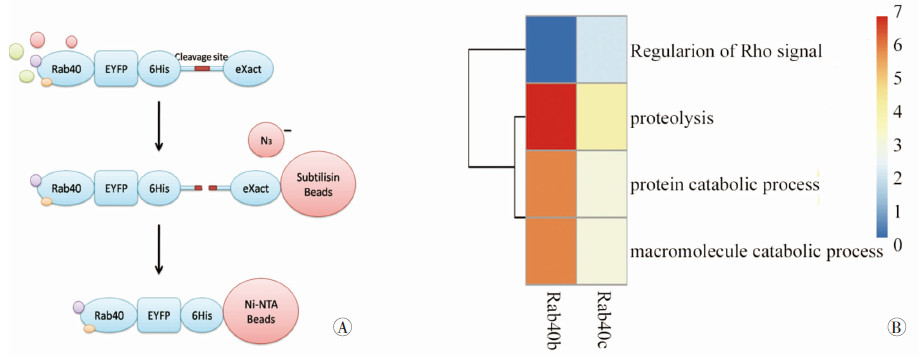 |
| 图 2 新型串联亲和纯化方案(A)及相互作用蛋白功能注释聚类(B) |
串联亲和质谱分析结果显示以Rab40b为诱饵蛋白时找到的相互作用蛋白中包括Rab40c(表 1),稳定共表达RFP-Rab40b和EYFP-Rab40c融合蛋白,共聚焦显微镜观察发现Rab40b在细胞质内呈现广泛分布,而Rab40c聚集分布并与Rab40b显著共聚(图 3)。免疫共沉淀结果显示Rab40b和Rab40c均与ElonginB、ElonginC、Cullin5存在相互作用(图 4)。
| 诱饵蛋白 | 相互作用蛋白 | 全称 | 权重打分(WD Score) | 权重打分与高可信蛋白阈值比值(DN-Score) |
| Rab40b | FBX4 | F-box protein 4 | 22179 | 395 |
| Rab40b | ELOB | transcription elongation factor B(SIII),polypeptide 2;ElonginB | 8205 | 146 |
| Rab40b | RB40C | Rab40c, member RAS oncogene family | 6114 | 109 |
| Rab40b | DPOG1 | polymerase (DNA directed), gamma | 2867 | 51 |
| Rab40b | CRYAB | crystallin, alpha B | 2296 | 40 |
| Rab40b | K0913 | RIKEN cDNA 2310021P13 gene | 2160 | 38 |
| Rab40b | SPAG5 | sperm associated antigen 5 | 2093 | 37 |
| Rab40b | ZZEF1 | zinc finger, ZZ-type with EF hand domain 1 | 1446 | 25 |
| Rab40b | SYAC | alanyl-tRNA synthetase | 1327 | 23 |
| Rab40b | ELOC | transcription elongation factor B (SIII), polypeptide 1;ElonginC | 1082 | 19 |
| Rab40b | KCNB1 | potassium voltage gated channel, Shab-related subfamily, member 1 | 1060 | 18 |
| Rab40b | FGD5 | FYVE, RhoGEF and PH domain containing 5 | 918 | 16 |
| Rab40c | ABCB8 | ATP-binding cassette, sub-family B (MDR/TAP), member 8 | 17786 | 317 |
| Rab40c | BICD1 | bicaudal D homolog 1 (Drosophila) | 13910 | 248 |
| Rab40c | RPAB2 | polymerase (RNA) II (DNA directed) polypeptide F | 11864 | 211 |
| Rab40c | ELOB | transcription elongation factor B (SIII), polypeptide 2;ElonginB | 7200 | 128 |
| Rab40c | OSR2 | odd-skipped related 2 | 1371 | 24 |
| Rab40c | DPYL5 | dihydropyrimidinase-like 5 | 928 | 16 |
| Rab40c | CUL5 | cullin 5 | 810 | 14 |
 |
| A:Rab40b在树突状细胞内的表达;B:Rab40c在树突状细胞内的表达;C:Rab40b和Rab40c在树突状细胞内的共表达 图 3 激光共聚焦显微镜镜观察Rab40b和Rab40c在树突状细胞内的分布 (×100) |
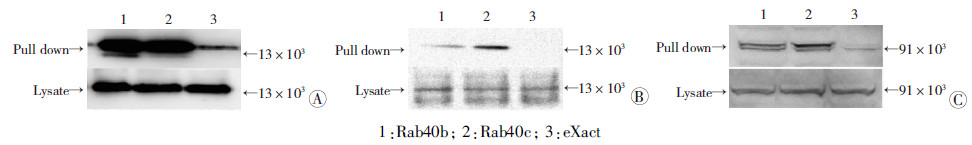 |
| 1:Rab40b; 2:Rab40c; 3:eXact 图 4 免疫共沉淀鉴定 Rab40b/c与ElonginB(A)、ElonginC(B)、Cullin5(C)相互作用 |
蛋白质通常形成蛋白质复合物执行其生物学功能,研究蛋白质相互作用研究对了解疾病发生、发展尤为重要[15]。基于串联亲和纯化质谱蛋白组学工具可在生理条件下鉴定蛋白相互作用复合物[16]。传统的串联亲和纯化标签由葡萄球菌蛋白A(ProtA)和钙调蛋白结合肽(CBP)组成,通过两步纯化获得蛋白质复合物[17, 18]。由于该方法存在效率较低的问题,本实验采用基于eXact和6×His标签的串联亲和纯化构建方法,首先在eXact标签纯化时加入叠氮化钠激活枯草杆菌蛋白酶精准切割融合蛋白的eXact标签,高效温和洗脱诱饵蛋白结合复合体,该方法有20%的相互作用蛋白被捕获,相较传统串联亲和纯化方法提高了纯化效率。
通过此串联亲和纯化方法,MASCOT 2.0软件鉴定获得Rab40b和Rab40c的相互作用蛋白分别为184个和163个,数据经过CompPASS打分筛选后,获得26个Rab40b高可信相互作用蛋白和16个Rab40c高可信相互作用蛋。Rab40b的26个高可信相互作用蛋白质中包含Rab40c,共聚焦结果显示Rab40b在细胞内广泛分布,Rab40c聚集分布且与Rab40b在空间上共定位。人少突胶质细胞系(HOG细胞)和人子宫颈癌细胞系(HeLa细胞)内Rab40c定位于靠近细胞核的囊泡结构,参与囊泡转运过程[19]。空间位置上的共定位及质谱鉴定二者具有相互作用提示了Rab40c在树突状细胞中通过与Rab40b形成复合物参与囊泡转运相关的过程。根据生物学途径进行DAVID在线聚类分析发现Rab40b和Rab40c相互作用蛋白主要参与蛋白质降解相关过程[20, 21],FBX4、RB40C、ASB2、CAND1、ELOB和ELOC这些Rab40的相互作用蛋白和CUL5、ELOB、UBE2O这些Rab40c的相互作用蛋白共同参与大分子和蛋白代谢过程等GO分类的生物学途径。其中与泛素化相关的蛋白质包括FBX4、ELOB、CUL5、CAND1、ELOC、UBE2O和ASB2。ElonginB/C-Cullin5-SOCS-box 蛋白是已知的E3泛素化连接酶,并且在鉴定的Rab40b和Rab40c高可信相互作用蛋白中,文献[22]报道ASB2是此E3泛素化连接酶的亚单位,参与调控树突状细胞迁移。而UBE2O被报道是E2泛素化连接酶,抑制TRAF6聚泛素化,阻止NF-κB通路激活,参与调节溶酶体蛋白运输过程[23]。FBX4和CAND1是Skp1-Cullins-F-box 蛋白复合物E3连接酶的组成成分[24]。这些Rab40b/c相互作用蛋白功能分析提示Rab40b/c在树突状细胞胞质中参与Cullin5依赖的泛素化过程。
泛素化过程由E1-E2-E3酶激活,通过传递泛素分子至底物进行泛素化降解[25]。Cullin是E3泛素化连接酶的重要组成成分,Cullin分子可以作为脚手架分别在其N末端和C末端募集底物结合蛋白和环指蛋白,具有SOCS结构域的蛋白可以形成ElonginB/C-Cullin5-SOCS泛素化连接酶复合物[26]。泛素化系统可调控Wnt通路,β-catenin是重要的泛素化底物。7次跨膜G蛋白the Frizzled(Fz)受体是重要的Wnt通路膜受体。胞浆Dishevelled(Dsh)蛋白是经典Wnt通路和非经典Wnt通路的共同关键作用因子[27]。研究验证一些泛素化连接酶在泛素化和蛋白降解过程中作用于Dishevelled(Dsh)蛋白[28]。泛素化连接酶复合物是Wnt通路信号转导的重要调控因子。非洲爪蟾Rab40可以与ElonginB/C和Cullin5形成泛素化连接酶复合物通过作用定位于膜上的Dsh蛋白调节非经典Wnt通路[7]。本研究数据证实Rab40b/c与ElonginB、ElonginC、Cullin5形成蛋白复合物,提示Rab40b/c与Cullin5-ElonginB-ElonginC泛素化E3连接酶形成蛋白复合物,从而区域化此泛素化E3连接酶功能并且Rab40b/c可能参与Wnt信号通路。
本研究通过改良后的串联亲和纯化质谱获得小鼠树突状细胞Rab40b/c的相互作用蛋白质,再经过基于无偏见的比较指标算法CompPASS进行权重打分,获得大量高可信相互作用蛋白。随后通过免疫共沉淀实验验证Rab40b/c与ElonginB/C、Cullin5的相互作用。本实验提示Rab40b/c通过形成泛素化连接酶复合物参与细胞内的泛素化过程,但对于Rab40b/c如何参与泛素化过程及是否参与Wnt通路或其他信号通路等问题未能阐述的更加深入和清楚,因此Rab40b/c通过参与泛素化过程影响树突状细胞生物学功能的机制还需进一步研究。
| [1] | Garrett W S, Chen L M, Kroschewski R, et al. Developmental control of endocytosis in dendritic cells by Cdc42[J]. Cell, 2000, 102(3): 325-334. |
| [2] | Reis-e-Sousa C. Dendritic cells in a mature age[J]. Nat Rev Immunol, 2006, 6(6): 476-483. DOI: 10.1038/nri1845 |
| [3] | Stow J L. Nobel Prize discovery paves the way for immunological traffic[J]. Nat Rev Immunol, 2013, 13(12): 839-841. DOI: 10.1038/nri3564 |
| [4] | Zerial M, McBride H. Rab proteins as membrane organizers[J]. Nat Rev Mol Cell Biol, 2001, 2(2): 107-117. DOI: 10.1038/35052055 |
| [5] | Stenmark H, Olkkonen V M. The Rab GTPase family[J]. Genome Biol, 2001, 2(5): REVIEWS3007. |
| [6] | Yatsu A, Shimada H, Ohbayashi N, et al. Rab40c is a novel Varp-binding protein that promotes proteasomal degradation of Varp in melanocytes[J]. Biol Open, 2015, 4(3): 267-275. DOI: 10.1242/bio.201411114 |
| [7] | Lee R H, Iioka H, Ohashi M, et al. XRab40 and XCullin5 form a ubiquitin ligase complex essential for the noncanonical Wnt pathway[J]. EMBO J, 2007, 26(15): 3592-3606. DOI: 10.1038/sj.emboj.7601781 |
| [8] | Staal F J, Luis T C, Tiemessen M M. WNT signalling in the immune system: WNT is spreading its wings[J]. Nat Rev Immunol, 2008, 8(8): 581-593. DOI: 10.1038/nri2360 |
| [9] | Logan C Y, Nusse R. The Wnt signaling pathway in development and disease[J]. Annu Rev Cell Dev Biol, 2004, 20: 781-810. DOI: 10.1146/annurev.cellbio.20.010403.113126 |
| [10] | Xiao J, Zhou H, Wu N, et al. The non-canonical Wnt pathway negatively regulates dendritic cell differentiation by inhibiting the expansion of Flt3(+) lymphocyte-primed multipotent precursors[J]. Cell Mol Immunol, 2015. DOI: 10.1038/cmi.2015.39 [Epub ahead of print] |
| [11] | Zhou J, Cheng P, Youn J I, et al. Notch and wingless signaling cooperate in regulation of dendritic cell differentiation[J]. Immunity, 2009, 30(6): 845-859. DOI: 10.1016/j.immuni.2009.03.021 |
| [12] | Maine G N, Li H, Zaidi I W, et al. A bimolecular affinity purification method under denaturing conditions for rapid isolation of a ubiquitinated protein for mass spectrometry analysis[J]. Nat Protoc, 2010, 5(8): 1447-1459. DOI: 10.1038/nprot.2010.109 |
| [13] | Behrends C, Sowa M E, Gygi S P, et al. Network organization of the human autophagy system[J]. Nature, 2010, 466(7302): 68-76. DOI: 10.1038/nature09204 |
| [14] | Sowa M E, Bennett E J, Gygi S P, et al. Defining the human deubiquitinating enzyme interaction landscape[J]. Cell, 2009, 138(2): 389-403. DOI: 10.1016/j.cell.2009.04.042 |
| [15] | Burckstummer T, Bennett K L, Preradovic A, et al. An efficient tandem affinity purification procedure for interaction proteomics in mammalian cells[J]. Nat Methods, 2006, 3(12): 1013-1019. DOI: 10.1038/nmeth968 |
| [16] | Puig O, Caspary F, Rigaut G, et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification[J]. Methods, 2001, 24(3): 218-229. DOI: 10.1006/meth.2001.1183 |
| [17] | Gavin A C, Bosche M, Krause R, et al. Functional organization of the yeast proteome by systematic analysis of protein complexes[J]. Nature, 2002, 415(6868): 141-147. DOI: 10.1038/415141a |
| [18] | Knuesel M, Wan Y, Xiao Z, et al. Identification of novel protein-protein interactions using a versatile mammalian tandem affinity purification expression system[J]. Mol Cell Proteomics, 2003, 2(11): 1225-1233. DOI: 10.1074/mcp.T300007-MCP200 |
| [19] | Rodriguez-Gabin A G, Almazan G, Larocca J N. Vesicle transport in oligodendrocytes: probable role of Rab40c protein[J]. J Neurosci Res, 2004, 76(6): 758-770. DOI: 10.1002/jnr.20121 |
| [20] | Huang-da W, Sherman B T, Lempicki R A. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J]. Nat Protoc, 2009, 4(1): 44-57. DOI: 10.1038/nprot.2008.211 |
| [21] | Huang-da W, Sherman B T, Lempicki R A. Bioinformatics enrichment tools: paths toward the comprehensive functional analysis of large gene lists[J]. Nucleic Acids Res, 2009, 37(1): 1-13. DOI: 10.1093/nar/gkn923 |
| [22] | Lamsoul I, Metais A, Gouot E, et al. ASB2α regulates migration of immature dendritic cells[J]. Blood, 2013, 122(4): 533-541. DOI: 10.1182/blood-2012-11-466649 |
| [23] | Hao Y H, Doyle J M, Ramanathan S, et al. Regulation of WASH-dependent actin polymerization and protein trafficking by ubiquitination[J]. Cell, 2013, 152(5): 1051-1064. DOI: 10.1016/j.cell.2013.01.051 |
| [24] | Flick K, Kaiser P. Set them free: F-box protein exchange by Cand1[J]. Cell Res, 2013, 23(7): 870-871. DOI: 10.1038/cr.2013.55 |
| [25] | Hochstrasser M. Lingering mysteries of ubiquitin-chain assembly[J]. Cell, 2006, 124(1): 27-34. DOI: 10.1016/j.cell.2005.12.025 |
| [26] | Petroski M D, Deshaies R J. Function and regulation of cullin-RING ubiquitin ligases[J]. Nat Rev Mol Cell Biol, 2005, 6(1): 9-20. DOI: 10.1038/nrm1547 |
| [27] | Wharton K A Jr. Runnin’ with the Dvl: proteins that associate with Dsh/Dvl and their significance to Wnt signal transduction[J]. Dev Biol, 2003, 253(1): 1-17. |
| [28] | Miyazaki K, Fujita T, Ozaki T, et al. NEDL1, a novel ubiquitin-protein isopeptide ligase for dishevelled-1, targets mutant superoxide dismutase-1[J]. J Biol Chem, 2004, 279(12): 11327-11335. DOI: 10.1074/jbc.M312389200 |



