心肌缺氧是紫绀型先心病患儿重要的病理生理改变。临床上,有些紫绀型先心病患儿虽然心脏长期被低氧含量的血液灌注,在一定时期内却仍能存活,且很少发生心力衰竭,并能抵御心脏外科手术所致的缺血缺氧,然而其中的心肌缺氧适应的确切机制尚不完全清楚。阐明缺氧适应的心肌调控机制,对保存儿童乃至成人缺氧心肌生存能力具有重要意义[1]。
线粒体经常经历融合、分裂,这对维持细胞器的高保真度是必要的,特别是细胞面临代谢或环境应急时。线粒体融合通过以一种互补的形式来混合部分受损的线粒体内容物来帮助缓解应激,而线粒体分裂可以产生新的线粒体,在高水平的细胞应激状态下促进受损伤的线粒体被移除来控制线粒体的质量[2]。线粒体分裂和融合过程均由动力蛋白家族中的大型GTP酶所介导[3]。线粒体分裂由胞质动力蛋白家族成员Drp1(dynamin related protein 1)和分裂蛋白(fission 1,Fis1)所介导。其中Fis1是一种线粒体锚定蛋白,参与将Drp1招募到线粒体外膜的过程。线粒体外膜之间的融合是由膜锚定的动力蛋白家族成员Mfn1与线粒体融合蛋白(mitofusins,Mfn2)所介导,而内膜融合则由Opa1蛋白介导[4]。缺氧能够诱导小鼠胚胎成纤维细胞线粒体分裂[5],适度的线粒体分裂有助于移除受损伤的线粒体,但是过度的线粒体分裂往往导致细胞死亡[2]。既往研究表明,抑制线粒体分裂对缺血灌注损伤、心肌病、动脉导管未闭、肺动脉高压等心血管疾病有保护作用[2],探索调控线粒体融合分裂的机制具有重要意义。
沉默信息调节因子2同源蛋白(silent information regulator 2 homolog,Sirt1)是研究酵母菌转录沉默时发现的酵母染色质沉默子sirt2在哺乳动物中的同源体1,具有组蛋白去乙酰化酶活性[6, 7, 8]。目前研究表明Sirt1参与调控了线粒体的许多生物学过程,包括参与线粒体自噬;Sirt1通过去乙酰化PGC-1α,参与线粒体增生;NAD+/NADH比值与化学诱导Sirt1活化均能降低线粒体内容物,增加自噬,诱导线粒体片段化[9],然而,Sirt1是否参与线粒体动态平衡调节尚少见报道。本研究旨在检测缺氧条件下心肌细胞线粒体动态学变化情况,观察Sirt1对缺氧心肌中细胞线粒体动态平衡的影响,并研究其可能的机制,为缺氧条件下心肌的保护提供新的思路。
1 资料与方法 1.1 临床资料经第三军医大学新桥医院伦理委员会批准,在术前获得患儿家属同意并签署知情同意书。以入院后于我院复查所得的心脏多普勒彩超结果为诊断标准,常温环境不吸氧1 h以上测四肢血压和血氧饱和度。纳入标准如下[10]:非紫绀组,平均血氧饱和度>95%且四肢血氧饱和度差异<2%,临床上诊断结果为室间隔缺损(ventricular septal defect,VSD)合并右室流出道 狭窄;紫绀组,平均血氧饱和度<85%且四肢血氧饱和度差异≤2%,临床诊断是法洛氏四联症(tetralogy of fallot,TOF)。选择2014年于我院行手术治疗的先心病患者29例,紫绀组15例与非紫绀组14例(表 1)。
组别 | 男/女(例) | 手术时年龄 (x±s,月) | 临床诊断 | 射血分数 (x±s,%) | 术前血氧饱和度 (x±s,%) | 血红蛋白 (x±s,g/L) |
| 紫绀组 | 10/5 | 21.3±6.2 | TOF | 65.3±6.6 | 68.9±3.5a | 145.1±15.8 |
| 非紫绀组 | 7/7 | 19.8±6.9 | VSD | 70.2±5.5 | 97.8±1.8 | 120.0±9.2 |
| a :P<0.05,与非紫绀组比较 | ||||||
H9c2细胞系 (ATCC),DMEM高糖培养基 (Gibco),FBS (Gibco),胰酶 (索莱宝),转染用无血清培养基(Gibco),细胞裂解液(Invitrogen),rabbit β-actin 抗体(CST),mouse Sirt1 抗体(Abcam),rabbit Drp1抗体(CST),rabbit hFis1抗体(Sigma),Lipofectamine 2000(Invitrogen),其余常见试剂均购自碧云天。Sirt1过表达腺病毒及对照Ad-GFP腺病毒由中国医学科学院基础医学研究所陈厚早教授惠赠。Sirt1过表达质粒、Sirt1低表达质粒Sh-Sirt1及Lv-Sh-Sirt1慢病毒由第三军医大学西南医院病理科钱程教授惠赠。
1.3 方法 1.3.1 标本的收集常规麻醉后,开胸建立体外循环,于术中取右室流出道组织,锡箔纸包裹后置于-80 ℃ 超低温冰箱,为后续研究做准备。
1.3.2 细胞培养与脂质体转染H9c2心肌细胞培养于含有10%胎牛血清的高糖DMEM培养基的6孔板中,置于常氧培养箱中(74% N2,5% CO2,21% O2)培养。缺氧培养时,将细胞置于缺氧培养箱中(94% N2,5% CO2,1% O2),并于0、2、4、8、12 h后收集蛋白。对线粒体形态学进行分析时,待细胞汇合度达到50%~60%时,按照转染说明书,运用Lipofectamine 2000进行转染。目的质粒(Sirt1,Sh-Sirt1和空白质粒)与线粒体靶向红色荧光质粒(mt-RFP)以2 ∶1的比例共转染至H9c2细胞中,转染6 h后更换换完全培养基,并置于常氧培养箱中继续培养48 h。将H9c2心肌细胞分为常氧组和缺氧组。随后,常氧组与缺氧组分别于常氧、缺氧培养箱中继续培养12 h,4%多聚甲醛固定后于激光共聚焦显微镜下进行观察。
1.3.3 腺病毒和慢病毒感染腺病毒感染:6孔板中接种H9c2细胞,待细胞汇合度约60%时,每孔加入计算好的重组腺病毒细胞裂解液或者对照的绿色荧光蛋白,6 h后换液,继续培养24 h,荧光倒置显微镜下观察荧光表达情况,通过GFP的表达情况分析腺病毒感染效率。实验组为Ad-Sirt1感染组,对照组为只表达绿色荧光的Ad-GFP。
慢病毒感染:本实验嘌呤霉素筛选浓度为2.5 μg/mL。 实验组为Lv-Sh-Sirt1,对照组为Lv-Scramble,具体方法参照文献[8]。
1.3.4 Western blot 测定蛋白表达情况弃细胞培养基,用预冷PBS冲洗3次,吸尽PBS,每个细胞培养瓶中加入150 μL总蛋白提取液(含蛋白酶和磷酸酶抑制剂),冰上裂解30 min,细胞刮收集细胞,4 ℃,离心机半径10 cm,12 000 r/min离心20 min后取上清,BCA法测定蛋白浓度。按照4 ∶1与5×SDS-PAGE蛋白上样缓冲液混匀,100 ℃煮沸5 min。心肌组织蛋白提取时运用匀浆仪将剪碎后的组织溶解于裂解液中制成匀浆,余下步骤 同细胞蛋白提取。取各个样本50 μg 蛋白进行SDS-PAGE凝胶电泳,湿转法转膜后运用BSA封闭1 h。分别加入Sirt1,Drp1,Fis1和β-actin孵育,4 ℃摇床过夜,TBST漂洗3次,每次10 min。相应的二抗室温孵育1 h,TBST漂洗10 min×3次,化学发光后显影并采集图像。Image J软件分析结果。
1.3.5 评价线粒体动态学激光共聚焦显微镜下观察,每个视野下选择50个细胞进行分析。每个处理因素分析的细胞不少于200个。对单个细胞而言,超过75%的线粒体处于点状形态则为线粒体分裂细胞,介于25%~75%的线粒体处于点状形态表明处于中间状态,低于25%的线粒体处于点状形态则记为线粒体融合细胞。这3种细胞以一定的比例存在于各种条件下。统计各个处理组细胞线粒体处于融合、分裂状态所占的比值。
1.3.6 乳酸脱氢酶(LDH)细胞死亡率检测将细胞接种于96孔板,根据所转染的质粒进行分组,依次分为对照组、Sirt1过表达组和Sirt1干扰组(n=3)。按照说明书进行处理,酶标仪于490 nm处测定光密度D(490)值,根据细胞毒性或死亡率(%)=(处理样品吸光度-样品对照孔光密度)/(细胞最大酶活性的光密度-样品对照孔光密度)×100% 公式计算细胞死亡率[11]。
1.4 统计学分析采用SPSS 13.0统计软件分析,数值均以x±s表示,多组间比较运用单因素方差分析,两两比较用LDS法,两组比较行t检验。
2 结果 2.1 心肌标本及缺氧H9c2心肌细胞Drp1和Fis1表达情况Western blot检测人心肌组织中Drp1和Fis1蛋白表达见图 1,紫绀组中促线粒体分裂蛋白Drp1和Fis1表达水平明显高于非紫绀组(P<0.05)。进而我们将大鼠H9c2心肌细胞系作为研究对象,运用激光共聚焦对常氧及缺氧处理12 h的H9c2心肌细胞线粒体形态进行观察,统计结果表明,同常氧组相比,缺氧组线粒体分裂细胞所占的比例明显上调(表 2,P<0.05)。Western blot进一步研究结果表明H9c2细胞在缺氧培养后,促线粒体分裂蛋白Drp1和Fis1的表达呈上升 趋势(图 2A),Image J软件对灰度值进行分析的结果见图 2B。以上结果表明缺氧诱导心肌细胞线粒体分裂。
 |
| 1-3:非紫绀组;4-6:紫绀组 图 1 Western blot检测2组先心病患者心肌组织中Drp1和Fis1蛋白的表达 |
| [n=3,(x±s)%] | ||||||
| 组别 | 延长状态 | 中间状态 | 碎片状态 | |||
| 常氧 | 缺氧 | 常氧 | 缺氧 | 常氧 | 缺氧 | |
| 空载质粒组 | 67.00±5.29 | 13.33±2.52 | 21.67±2.53 | 16.33±1.53 | 11.33±3.21 | 70.33±4.04 |
| Sirt1质粒组 | 69.67±5.51 | 47.33±4.04 | 20.33±3.05 | 18.33±2.08 | 10.00±2.65 | 34.33±3.79a |
| Sh-Sirt1质粒组 | 66.33±3.06 | 5.67±1.53 | 19.33±1.53 | 11.67±2.08 | 14.33±1.53 | 82.67±3.06b |
| a:P<0.05,与空载质粒组比较;b:P<0.05,与Sirt1质粒组比较 | ||||||
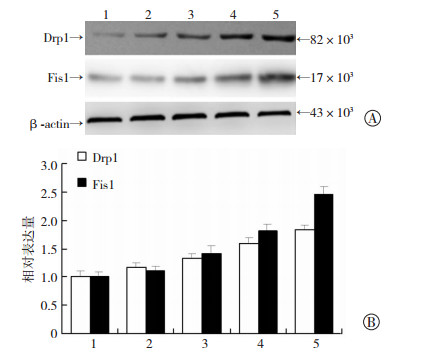 |
| A:Western blot检测结果; B:半定量分析结果 1-5:依次代表缺氧0、2、4、8、12 h组 a:P<0.05,与缺氧0 h组比较 图 2 Western blot检测H9c2心肌细胞缺氧培养条件下Drp1和Fis1的表达 |
激光共聚焦显微镜下可观察到线粒体存在延长、中间、碎片3种状态。见图 3。与缺氧的空载组相比较,Sirt1过表达+缺氧组中线粒体处于碎片状的比例明显减少(P<0.05),而Sirt1干扰+缺氧组中线粒体处于碎片状的比例增加得更加明显(P<0.05)。表明Sirt1能够有效地缓解缺氧诱导的线粒体分裂(表 2)。
 |
| A:延长状态;B:中间状态;C:碎片状态 图 3 激光共聚焦显微镜下线粒体靶向质粒标记后粒体呈现延长、中间、碎片3种状态变化 |
Western blot结果表明,缺氧条件下过表达Sirt1 能够抑制线粒体促分裂蛋白Drp1和Fis1的表达(P< 0.05),而干扰Sirt1表达后Drp1与Fis1蛋白表达上调 (P<0.05,图 4)。提示Sirt1可能通过抑制线粒体促分裂蛋白Drp1和Fis1的表达来缓解缺氧诱导的线粒体分裂。
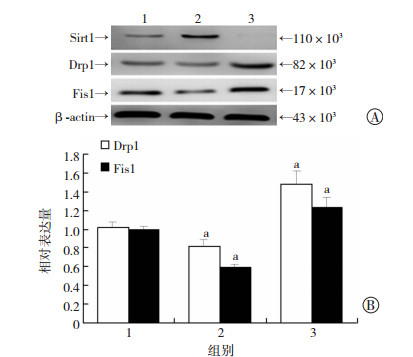 |
| 1:缺氧对照组;2:缺氧+ Ad-Sirt1组; 3:缺氧+ Lv-Sh-Sirt1组 A: Western blot检测结果; B:半定量分析结果 a:P<0.05,与缺氧对照组比较 图 4 Western blot检测缺氧条件下各组促线粒体分裂蛋白Drp1和Fis1的表达 |
LDH细胞死亡率检测结果表明,缺氧前预转染Sirt1过表达或干扰质粒后,Sirt1过表达组与缺氧对照组相比,心肌细胞死亡率降低(P<0.05),而Sirt1低表达组与缺氧对照组相比,心肌细胞的死亡率上升(P<0.05,图 5)。
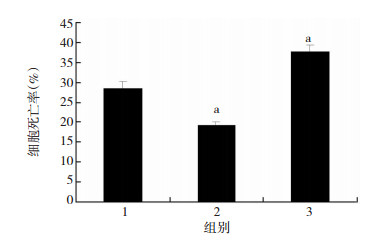 |
| 1:缺氧+空载质粒组;2:缺氧+Sirt1过表达质粒组;3:缺 氧+Sirt1干扰质粒组 a:P<0.05,与缺氧+空载质粒组比较 图 5 LDH检测缺氧条件下各组心肌细胞死亡率 |
最新研究表明线粒体形态对细胞生理十分重要,因为线粒体形态改变与神经元退性,钙信号通道,生命周期与细胞死亡密切相关。线粒体分裂生成的新线粒体能产生更多的活性氧,促进自噬,或者加速细胞的增生。而线粒体融合形成的相互连接的线粒体网络则会增强其与内质网的联系,还能实现线粒体基质在各个线粒体之间扩散,稀释不断累积的突变线粒体DNA 和氧化的蛋白。任何应激导致的线粒体持续性紊乱都将导致线粒体功能异常,进而影响细胞存活。异常的线粒体分裂参与凋亡的起始过程[12]。缺氧可引起线粒体结构和动力学发生大的改变,最终导致缺陷的线粒体功能、ATP供给减少,细胞死亡通路的活化[13, 14]。线粒体占到心肌细胞内容物大小的30%,条件性的敲除成年鼠Mfn1与Mfn2基因,心肌细胞线粒体分裂显著,导致心肌细胞呼吸异常,最终发展成快速进展性扩张性心肌病[15]。因此,维持线粒体融合与分裂平衡,干预缺氧诱导的线粒体过度分裂,对缺氧条件下的心肌细胞有一定的保护作用。
我们发现,在人体临床标本组织中,紫绀组Drp1与Fis1表达明显高于非紫绀组,而心肌细胞在缺氧培养后Drp1与Fis1表达也明显增加,表明缺氧能够诱导心肌细胞线粒体分裂。此外,进一步的实验发现Sirt1能够明显抑制缺氧所诱导的线粒体分裂。分子生物学实验表明,Sirt1能够抑制促线粒体分裂蛋白Drp1和Fis1表达。LDH实验表明缺氧条件下的过表达Sirt1能够降低细胞死亡率。因此,我们认为Sirt1除了能通过已知的调控线粒体自噬和增生外,还能通过参与线粒体动态平衡的调控进而减少缺氧对心肌细胞造成的损伤,促进细胞存活。
最新研究表明在肾脏中,Drp1抑制剂mdivi-1(mitochondrial division inhibitor 1)能保护肾小管细胞,减少其因受到缺血灌注损伤引起的线粒体分裂[16],在心脏骤停过程中,Drp1会被钙调磷酸酶介导的Drp1分子丝氨酸637位点上的去磷酸化所激活[17]。线粒体分裂程序的激活会增加活性氧的生成,提高钙离子水平,并削弱心脏舒张期的放松。直接或通过钙调磷酸酶间接抑制Drp1可能有治疗的效果。此外,Ong等[18]发现针对Drp1的化学抑制剂能够有效缓解缺血灌注对心肌细胞所造成的损伤。我们观察到Sirt1干扰缺氧诱导的促线粒体分裂蛋白Drp1表达,进而抑制线粒体分裂。研究表明,Fis1的敲除可减少细胞的死亡。在缺血在灌注损伤中,Fis1的敲除减弱线粒体分裂、凋亡,并减小心肌梗死面积[19]。在我们的研究中,Sirt1能够抑制Fis1表达,意味着抑制了Fis1促进Drp1转位的功能,进而抑制缺氧诱导的线粒体分裂,促进细胞的存活。本研究关于Sirt1调控缺氧心肌细胞中的线粒体动力学,可以为紫绀型心脏病围手术期的心肌保护提供新的策略。
| [1] | Jian Z, Li J B, Ma R Y, et al. Pivotal role of activating transcription factor 6alpha in myocardial adaptation to chronic hypoxia [J]. Int J Biochem Cell Biol, 2012, 44(6): 972-979. DOI: 10.1016/j.biocel.2012.03.004 |
| [2] | Archer S L. Mitochondrial dynamics-mitochondrial fission and fusion in human diseases [J]. N Engl J Med, 2013, 369(23): 2236-2251. DOI: 10.1056/NEJMra1215233 |
| [3] | Youle R J,van-der-Bliek A M. Mitochondrial fission, fusion, and stress [J]. Science, 2012, 337(6098): 1062-1065. DOI: 10.1126/science.1219855 |
| [4] | Westermann B. Mitochondrial fusion and fission in cell life and death [J]. Nat Rev Mol Cell Biol, 2010, 11 (12): 872-884. DOI: 10.1038/nrm3013 |
| [5] | Kim H, Scimia M C, Wilkinson D, et al. Fine-tuning of Drp1/Fis1 availability by AKAP121/Siah2 regulates mitochondrial adaptation to hypoxia[J]. Mol Cell, 2011, 44(4): 532-544. DOI: 10.1016/j.molcel.2011.08.045 |
| [6] | Liu B, Ghosh S, Yang X, et al. Resveratrol rescues SIRT1-dependent adult stem cell decline and alleviates progeroid features in laminopathy-based progeria[J]. Cell Metab, 2012, 16(6): 738-750. DOI: 10.1016/j.cmet.2012.11.007 |
| [7] | Dioum E M, Chen R, Alexander M S, et al. Regulation of hypoxia-inducible factor 2alpha signaling by the stress-responsive deacetylase sirtuin 1[J]. Science, 2009, 324(5932): 1289-1293. DOI: 10.1126/science.1169956 |
| [8] | 宋春丽, 任吉华, 张祯祯, 等. SIRT1基因沉默诱导肝癌细胞老化及其机制 [J]. 第三军医大学学报, 2012, 34(19): 1929-1932. |
| [9] | Shin D H, Choi Y J, Park J W. SIRT1 and AMPK mediate hypoxia-induced resistance of non-small cell lung cancers to cisplatin and doxorubicin[J]. Cancer Res, 2014, 74(1): 298-308. DOI: 10.1158/0008-5472.CAN-13-2620 |
| [10] | 蹇朝, 马瑞彦, 王咏, 等. 缺氧诱导因子-1α在紫绀型先心病患儿心肌中的表达 [J]. 第三军医大学学报, 2009, 31(12): 1189-1192. |
| [11] | 李畑波, 鞠胜杰, 蹇朝, 等. 腺苷酸激活蛋白激酶激活参与促进慢性缺氧时心肌细胞存活 [J]. 第三军医大学学报, 2015, 37(8): 797-803. DOI: 10.16016/j.1000-5404.201411089 |
| [12] | Tan W Q, Wang J X, Lin Z Q, et al. Novel cardiac apoptotic pathway: the dephosphorylation of apoptosis repressor with caspase recruitment domain by calcineurin [J]. Circulation, 2008, 118(22): 2268-2276. DOI: 10.1161/CIRCULATIONAHA.107.750869 |
| [13] | Solaini G, Baracca A, Lenaz G, et al. Hypoxia and mitochondrial oxidative metabolism [J]. Biochim Biophys Acta, 2010, 1797(6/7): 1171-1177. DOI: 10.1016/j.bbabio.2010.02.011 |
| [14] | Khacho M, Tarabay M, Patten D, et al. Acidosis overrides oxygen deprivation to maintain mitochondrial function and cell survival [J]. Nat Commun, 2014, 5: 3550. DOI: 10.1038/ncomms4550 |
| [15] | Chen Y, Liu Y, Dorn G W 2nd. Mitochondrial fusion is essential for organelle function and cardiac homeostasis[J]. Circ Res, 2011, 109(12): 1327-1331. DOI: 10.1161/CIRCRESAHA.111.258723 |
| [16] | Brooks C, Wei Q, Cho S G, et al. Regulation of mitochondrial dynamics in acute kidney injury in cell culture and rodent models [J]. J Clin Invest, 2009, 119(5): 1275-1285. DOI: 10.1172/JCI37829 |
| [17] | Sharp W W, Fang Y H, Han M, et al. Dynamin-related protein 1 (Drp1)-mediated diastolic dysfunction in myocardial ischemia-reperfusion injury: therapeutic benefits of Drp1 inhibition to reduce mitochondrial fission[J]. FASEB J, 2014, 28(1): 316-326. DOI: 10.1096/fj.12-226225 |
| [18] | Ong S B, Subrayan S, Lim S Y, et al. Inhibiting mitochondrial fission protects the heart against ischemia/reperfusion injury[J]. Circulation, 2010, 121(18): 2012-2022. DOI: 10.1161/CIRCULATIONAHA.109.906610 |
| [19] | Wang K, Long B, Jiao J Q, et al. miR-484 regulates mitochondrial network through targeting Fis1[J]. Nat Commun, 2012, 3: 781. DOI: 10.1038/ncomms1770 |



