固醇调节元件结合蛋白裂解激活蛋白(SREBP cleavage activating protein,SCAP)位于内质网膜上,含固醇敏感区(sterol-sensing domain,SSD)和多个WD40区[1],是SREBPs裂解激活的分子伴侣。当内质网膜上胆固醇水平高于细胞内总胆固醇5%,即高胆固醇水平时,胆固醇与SCAP结合并使其构象发生改变。此时,位于内质网膜上的胰岛素诱导基因蛋白(insulin inducible gene,Insig-1)就能与SCAP结合,从而使SCAP-SREBPs复合物滞留在内质网膜上,减少有活性的SREBP的产生,从而抑制脂质合成及吸收的相关基因及INSIG的表达;当内质网膜上胆固醇水平低于胞内总胆固醇5%时,即细胞处于低胆固醇水平[2],SCAP蛋白以出芽的方式被运至高尔基体[3],在高尔基体内由SIP和S2P蛋白酶分别先后切割SREBPs,产 生具有转录活性的N-SREBPs进入细胞核,调控胆固醇、脂肪酸合成及吸收相关基因的表达,促进脂质的合成[4-5]。
ATDC5细胞系起源于鼠畸胎瘤细胞,具软骨细胞系特征,已被广泛用于研究软骨发育、分化和相关疾病的细胞模型[6]。研究表明软骨细胞代谢紊乱会促进骨关节炎的发生,软骨细胞凋亡或死亡也会导致骨关节炎的产生[7]。本实验通过构建Ad-SCAP和Ad-siSCAP重组腺病毒,探讨其对ATDC5细胞增殖和凋亡的影响,为进一步研究SCAP基因的功能奠定基础,也为探讨SCAP介导的脂质代谢与骨关节炎的关系提供一定的实验基础和理论依据。
1 材料与方法 1.1 材料 1.1.1 质粒、细菌和细胞穿梭质粒pSES-HUS、pAdTrack-CMV、腺病毒骨架质粒pAdEasy-1、大肠杆菌DH5α和BJ5183感受态及HEK293细胞和ATDC5细胞株均由本实验室保存。
1.1.2 主要试剂限制性核酸内切酶SfiⅠ、KpnⅠ、EcoRV、T4DNA连接酶、2×Plus Taq聚合酶、ExonucleaseⅢ、DNA Standard Marker、RT-PCR试剂盒均购自TaKaRa公司;PacⅠ、PmeⅠ限制性核酸内切酶购自Thermo fisher公司;质粒小提试剂盒和DNA胶回收纯化试剂盒购自Omega公司;lipofectamineTM2000购自Invitrogen公司;TRIzol(总RNA抽提试剂)、RIPA蛋白裂解液购自碧云天公司;SCAP、Cleaved Caspase-3及p-JNK抗体均购自Abcam公司;鼠抗β-actin单克隆抗体、HRP标记的抗兔和抗鼠IgG二抗均购自北京中杉金桥公司;SDS-PAGE凝胶配置试剂盒、ECL化学发光液均购自碧云天生物技术研究所;DMEM培养基购自Gibco公司、PANTM南美胎牛血清购自PAN-Biotech GmbH公司。siRNA序列的合成及测序由Invitrogen公司完成。
1.2 方法 1.2.1 重组腺病毒穿梭质粒pSES-HUS-SCAP siRNA1Ű2和pAdTrack-SCAP的构建Oligoengine软件在线设计靶向SCAP的2条siRNA序列并送Invitrogen公司合成(正义链:5′-AGAGCTAGCAGACCTGAACATTTT-3′,反义链:5′-ATGTTCAGGTCTGCTAGCTC-TTTT-3′;正义链:5′-AAGCTAGCAGACCTGAACAAT- TTT-3′,反义链:5′-ATTGTTCAGGTCTGCTAGCTTTTT-3′ ),退火后分别与SfiⅠ线性的pSES-HUS穿梭质粒行T4连接,经KpnⅠ、EcoRV双酶切鉴定后将候选阳性克隆送Invitrogen公司测序。PCR法从质粒pCMV-SCAP(重庆医科大学教育部感染性疾病分子生物学重点实验惠赠)上获得SCAP基因cDNA片段并与HindⅢ、BglⅡ双切且胶回收的穿梭载体pAdTrack-CMV行LIC连接,PCR法和EcoRⅠ酶切鉴定,候选阳性克隆送Invitrogen公司测序。扩增SCAP的PCR引物序列,正义链:5′- GATCCGCTAGAGATC ATGACCCTGACTGAAAG-GCTGC-3′,反义链:5′- GATATCTTATCTAGA TCAGTCCAGTTTCTCCAGCACAG-3′(划线部分为与HindⅢ、BglⅡ 酶双切线性载体pAdTrack-CMV对应的同源臂)。
1.2.2 电转法同源重组构建腺病毒质粒pAdSES-HUS-SCAPsiRNA1&2及Ad-SCAP此部分实验方法参照文献[8]。
1.2.3 腺病毒Ad-SCAP和Ad-SCAPsiRNA的包装扩 增及滴度测定 1.2.4 重组腺病毒感染ATDC5细胞接种ATDC5 细胞至24孔板中,10%胎牛血清的DMEM培养,待细胞融合度达70%左右时,分别加入不同滴度的携带红色荧光(Ad-RFP作对照病毒)的腺病毒Ad-siSCAP 和绿色荧光(Ad-GFP作对照病毒)的Ad-SCAP腺病毒。48 h后观察荧光,确定最佳感染复数(MOI)。将重组腺病毒Ad-siSCAP和Ad-SCAP以最适的MOI感染ATDC5细胞,并设Ad-RFP、Ad-GFP和NC对照组。48 h 后,检测SCAP基因的表达[8]。
1.2.5 RT-PCR检测ATDC5细胞SCAP mRNA水平的变化将对数生长期的ATDC5细胞接种于6孔板,分别加入MOI为100、100、150、150的腺病毒Ad-siSCAP、Ad-RFP、Ad-SCAP、Ad-GFP病毒液感染48 h后,提对照组和实验组细胞总RNA。紫外分光光度计测总RNA浓度,按逆转录说明书及时逆转录为cDNA。PCR反应扩增SCAP基因和内参GAPDH,以逆转录得到的cDNA为模板,SCAP的上下游引物分别是:5′-ATGACCCTGACTGAAAGGCTGC-3′和5′-CATCTACTGCCAGGAGGTTCTTGTG-3′,产物大小为340 bp。内参GAPDH的上下游引物分别是5′-GAGCCAA-AAGGGTCATCATCTC-3′和5′-AAAGGTGGAGGAGTGGGTGTC-3′,扩增片段长度为542 bp。反应条件为:94 ℃预变性1 min 30 s; 94 ℃变性40 s,60 ℃退火1 min,72 ℃延伸1 min,30个循环;72 ℃延伸5 min。PCR扩增产物用1.0%琼脂糖凝胶电泳鉴定。
1.2.6 细胞内外源SCAP蛋白的检测此部分实验分组及处理情况同1.2.5,待感染ATDC5细胞48 h后,用细胞裂解液RIPA提NC组及处理组细胞的总蛋白,随后进行Western blot检测,具体步骤见参考文献[8],其中,SCAP抗体与一抗稀释液的比例为1 ∶1 000。
1.3 Ad-siSCAP和Ad-SCAP对ATDC5细胞增殖和凋亡的影响 1.3.1 流式细胞仪(FCM)检测Ad-siSCAP和Ad-SCAP对ATDC5细胞增殖和凋亡的影响此部分实验步骤中细胞分组及病毒处理情况同1.2.5,待各病毒分别感染ATDC5细胞48 h后收集细胞,送重庆医科大学生命科学院流式检测中心,检测各组ATDC5细胞增殖和凋亡的情况。
1.3.2 Western blot检测Ad-siSCAP和Ad-SCAP对ATDC5细胞凋亡的影响与FCM检测时的实验设计一致,各组细胞在感染48 h之后分别提总蛋白,Western blot检测与凋亡相关基因Cleaved Caspase-3和p-JNK蛋白的表达。
1.4 统计学分析采用SPSS 13.0统计软件,数据以x ±s表示,组间比较采用多因数方差分析。
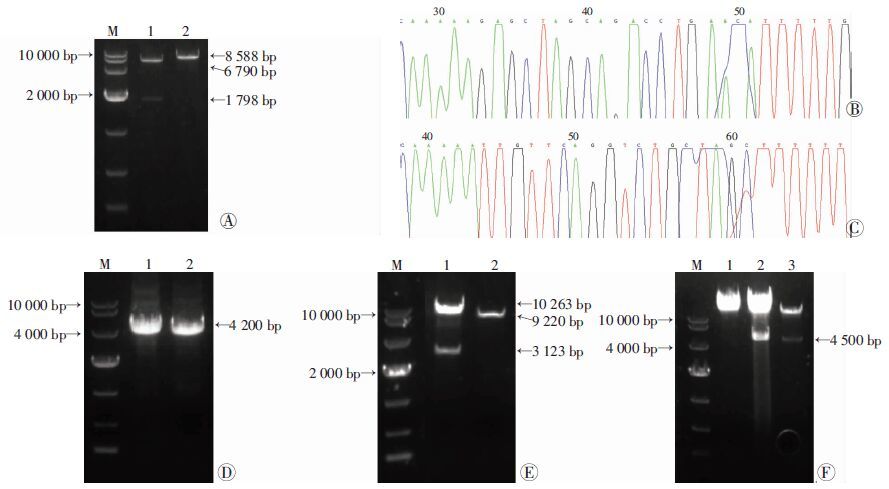
2 结果 2.1 Ad-siSCAP和Ad-SCAP腺病毒载体的构建 2.1.1 重组腺病毒载体的鉴定pSES-HUS空载被EcoRV和KpnⅠ酶双切,产生大小约6.8 kb和1.8 kb的2个片段(图 1A),而阳性克隆只被KpnⅠ单切产生 1个条带,大小约为8.6 kb且测序结果正确(图 1B、C); PCR扩增产生的SCAP片段大小和EcoRⅠ酶切产生的片段数目和大小均与预期相符(图 1D、E)且测序结果比对正确,表明重组腺病毒穿梭质粒pAdTrack-SCAP构建成功。PacⅠ酶切pAd-siSCAP和pAd-SCAP后,均得到1条约30 kb的大片段和1条约4.5 kb的特征性小片段(图 1F),表明穿梭质粒和骨架质粒同源重组成功。
|
| A:EcoRV、KpnⅠ双酶切鉴定pSES-HUS-SCAPsiRNA M:DL 10 000标准;1:pSES-HUS;2:pSES-HUS-SCAPsiRNA;B: pSES-HUS-SCAPsiRNA1测序结果;C: pSES-HUS-SCAPsiRNA2测序结果;D: pAdTrack-SCAP的 PCR鉴定 M: DL 10 000标准; 1: pCMV-SCAP; 2: pAdTrack-SCAP;E: EcoRⅠ酶切鉴定AdTrack-SCAP M:DL 10 000标准; 1: AdTrack-SCAP; 2:AdTrack-CMV; F: PacⅠ酶切鉴定pAd-siSCAP和pAd-SCAP重组腺病毒质粒 M: DL 10 000标准; 1:pAdEasy-1; 2: Ad-SCAP; 3: Ad-siSCAP 图 1 Ad-siSCAP和Ad-SCAP腺病毒质粒的构建与鉴定 |
2.1.2 重组腺病毒颗粒pAd-siSCAP和pAd-SCAP的包装
重组腺病毒质粒pAd-siSCAP、pAd-SCAP分别转染HEK-293细胞后第2天,荧光显微镜下分别可见部分细胞呈红色、绿色荧光,随着时间延长,表达RFP、GFP的细胞增多,荧光加强,表明HEK-293细胞中存在病毒的包装和扩增。转染7 d左右,细胞呈彗星状的腺病毒病灶,10 d后可观察到细胞病变(CPE),大部分包装细胞变圆脱落(图 2)。

|
| 图 2 重组腺病毒颗粒的包装 (荧光显微镜×200) |
2.1.3 ATDC5细胞MOI的测定
重组腺病毒Ad-siSCAP、Ad-SCAP扩增3代以后,测得滴度分别是2.5×1010、3.0×1011 PFU/mL。按MOI为0、10、20、50、100、150、250分别感染ATDC5细胞,48 h后荧光显微镜下分别观察RFP、GFP的表达,结果显示Ad-siSCAP、Ad-SCAP在ATDC5细胞中的最佳MOI分别为100和150。
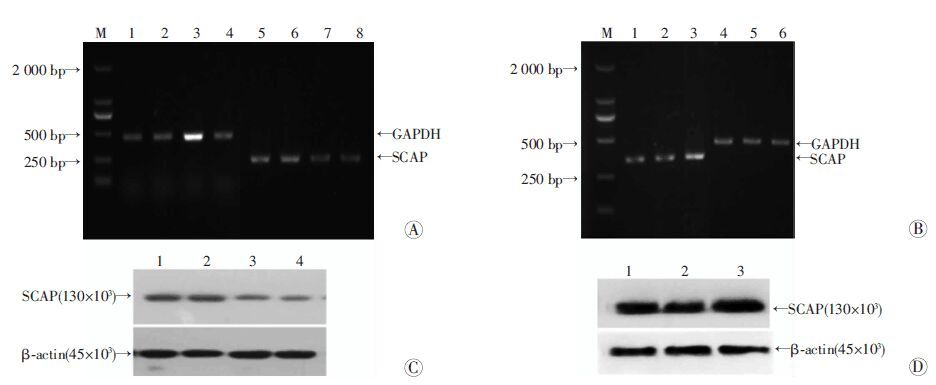
2.1.4 Ad-siSCAP和Ad-SCAP在ATDC5细胞中的表达RT-PCR检测结果显示:ATDC5细胞中感染Ad-siSCAP组的SCAP mRNA水平明显降低(图 3A),而感染了Ad-SCAP组的SCAP mRNA水平则明显上升(图 3B)。Western blot检测结果与mRNA检测结果一致(图 3C、D)。
|
| A:RT-PCR检测 M: DL 2 000标准; 1、5:NC组; 2、6:Ad-RFP组; 3、7:Ad-SCAPsiRNA2组; 4、8:Ad-SCAPsiRNA1组; B: RT-PCR检测 M: DL 2 000标准; 1、4:NC组; 2、5:Ad-GFP组; 3、6:Ad-SCAP组; C: Western blot检测 1:NC组; 2:Ad-RFP组; 3:Ad-SCAPsiRNA1组; 4:Ad-SCAPsiRNA2组; D: Western blot检测 1:NC组; 2:Ad-GFP组; 3:Ad-SCAP组 图 3 Ad-siSCAP和Ad-SCAP重组腺病毒分别感染ATDC5细胞48 h后SCAP mRNA和蛋白的表达 |
2.2 Ad-siSCAP和Ad-SCAP重组腺病毒对ATDC5细胞增殖和凋亡的影响 2.2.1 Ad-siSCAP和Ad-SCAP重组腺病毒对ATDC5细胞增殖的影响
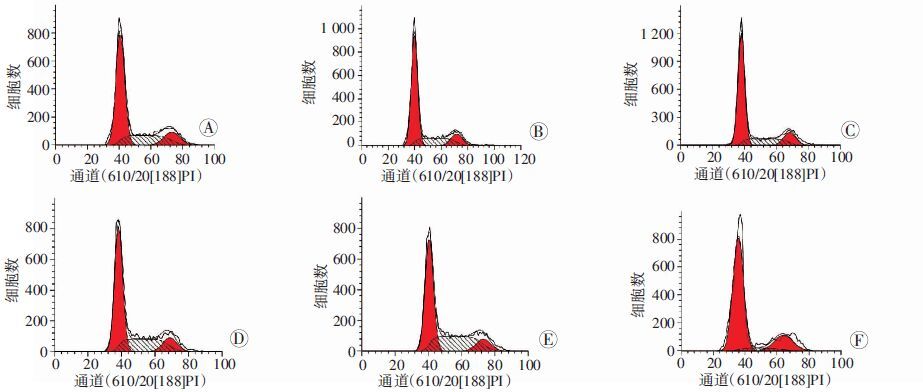
流式细胞仪检测结果显示:与NC组和RFP组比较,Ad-siSCAP2组G1期细胞比例分别降低12.12%和12.64%(P<0.05),S期的细胞比例则分别升高15.45%和16.07%(P<0.05);而Ad-SCAP组与NC组和GFP组相比,G1期细胞比例分别升高9.34%和8.72%(P<0.05),S期细胞比例则分别降低14.27%和13.45%(P<0.05,图 4)。结果表明:Ad-siSCAP可促进细胞的增殖,Ad-SCAP则抑制细胞增殖。
|
| A:NC组;B: Ad-RFP组;C: Ad-GFP组;D: Ad-SCAPsiRNA1组;E:Ad-SCAPsiRNA2组;F:Ad-SCAP组 图 4 流式细胞仪检测重组腺病毒感染ATDC5细胞48 h后各组细胞周期的分布 |
2.2.2 SCAP重组腺病毒对ATDC5细胞凋亡的影响 2.2.2.1 流式细胞仪检测
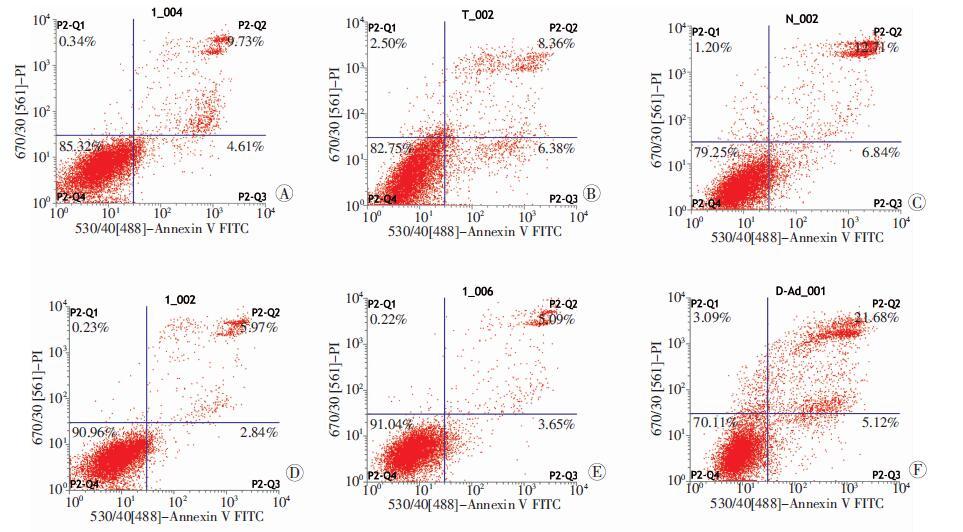
Ad-SCAP siRNA2组凋亡率与NC组和Ad-RFP组比较分别降低13.10%和11.50%(P<0.05);Ad-SCAP组与NC组和Ad-GFP组比较,凋亡率则分别升高10.51%和10.17%(P<0.05,图 5)。结果表明:Ad-siSCAP抑制ATDC5细胞的凋亡,Ad-SCAP则促进细胞凋亡。
|
| A:NC组;B: Ad-GFP组;C: Ad-RFP组;D: Ad-SCAPsiRNA1组; E:Ad-SCAPsiRNA2组;F:Ad-SCAP组 图 5 流式细胞仪检测SCAP腺病毒感染ATDC5细胞48 h后各组细胞凋亡 |
2.2.2.2 Western blot 检测
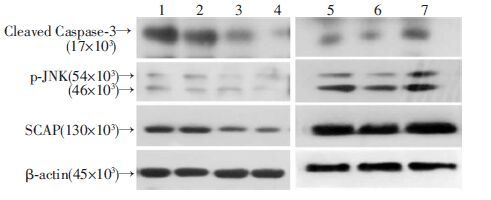
分别检测ATDC5细胞中SCAP蛋白水平和过表达对Cleaved Caspase-3和p-JNK蛋白表达的影响。结果表明:与NC组和Ad-RFP组比较,Ad-siSCAP处理组中Cleaved Caspase-3和p-JNK的表达均明显下降,表明Ad-siSCAP对ATDC5细胞的凋亡有抑制作用;与NC组和Ad-GFP组比较,Ad-SCAP感染ATDC5细胞后,Cleaved Caspase-3和p-JNK的表达均明显增加(图 6),表明ATDC5细胞中过表达SCAP可促进其凋亡。
|
| 1、5:NC组;2:Ad-RFP组;3:Ad-SCAPsiRNA1组;4:Ad-SCAPsiRNA2组;6:Ad-GFP组;7:Ad-SCAP组 图 6 Western blot 检测各组细胞凋亡相关蛋白的表达 |
3 讨论
SCAP位于内质网膜上,是SREBP形成复合物并从内质网到高尔基运输过程中的分子伴侣。SCAP-SREBPs的运输过程受固醇调控,是胆固醇负反馈调控的重要步骤[11]。SREBPs包括SREBP-1a、1c和SREBP2。SREBP-1a和SREBP-1c在不同组织器官中表达。SREBP1a在正在生长的正常细胞和癌细胞中呈现高表达,其合成的胆固醇和脂肪酸是细胞膜中脂质的重要成分;而SREBP1c则主要在肝脏中表达,当胰岛素水平异常升高时,其合成的过量的脂肪酸则会导致2型糖尿病患者发生脂肪肝[12-13]。SREBP-2则主要影响LDL受体形成和胆固醇合成途径中相关酶的表达。SREBPs的3种异构体均以无活性的前体形式以发夹结构位于内质网膜上,其发挥相应的功能都需在高尔基体内经剪切形成有活性的N-SREBPs入核后,作为转录因子参与相关基因的表达调控。然而,SCAP具有感觉胆固醇的水平,有条件地把SREBPs从内质网运送到高尔基体,通过调控SREBPs的水解反应控制细胞内脂质合成。研究表明SCAP的固醇传感结构域是SCAP的调节位点,胆固醇可以与这一结构域相结合完成其功能[13]。
本研究分别构建Ad-siSCAP和Ad-SCAP重组腺病毒,探讨SCAP对ATDC5软骨干细胞增殖和凋亡的影响。ATDC5细胞系是从小鼠畸胎瘤细胞分化培养中分离出来的,是一个具有软骨细胞典型特点的细胞株,是研究软骨细胞分化不同阶段的一个良好的细胞模型。结果显示:重组腺病毒Ad-SCAP感染软骨干细胞ATDC5 以后,SCAP在ATDC5细胞中过表达,ATDC5 细胞S期细胞减少,G1期细胞增多,抑制ATDC5 细胞的增殖,促进其凋亡;而重组腺病毒 Ad-siSCAP 感染软骨干细胞ATDC5以后,抑制了ATDC5 细胞中SCAP的表达,S期细胞增加,G1期细胞减少,促进了ATDC5细胞的增殖,抑制其凋亡。Western blot检测凋亡相关蛋白表达结果显示:与Ad-RFP组和NC组相比,Ad-siSCAP组凋亡相关蛋白Cleaved Caspase-3和p-JNK表达明显下调;Ad-SCAP组凋亡相关蛋白表达较NC组和Ad-GFP对照组明显上调,说明在ATDC5细胞中,过表达SCAP可以抑制增殖、促进凋亡;抑制SCAP的表达则促进增殖抑制其凋亡。
综上所述,本实验成功构建了Ad-SCAP和Ad-siSCAP的重组腺病毒,在ATDC5细胞中研究了SCAP敲低和过表达分别对ATDC5软骨干细胞增殖和凋亡的作用。为后续研究SCAP的生物学功能,探讨骨关节炎与脂代谢的关系奠定了实验基础。
| [1] | 柳童斐, 宋保亮. 胆固醇合成途径的负反馈调控机制[J]. 中国细胞生物学学报,2013, 35 (4) : 401 –409. |
| [2] | Radhakrishnan A, Goldstein J L, McDonald J G, et al. Switch-like control of SREBP-2 transport triggered by small changes in ER cholesterol: a delicate balance[J]. Cell Metab,2008, 8 (6) : 512 –521. DOI:10.1016/j.cmet.2008.10.008 |
| [3] | Sun L P, Li L, Goldstein J L, et al. Insig required for sterol-mediated inhibition of Scap/SREBP binding to COPII proteins in vitro[J]. J Biol Chem,2005, 280 (28) : 26483 –26490. |
| [4] | Xu D, Wang Z, Zhang Y, et al. PAQR3 modulates cholesterol homeostasis by anchoring Scap/SREBP complex to the Golgi apparatus[J]. Nat Commun,2015, 6 : 8100 . DOI:10.1038/ncomms9100 |
| [5] | Lee J N, Song B, DeBose-Boyd R A, et al. Sterol-regulated degradation of Insig-1 mediated by the membrane-bound ubiquitin ligase gp78[J]. J Biol Chem,2006, 281 (51) : 39308 –39315. DOI:10.1074/jbc.M608999200 |
| [6] | Newton P T, Staines K A, Spevak L, et al. Chondrogenic ATDC5 cells: an optimised model for rapid and physiological matrix mineralisation[J]. Int J Mol Med,2012, 30 (5) : 1187 –1193. DOI:10.3892/ijmm.2012.1114 |
| [7] | Kim J H, Jeon J, Shin M, et al. Regulation of the catabolic cascade in osteoarthritis by the zinc-ZIP8-MTF1 axis[J]. Cell,2014, 156 (4) : 730 –743. DOI:10.1016/j.cell.2014.01.007 |
| [8] | 韩晓凤, 李美玲, 张鹏, 等. siIRE1α重组腺病毒对内质网应激介导凋亡的影响[J]. 第三军医大学学报,2014, 36 (11) : 1147 –1152. DOI:10.16016/j.1000-5404.2014.11.008 |
| [9] | 李祥柱, 张鹏, 韩晓凤, 等. IRE1α重组腺病毒载体对ATDC5软骨干细胞增殖及凋亡的影响[J]. 解放军医学杂志,2013, 38 (8) : 639 –643. |
| [10] | 韩晓凤, 张鹏, 李美玲, 等. 携人ATF6重组腺病毒载体的构建及对C28I2细胞增殖及凋亡的影响[J]. 医学分子生物学杂志,2013, 10 (4) : 187 –192. DOI:10.3870/j.issn.1672-8009.2013.04.001 |
| [11] | Radhakrishnan A, Sun L H, Kwon H J, et al. Direct binding of cholesterol to the purified membrane region of SCAP: mechanism for a sterol-sensing domain[J]. Mol Cell,2004, 15 (2) : 259 –268. |
| [12] | Goldstein J L, Brown M S. A century of cholesterol and coronaries: from plaques to genes to statins[J]. Cell,2015, 161 (1) : 161 –172. DOI:10.1016/j.cell.2015.01.036 |
| [13] | Moon Y A, Liang G, Xie X, et al. The Scap/SREBP pathway is essential for developing diabetic fatty liver and carbohydrate-induced hypertriglyceridemia in animals[J]. Cell Metab,2012, 15 (2) : 240 –246. DOI:10.1016/j.cmet.2011.12.017" |



