肝脏缺血再灌注损伤(hepatic ischemia reperfusion injury,HIRI)是指各种原因导致的肝血流中断或不足使肝缺血一段时间,在重新恢复肝脏血供之后肝功能不仅得不到恢复,反而进一步加重的现象。在HIRI过程中,炎症反应的产生是其中一个重要因素[1-2]。研究报道TLR4(Toll-like receptor4)/NF-κB(nuclear factor-κB)信号通路是细胞内重要的炎症信号通路,在诱导细胞产生炎症反应、释放炎症因子过程中发挥重要作用,阻断细胞TLR4/NF-κB信号通路的传导能够有效抑制细胞炎症反应的发生[3]。白藜芦醇(resveratrol,RES)是植物体内一种天然的多酚类化合物质,广泛存在于葡萄籽、虎杖等植物中[4]。因为其具有抗癌、抗氧化损伤和抗炎等作用[5],被称为植物抗毒素并受到广泛关注。但目前少见RES在肝脏保护方面的报道。Wang等[6]提出缺氧/复氧(hypoxia reoxygenation,H/R)处理对肝细胞造成的损伤是肝缺血再灌注损伤的有效体外实验模型。本实验建立BRL-3A细胞H/R损伤模型,探讨RES是否在H/R状态下对BRL-3A细胞发挥保护作用,以及这种保护作用与TLR4/NF-κB信号通路之间的关系。
1 材料与方法 1.1 主要试剂和药品BRL-3A肝细胞株购于中国科学院细胞库;RES(纯度>98%),DMSO试剂购于美国Sigma公司;CCK-8试剂购自日本同仁化学研究所;谷丙转氨酶(Alanine transaminase,ALT)试剂盒购于南京建成生物工程研究所;Annexin V-PE细胞凋亡试剂盒购于凯基生物公司;ELISA试剂盒购自深圳欣博盛生物科技有限公司;TRIzol、PrimeScript RT Reagent Kit及SYBP Premix Ex Taq试剂购于TaKaRa-宝生物工程(大连)有限公司;RIPA裂解液、BCA蛋白浓度检测试剂盒、ECL发光液、免疫荧光染色试剂盒及抗荧光淬灭封片液购于碧云天生物研究所;小鼠抗大鼠TLR4抗体及TLR4抑制剂(HTA125)购于英国Abcam公司;兔抗大鼠NF-κB购于北京中杉金桥生物技术有限公司。
1.2 细胞培养及药物配置BRL-3A细胞株培养在含10%胎牛血清的DMEM/F12培养基中。RES溶于DMSO中配制成母液,于-20 ℃避光保存,使用时用DMEM/F12培养液将母液稀释到相应浓度(确保DMSO含量<0.1%),将HTA125稀释至10 μg/mL。
1.3 实验分组及H/R模型①空白对照组:不接受任何处理;②RES实验组(RES):加入RES并在正常培养箱中培养;③H/R模型组(H/R):接受H/R处理;④RES处理组(H/R+RES):在接受H/R处理2 h前加入与RES组等量的RES;⑤TLR4抑制剂处理组(H/R+HTA125):在接受H/R处理2 h前加入10 μg/mL HTA125。H/R模型建立:待传代细胞生长24 h后进行细胞换液,加入不含血清培养基,将细胞置于三气培养箱(1% O2,5% CO2,94% N2)中缺氧培养12 h,经缺氧处理后将细胞移至正常培养箱(95%空气,5% CO2)中复氧4 h。
1.4 CCK-8检测细胞存活率将细胞接种于3块96孔板(标记为1、2、3号板),每孔中接种5×103个细胞。1、2号板分别设置空白组、5 μmol/L RES组、10 μmol/L RES组、20 μmol/L RES组;3号板设置空白组、10 μg/L HTA125组;每组各设3个平行孔,同时设除零组(只加入培养基,不接种细胞,以消除培养基对光密度影响)。待细胞生长24 h后换液,1号板每孔分别加入含对应浓度RES的培养基100 μL;2号板每孔分别加入含对应浓度RES但不含血清的细胞培养基;3号板每孔加入含HTA125但不含血清的培养基。2 h后,将2、3号板置于三气培养箱中缺氧12 h,再移至正常培养箱中复氧4 h,1号板则一直在正常培养箱中培养。4 h后3块板每孔分别加入10 μL CCK-8试剂,继续在正常培养箱中培养2 h,酶标仪检测450 nm波长下光密度值[D(450)]。按以下公式计算细胞存活率,以1号板空白组作为对照组,其他各组皆作为实验组。细胞存活率= [D(450)实验组-D(450)除零组]/[D(450)空白组- D(450)除零组]×100%。
1.5 细胞HE染色将细胞消化离心后(800 r/min,5 min),用培养基调整细胞数为1×105/mL,滴加于盖玻片上,放入正常培养箱中培养,待细胞生长24 h后建模,取出细胞爬片,PBS洗涤3次。样品固定:4%多聚甲醛固定30 min,后PBS洗涤2次;染核:苏木精染色15 min,双蒸水洗涤2次;染细胞质:伊红染色5 min,双蒸水洗涤 2次。晾干爬片,中性树胶封片,显微镜下观察细胞形态。
1.6 检测ALT活力取经建模处理后各组细胞上清液,测定ALT活力。操作按照ALT检测试剂盒说明书进行。
1.7 流式细胞术检测细胞凋亡用0.25%胰酶将经建模处理后的各组细胞消化,800 r/min离心5 min后收集细胞,按Annexin V-PE细胞凋亡试剂盒说明书操作,用流式细胞仪检测细胞凋亡情况。
1.8 实时荧光定量PCR检测mRNA表达采用TRIzol法提取细胞总RNA,并用PrimeScript RT Reagent Kit试剂盒将总RNA反转录成cDNA。反转录条件:42 ℃孵育30 min,95 ℃灭活3 min。取反转录合成的cDNA进行荧光定量PCR,检测TLR4及NF-κB的mRNA表达水平,并以GAPDH作为内参。TLR4引物序列(140 bp):上游5′-GGAGTACAAAACTCTG-CGCC-3′,下游5′-ACTTCCTTGTGCCCTGTGAG-3′;NF-κB-p65引物序列(135 bp):上游5′-CATACGCTG-ACCCTAGCCTG-3′,下游5′-TTTCTTCAATCCGGTGG-CGA-3′;GAPDH引物序列(252 bp):上游5′-ACAG-CAACAGGGTGGTGGAC-3′,下游5′-TTTGAGGGTGC-AGCGAACTT-3′。PCR反应体系:SYBR green 5 μL、上下游引物各0.3 μL、 cDNA 1 μL、Nase-free H2O 3.4 μL; 反应条件:95 ℃预变性5 min,95 ℃变性30 s,59 ℃退火30 s(TLR4,NF-κB)/57 ℃退火30 s(GAPDH),72 ℃ 延伸1 min,反应40个循环。循环结束后,72 ℃延伸5 min。
1.9 Western blot法检测蛋白表达按照RIPA试剂盒说明书提取处理后各组细胞总蛋白,BCA法测定蛋白浓度。每孔上样50 μg,按浓缩胶80 V、分离胶100 V电压下分离,再用250 mA恒流将凝胶上的蛋白湿转至PVDF膜上,5%脱脂奶粉封闭1 h后,分别加入小鼠抗大鼠TLR4抗体(1 ∶1 000)、兔抗大鼠NF-κB抗体、小鼠抗大鼠β-actin抗体(1 ∶1 000),4 ℃孵育过夜;次日用TBST充分洗膜后,加入辣根过氧化物标记的羊抗小鼠IgG(1 ∶5 000)、山羊抗兔IgG(1 ∶5 000),室温孵育1 h。ECL显色,曝光显影,行灰度值扫描分析。
1.10 免疫荧光检测NF-κB p65核转录细胞爬片及建模处理同1.5,将处理后的各组细胞按照标准免疫荧光染色步骤进行固定、穿透、封闭、抗体孵育、DAPI染核及封片[7]。NF-κB抗体稀释浓度为(1 ∶50),荧光二抗稀释浓度为(1 ∶100),荧光显微镜下观察p65入核情况。
1.11 ELISA法检测IL-1β含量取经建模处理后的各组细胞上清液,采用ELISA技术检测IL-1β含量,操作过程按照ELISA试剂盒说明书进行。每组标本设置3个平行孔,结果取平均值。
1.12 统计学分析实验至少重复3次,采用SPSS 17.0统计软件及 Graphpad prism 5.0,计量资料用x±s表示,多样本均数比较采用单因素方差分析,其两两比较采用LSD-t法。
2 结果 2.1 CCK-8实验在1号板中,空白组、5 μmol/L RES组、10 μmol/L RES组及20 μmol/L RES组存活率比较差异无统计学意义(F=0.958,P=0.436),说明RES浓度为5、10、20 μmol/L时对细胞的存活率没有明显影响。在2号板中,5 μmol/L RES组与空白组相比存活率有提升(P=0.045),10、20 μmol/L组存活率均较空白组有显著提升(P<0.01),且细胞存活率在RES浓度为20 μmol/L 时达到最高(表 1)。因此,我们选取20 μmol/L RES进行后续实验。
在3号板中,空白组细胞存活率(60.44±5.56)% 相对于对照组(100.00±0.00)%明显降低(P<0.01),但应用HTA125预处理细胞后,细胞存活率显著升高[(81.65±7.68)%,P<0.01]。
| 组别 | 正常培养 | H/R培养 |
| 空白组 | 100.00±0.00 | 57.59±5.29 |
| 5 μmol/L RES组 | 100.60±3.13 | 67.92±6.71a |
| 10 μmol/L RES组 | 101.50±3.09 | 73.12±8.24b |
| 20 μmol/L RES组 | 98.84±2.44 | 78.79±8.21b |
| a:P<0.05,b:P<0.01,与空白组比较 | ||
2.2 HE染色观察细胞形态学变化
显微镜下观察,空白组与RES组细胞生长状态良好,形状规则,呈梭形或多角形。与空白组细胞相比,H/R组细胞胞体缩小、皱缩,呈不规则状;细胞核固缩、碎裂,培养液中有较多的细胞碎片。与H/R组细胞相比,H/R+RES组细胞形态较规则,受损细胞明显减少。见图 1。

|
| A:空白组;B:RES组;C:H/R组;D:H/R+RES组 图 1 显微镜观察各组BRL-3A细胞形态学变化 (HE ×100) |
2.3 ALT活力检测
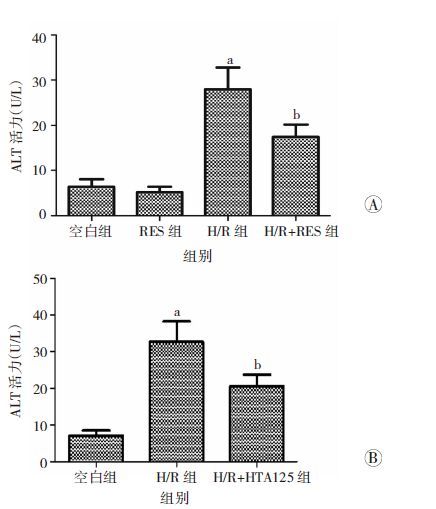
RES预处理,H/R组ALT活力较空白组明显升高(P<0.01);与H/R组相比,H/R+RES组ALT活力显著降低(P=0.002,图 2A)。HTA125预处理,H/R组ALT活力较空白组明显升高(P<0.01);与H/R组相比,H/R+HTA125组ALT活力显著降低(P=0.008,图 2B)。
|
| A:RES预处理;B:HTA125预处理 a: P<0.01,与空白组比较;b: P<0.01,与H/R组比较 图 2 RES和HTA125对细胞ALT活力的影响 |
2.4 流式细胞术检测细胞凋亡
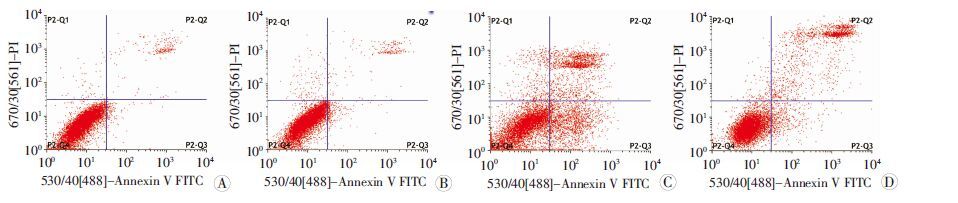
空白组、RES组、H/R组、H/R+RES组细胞凋亡 率分别为(6.53±1.07)%、(7.64±1.26)%、(37.25± 5.21)%、(22.49±4.87)%。H/R组细胞凋亡率较空白组明显升高(P<0.01);与H/R组相比,H/R+RES组细胞凋亡率显著降低(P=0.001,图 3)。
|
| A:空白组;B:RES组;C:H/R组;D:H/R+RES组 图 3 流式细胞术检测各组细胞凋亡情况 |
2.5 实时荧光定量PCR检测
H/R组TLR4、NF-κB-p65 mRNA表达水平均较空白组升高(P<0.01);与H/R组相比,H/R+RES组TLR4、NF-κB-p65 mRNA表达水平均显著降低(P=0.001,表 2)。
| 组别 | TLR4 mRNA | NF-κB-p65 mRNA |
| 空白组 | 1.000±0.000 | 1.000±0.000 |
| RES组 | 1.067±0.037 | 1.050±0.037 |
| H/R组 | 1.870±0.149a | 1.924±0.173a |
| H/R+RES组 | 1.483±0.103b | 1.477±0.125b |
| a: P<0.01,与空白组比较;b: P<0.01,与H/R组比较 | ||
2.6 Western blot检测
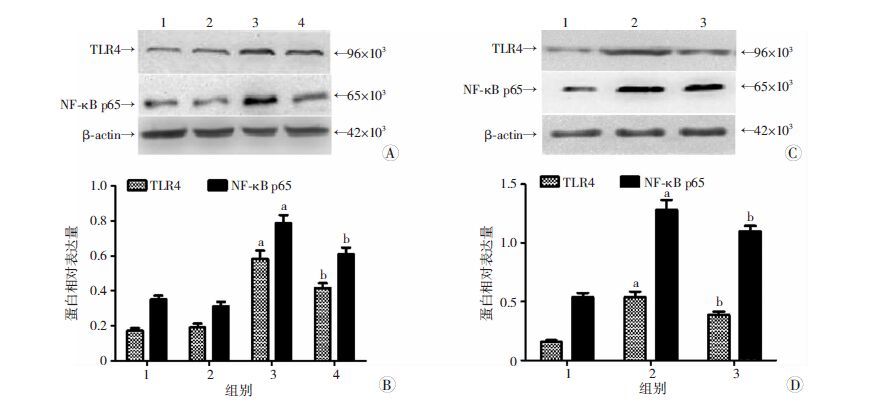
RES预处理,H/R组TLR4、NF-κB-p65蛋白表达水平均较空白组升高(P<0.01);与H/R组相比,H/R+RES组TLR4、NF-κB-p65蛋白表达水平均显著降低(P<0.01,图 4A、B)。
|
| A、B:RES预处理的Western blot 检测及半定量分析 1:空白组,2:RES组,3:H/R组,4:H/R+RES组;C、D:HTA125预处理的Western blot 检测及半定量分析 1:空白组,2:H/R组,3:H/R+HTA125组;a: P<0.01,与空白组比较;b: P<0.01,与H/R组比较 图 4 Western blot 检测TLR4、NF-κB蛋白的表达 |
HTA125预处理,H/R组TLR4、NF-κB-p65蛋白表达水平均较空白组升高(P<0.01);与H/R组相比,H/R+HTA125组TLR4、NF-κB-p65蛋白表达水平均显著降低(P=0.001,图 4C、D)。
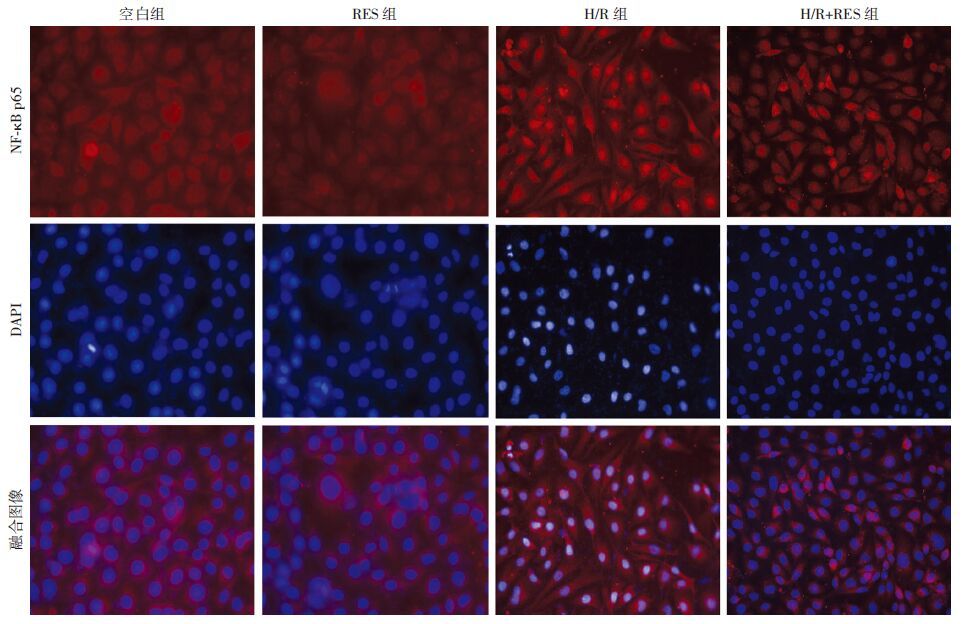
2.7 免疫荧光检测荧光显微镜观察空白组、RES组、H/R组、H/R+RES组p65入核细胞比例分别为(9.44±2.25)%、(9.18±2.38)%、(89.55±6.40)%、(44.60±4.29)%。H/R组p65入核比例较空白组急剧升高(P<0.01);与H/R组相比,H/R+RES组入核细胞比例显著降低(P<0.01,图 5)。
|
| 图 5 免疫荧光检测NF-κB p65入核情况 (×400) |
2.8 ELISA检测
H/R组(201.10±30.01)pg/mL IL-1β含量显著高于空白组[(52.85±8.81)pg/mL,P<0.01];与H/R组细胞相比,H/R+RES组IL-1β含量明显降低[(134.80±16.94)pg/mL,P=0.002]。
3 讨论HIRI是目前复杂肝切除术、肝移植术等临床手术中经常涉及到的病理生理过程,也是引起术后肝功能恶化甚至丧失肝功能的重要原因[8-9]。研究表明HIRI的发生可能与钙超载线粒体通透转换孔道、氧化应激反应、炎症反应、一氧化氮等有关[2]。作为肝脏复杂手术中不能避免的问题,如何进一步了解HIRI机制,以及运用合适的方法来防治HIRI仍然是研究的热点。由于RES具有抗炎和抗氧化损伤等作用,其对心脏缺血再灌注损伤的保护已有报道[10],而RES对HIRI的保护作用在国内却鲜见报道,所以本实验以H/R处理BRL-3A细胞模拟肝脏缺血再灌注模型,着重从抑制炎症反应方面探讨RES对HIRI的影响及其潜在的分子机制。本研究发现:①当RES浓度为5、10、20 μmol/L时,对BRL-3A细胞造成的毒性作用可以忽略不计;②RES和TLR4抑制剂都能够缓解H/R诱导的细胞损伤及凋亡;③RES能下调由H/R诱导造成的细胞TLR4、NF-κB p65 mRNA及蛋白水平的表达;④RES能抑制NF-κB p65入核;⑤RES能够减少由H/R诱导的炎症因子(IL-1β)的释放。本实验证明RES能够通过抑制H/R诱导的BRL-3A细胞炎症反应从而发挥对细胞的保护作用,而这种保护作用可能与抑制TLR4/NF-κB信号通路的传导有关。
细胞存活率和ALT活力通常被看作细胞损伤指标。本研究发现,在H/R状态下BRL-3A细胞的存活率显著降低及细胞上清液中ALT活力明显提高,提示BRL-3A细胞受到了严重损伤。但是RES(5、10、 20 μmol/L)和HTA125(10 μg/mL)能够显著提高H/R状态下BRL-3A细胞的存活率及降低细胞上清液中 ALT活力,提示RES可能对BRL-3A细胞产生保护作用。
本研究还发现,TLR4和NF-κB p65在H/R模型中的表达上调,而RES和HTA125能够抑制H/R诱导的TLR4和NF-κB p65过表达。已有研究证明,TLR4在肝缺血再灌注过程中表达上调,从而激活下游信号通路,进而引起一系列连锁反应[11],而在由TLR4调控的细胞炎症反应相关的信号通路中,NF-κB又是其中一个重要的转录因子[12-13]。本研究发现,在H/R诱导的TLR4过表达状态下,NF-κB也表达上调,且促进p65入核,进而IL-1β分泌增多;应用了RES及HTA125之后,由H/R诱导的BRL-3A细胞TLR4、NF-κB的表达都明显下降,p65入核细胞比例下降。综合以上结果说明,TLR4/NF-κB通路可能在缺氧/复氧诱导的肝细胞损伤中发挥重要作用,而RES很可能是通过抑制TLR4/NF-κB信号通路的传导来抑制炎症反应的发展,从而发挥对细胞的保护作用。
TLR4信号通路由MyD88依赖途径、MyD88非依赖途径或两者共同传导来激活NF-κB,进而刺激炎症因子的释放。NF-κB在静息状态下与其抑制性蛋白(IκB)以三聚体的形式结合,此时NF-κB功能被抑制并以失活状态存在于细胞质中。在接到上游信号分子的刺激之后,IκB激酶(IKK)复合体诱导IκB磷酸化,使其变性降解,因此IκB对NF-κB的抑制作用减弱甚至消失,NF-κB逐渐活化并向细胞核移位,从而调控炎症因子的释放[14]。本实验证明RES能降低TLR4、NF-κB的表达,并抑制p65入核,其作用机制可能是抑制TLR4的活化或者降低IKK复合体的活性,使其不能诱导IκB磷酸化,那么NF-κB仍以失活状态存在于细胞质,不能入核参与炎症因子的表达。
综上所述,我们建议将RES的应用作为防治HIRI的新策略。在后续的实验中,我们也将继续增加动物实验,以探究RES在治疗HIRI过程中的确切机制以及其他潜在的保护作用。
| [1] | Zhai Y, Busuttil R W, Kupiec-Weglinski J W. Liver ischemia and reperfusion injury: new insights into mechanisms of innate-adaptive immune-mediated tissue inflammation[J]. Am J Transplant,2011, 11 (8) : 1563 –1569. DOI:10.1111/j.1600-6143.2011.03579.x |
| [2] | Guan L Y, Fu P Y, Li P D, et al. Mechanisms of hepatic ischemia-reperfusion injury and protective effects of nitric oxide[J]. World J Gastrointest Surg,2014, 6 (7) : 122 –128. DOI:10.4240/wjgs.v6.i7.122 |
| [3] | Hassan-Khabbar S, Vamy M, Cottart C H, et al. Protective effect of post-ischemic treatment with trans-resveratrol on cytokine production and neutrophil recruitment by rat liver[J]. Biochimie,2010, 92 (4) : 405 –410. DOI:10.1016/j.biochi.2009.12.009 |
| [4] | 安梅, 周瑾, 陈晓宇. 白藜芦醇药理学作用的研究进展[J]. 肿瘤医学,2014, 4 (4) : 242 –246. DOI:10.3969/j.issn.2095-1264.2014.049 |
| [5] | Pangeni R, Sahni J K, Ali J A, et al. Resveratrol: review on therapeutic potential and recent advances in drug delivery[J]. Expert Opin Drug Deliv,2014, 11 (8) : 1285 –1298. DOI:10.1517/17425247.2014.919253 |
| [6] | Wang R, Huang F, Chen Z, et al. Downregulation of connexin 32 attenuates hypoxia/reoxygenation injury in liver cells[J]. J Biochem Mol Toxicol,2015, 29 (4) : 189 –197. DOI:10.1002/jbt.21684 |
| [7] | 李胜君, 李梦文, 张燕, 等. 反式激活蛋白-NEMO结合域抑制胆红素诱导的大鼠皮层星形胶质细胞NF-κB活化[J]. 第三军医大学学报,2015, 37 (21) : 2131 –2136. DOI:10.16016/j.1000-5404.201503068 |
| [8] | Karatzas T, Neri A A, Baibaki M E, et al. Rodent models of hepatic ischemia-reperfusion injury: time and percentage-related pathophysiological mechanisms[J]. J Surg Res,2014, 191 (2) : 399 –412. DOI:10.1016/j.jss.2014.06.024 |
| [9] | 麻勇, 汪大伟, 刘连新, 等. 小鼠肝脏部分缺血再灌注损伤模型的建立[J]. 中华消化外科杂志,2013, 12 (9) : 703 –708. DOI:10.3760/cma.j.issn.1673-9752.2013.09.015 |
| [10] | Zhang C, Lin G, Wan W, et al. Resveratrol, a polyphenol phytoalexin, protects cardiomyocytes against anoxia/reoxygenation injury via the TLR4/NF-κB signaling pathway[J]. Int J Mol Med,2012, 29 (4) : 557 –563. DOI:10.3892/ijmm.2012.885 |
| [11] | Zhai D, Zhang J, Zheng Q, et al. Significance of rosiglitazone inhibiting TLR4 expression in partial hepatic ischemia/reperfusion of mice[J]. J Huazhong Univ Sci Technolog Med Sci,2008, 28 (5) : 564 –567. DOI:10.1007/s11596-008-0516-8 |
| [12] | Cui L, Feng L, Zhang Z H, et al. The anti-inflammation effect of baicalin on experimental colitis through inhibiting TLR4/NF-κB pathway activation[J]. Int Immunopharmacol,2014, 23 (1) : 294 –303. DOI:10.1016/j.intimp.2014.09.005 |
| [13] | Li J, Xie C, Zhuang J, et al. Resveratrol attenuates inflammation in the rat heart subjected to ischemia-reperfusion: Role of the TLR4/NF-κB signaling pathway[J]. Mol Med Rep,2015, 11 (2) : 1120 –1126. DOI:10.3892/mmr.2014.2955 |
| [14] | Yamamoto M, Takeda K. Current views of toll-like receptor signaling pathways[J]. Gastroenterol Res Pract,2010, 2010 : 240365 . DOI:10.1155/2010/240365 |



