类鼻疽伯克霍尔德菌(Burkholderia pseudomallei,BP)是一种革兰阴性杆菌,主要存在水或土壤中,极易感染与传播,主要引起以肺炎和多发性脓肿为特点的类鼻疽病,该病诊断难,致病性强,治疗困难,死亡率高达40%,目前尚无针对类鼻疽的有效疫苗[1-3]。研究表明,类鼻疽杆菌在全球的分布范围正在逐步扩大,故加强类鼻疽的研究对疾病的防治具有重要意义[4]。类鼻疽杆菌致死因子1(Burkholderia lethal factor 1,BLF1)是类鼻疽杆菌被发现的第1个重要致病因子,进入机体后能够促进宿主细胞真核翻译起始因子4A(eukaryotic translation initiation factor 4A,eIF4A)的第339位谷氨酰胺(Gln339)脱酰胺变为谷氨酸(Glu339),使其失去mRNA的解旋酶活性,抑制蛋白质的翻译起始阶段,进而抑制蛋白质的合成,使感染宿主细胞受到损伤,导致疾病的发生[5]。获取BLF1毒素并研究其致病机制对类鼻疽的诊断及防治具有重要意义。
近年来,随着蛋白合成抑制剂在抗肿瘤治疗方面的作用逐渐被认可,人们对蛋白质翻译起始因子eIF4A的抑制剂在靶向抗肿瘤治疗中的应用的关注度也越来越高[6-7]。BLF1作为潜在的eIF4A解旋酶活性抑制剂,能够抑制蛋白质的合成。那么我们可以设想,如果将该毒素递送至肿瘤细胞后,毒素是否具有广谱杀伤肿瘤细胞的作用呢?目前国内外尚少见关注于BLF1与肿瘤细胞的报道[8]。本研究拟通过基因工程技术重组表达BLF1(rBLF1)蛋白,初步研究BLF1对肿瘤细胞的杀伤作用,为进一步研究该蛋白在抗肿瘤治疗中的应用提供依据。
1 材料与方法 1.1 材料BPC006菌株、宿主菌E.coli XL1-Blue、pGEX-6P-2质粒、A549细胞为本实验室保存;细菌DNA基因组提取试剂盒、DNA胶回收试剂盒、质粒提取试剂盒购自 美国Omega公司;高保真DNA聚合酶、 BamHⅠ和XhoⅠ限制性内切酶、DNA连接酶、DNA Marker、蛋白Marker购自大连TaKaRa公司;PreScission protease(PSP酶)购于瑞士GE Healthcare公司; HRP标记山羊抗兔IgG抗体,购自北京中杉金桥公司;细胞计数试剂盒购于日本Dojindo公司。
1.2 方法 1.2.1 pGEX-6P-2-BLF1表达载体的构建以BPC006 株的全基因组DNA为模板,引物序列正义链: 5′-CGGGATCCATGCCCAACTCACTCGAAG-3′ (BamHⅠ);反义链:5′-CCGCTCGAGCTATTGCTTGCGCTGCTG-3′(XhoⅠ),PCR扩增目的基因BLF1(636 bp),将BLF1片段和pGEX-6P-2质粒同时进行BamHⅠ/XhoⅠ双酶切,酶切产物用DNA ligation mix于16 ℃连接4 h,连接产物转化E.coli XL1-Blue感受态细胞,在含氨苄的LB平板上37 ℃过夜培养,挑取阳性单克隆转接于氨苄抗性的LB液体培养基中过夜培养,提取质粒,进行BamHⅠ/XhoⅠ双酶切验证,将双酶切验证正确的质粒进行DNA测序。
1.2.2 rBLF1蛋白的表达和纯化阳性重组工程菌于37 ℃培养至D(600)为0.6~0.8,加入0.2 mmol/L IPTG于30 ℃诱导3 h后收集菌体,SDS-PAGE检测融合蛋白GST-BLF1的表达情况。菌体加入PBS缓冲液 重悬菌体,200 W超声裂解15 min,于4 ℃、12 000 r/min 离心20 min,分离上清和沉淀。将含有GST-BLF1融合蛋白的上清与Glutathione Sepharose 4B室温旋转结合4 h,4 ℃、12 000 r/min离心5 min,收集特异性结合GST融合蛋白的Glutathione Sepharose 4B,并加入等体积PBS缓冲液和PreScission protease(PSP酶),于4 ℃旋转酶切过夜。4 ℃离心后收集上清,SDS-PAGE检测rBLF1蛋白的纯度。
1.2.3 多克隆抗体的制备及鉴定2 mg纯化rBLF1蛋白制品,以等体积弗氏完全佐剂充分乳化后,皮下多点接种于新西兰大白兔,每间隔7 d接种1次,共接种3次,第3次加强免疫14 d后进行心脏取血,分离血清于-80 ℃保存备用。
rBLF1蛋白作为抗原包被酶标板(0.4 μg/孔),5%的脱脂奶粉封闭,间接ELISA检测抗体效价,倍比稀释抗血清(1 ∶10 000~1 ∶1 280 000),HRP标记的山羊抗兔IgG为二抗,未免疫家兔血清作为阴性对照,检测抗体滴度,结果判断标准:A样品≥2.1A阴性。
将目的蛋白条带转移至聚偏二氟乙烯(PVDF)薄膜上,加入抗血清孵育后,以HRP标记的山羊抗兔IgG抗体检测rBLF1蛋白的特异性条带,牛血清白蛋白(BSA)作为对照。
1.2.4 动物毒性实验选取50只6周龄雌性BALB/c小鼠,分为5组,每组10只。其中4组分别经腹腔注射150、100、50、25 μg rBLF1蛋白,另1组注射同体积PBS(0.01 mol/L,pH 7.4)作为对照,观察小鼠生存率。
1.2.5 细胞毒性实验将处于对数期生长的A549细胞加入96孔板中(1×103/孔),5%CO2,37 ℃孵箱中培养。次日加入rBLF1蛋白以及5倍和10倍量的多克隆抗体中和后的rBLF1蛋白,每孔蛋白浓度分别为100、50、25、12.5、6.25、3.125、1.562 5 μg/mL;并设阳性对照:吡柔比星;阴性对照:0.01 mol PBS缓冲液 (pH 7.4)及空白对照。每隔48 h 更换1次药物,120 h后用CCK-8试剂盒检测活细胞的数量。
1.3 统计学处理数据采用GraphPad Prism 5统计软件进行处理。
2 结果 2.1 BLF1基因的扩增及原核表达载体pGEX-6P-2-BLF1的构建以BPC006株全基因组DNA为模板,经PCR扩增得到目的基因BLF1(636 bp),重组质粒pGEX-6P-2-BLF1经BamHⅠ/XhoⅠ双酶切鉴定目的片段与理论大小一致(图 1),DNA测序结果与GenBank公布的BLF1基因序列一致。
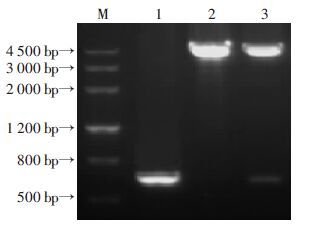
|
| M:DNA标准;1:BLF1基因扩增产物;2:质粒pGEX-6P-2经BamHⅠ/XhoⅠ双酶切产物;3:重组质粒pGEX-6P-2-BLF1经BamHⅠ/XhoⅠ双酶切产物 图 1 BLF1基因的扩增及重组质粒的鉴定 |
2.2 rBLF1蛋白的诱导表达
重组质粒pGEX-6P-2-BLF1转化E.coli XL1-Blue,菌液经IPTG诱导表达的GST-BLF1融合蛋白与预期蛋白相对分子质量一致,表达量达90%,且主要为可溶性表达(图 2)。
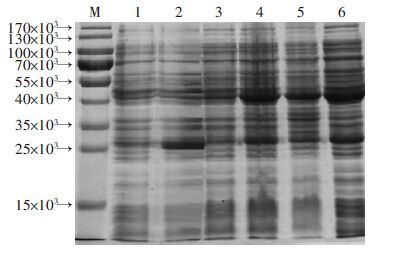
|
| M:标准;1:菌液pGEX-6p-2/XL1-Blue;2:菌液pGEX-6p-2/XL1-Blue于30 ℃诱导3 h;3:菌液BLF1/XL1-Blue;4:菌液BLF1/XL1-Blue 30 ℃诱导3 h;5:菌液BLF1/XL1-Blue经超 声破碎后的沉淀; 6:菌液BLF1/XL1-Blue经超声破碎后的上清 图 2 融合蛋白在E.coli XL1-Blue中的表达 |
2.3 rBLF1蛋白的纯化
将表达的GST-BLF1融合蛋白纯化后,用PreScission protease(PSP酶)将GST标签切除,得到rBLF1,经SDS-PAGE检测表明rBLF1条带为23×103,与预期相对分子质量一致(图 3)。
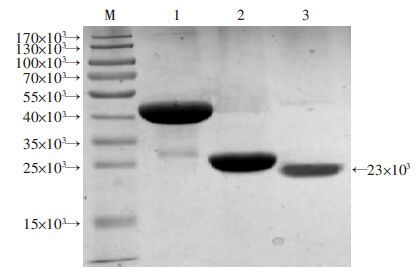
|
| M:标准;1:GST-BLF1融合蛋白;2:GST标签;3:rBLF1 图 3 rBLF1蛋白的纯化 |
2.4 多克隆抗体的制备
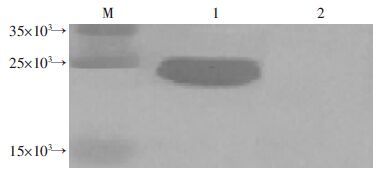
重组蛋白免疫家兔,ELISA检测结果显示,抗体滴度达1 280 000。以BLF1蛋白作为抗原制备的抗血清作为一抗,以山羊抗兔IgG作为二抗对rBLF1进行Western blot分析,在23×103出现特异性免疫印迹条带(图 4)。
|
| M:标准;1:rBLF1;2:BSA 图 4 rBLF1多克隆抗体的免疫印迹检测 |
2.5 动物毒性实验
rBLF1通过腹腔注射于BALB/c小鼠后可引起动 物死亡。5 d内,小鼠基本无死亡;毒素蛋白剂量为25 μg 时,小鼠死亡率为10%,后期小鼠死亡率随着蛋白剂量的增加而升高(图 5)。
|
| 图 5 rBLF1蛋白对BALB/c小鼠的致死作用 |
2.6 细胞毒性实验
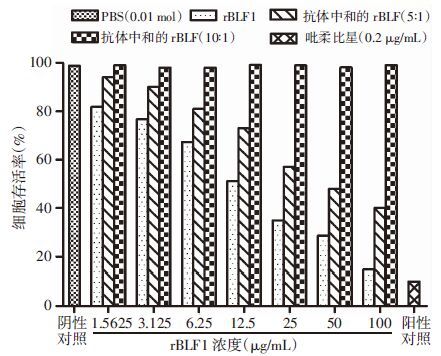
正常生长的A549细胞折光性好,胞膜较清晰,胞质透亮。经rBLF1蛋白作用120 h后,可见96孔板内A549细胞贴壁减少,胞质圆缩,随着蛋白浓度的升高,细胞多见碎片或明显皱缩。经CCK-8试剂盒检测可见细胞存活率随着rBLF1蛋白浓度的增加而降低,呈剂量依赖性,而rBLF1蛋白经多克隆抗体中和后,细胞存活率增高,说明rBLF1能够杀伤A549细胞,而多克隆抗体能够抑制rBLF1蛋白杀伤作用(图 6)。
|
| 图 6 rBLF1蛋白对A549细胞的毒性作用 |
3 讨论
BLF1作为类鼻疽杆菌的首个被发现的致死因子,在致病过程中发挥重要作用,于2011年被英国科学家Cruz-Migoni等[5]发现。BLF1由BPSL1549基因编码,结构类似于大肠杆菌细胞毒性坏死因子1(CNF1-C),主要通过干扰蛋白质翻译起始,导致肌动蛋白细胞骨架的改变,并最终导致细胞死亡[9-10]。本研究采用pGEX载体,高效表达了GST-BLF1融合蛋白,并运用亲和层析方法纯化获得了纯度较高的rBLF1蛋白,经细胞和动物实验证实其具有生物学活性。
类鼻疽杆菌的致病机制尚不清楚,而BLF1作为其第1个被发现的能够导致死亡的毒力因子,在类鼻疽杆菌的致病中发挥着重要作用。类鼻疽的临床表现与多种疾病相似,故诊断极难,而BLF1作为类鼻疽杆菌的致死因子,能够引起强烈的免疫应答,其特异性的抗体检测将来可用于类鼻疽的实验室诊断。同时毒素BLF1的蛋白结构解析及其作用于细胞的分子生物学机制的研究,为寻找新型药物靶点奠定了坚实的理论基础,如将BLF1作为靶点研究新型的小分子药物,可用于钝化BLF1 的作用位点,阻止其脱酰胺作用,进而防止细胞损伤,阻止疾病的发生。因BLF1对细胞的毒性较高,Cruz-Migoni等[5]对其活性位点进行突变后,突变体C94S毒性显著下降,其谷氨酰胺脱酰胺酶活性受到抑制,将来可作为疫苗候选抗原。
BLF1作用靶点为蛋白翻译起始因子eIF4A 的解旋酶,能够抑制宿主细胞蛋白合成。本实验证实毒素rBLF1具有广谱细胞毒性,既能明显杀伤肿瘤细胞,同时也能杀伤正常细胞。但是从动物实验结果我们可看出,该毒素对正常小鼠致死剂量较高(与其他生物毒素如蓖麻毒素10 μg/kg相比)作用速度较慢(5 d以前未见死亡),说明正常细胞对其可能具有一定耐受性。而肿瘤细胞生长旺盛,则更利于毒素的作用发挥。rBLF1表现出对肿瘤细胞比较敏感、具有耐受正常细胞的特点[11],为毒素的抗肿瘤治疗提供了可行性。进一步我们正在探索毒素的治疗用药窗口剂量,使其在杀伤肿瘤细胞的同时不影响正常细胞的功能。另外,BLF1是一种生物毒素,作为肿瘤药物作用于机体后,对正常细胞仍然具有一定的毒副作用,为了降低其毒副作用,可采用靶向给药方式将毒素递送至肿瘤细胞,如可通过双特异性抗体技术、抗体融合技术将BLF1结合的单克隆抗体或整合素αVβ3配体RGD肽靶向呈递肿瘤靶细胞发挥其肿瘤杀伤作用[12-15]。
| [1] | Wiersinga W J, Currie B J, Peacock S J. Melioidosis[J]. N Engl J Med,2012, 367 (11) : 1035 –1044. DOI:10.1056/NEJMra1204699 |
| [2] | Foong Y C, Tan M, Bradbury R S. Melioidosis: a review[J]. Rural Remote Health,2014, 4 (4) : 2763 . |
| [3] | Silva E B, Dow S W. Development of Burkholderia mallei and pseudomallei vaccines[J]. Front Cell Infect Microbiol,2013, 3 : 10 . DOI:10.3389/fcimb.2013.00010 |
| [4] | 毛旭虎. 加强类鼻疽的研究[J]. 第三军医大学学报,2011, 33 (13) : 1315 –1317. DOI:10.16016/j.1000-5404.2011.13.013 |
| [5] | Cruz-Migoni A, Hautbergue G M, Artymiuk P J, et al. A Burkholderia pseudomallei toxin inhibits helicase activity of translation factor eIF4A[J]. Science,2011, 334 (6057) : 821 –824. DOI:10.1126/science.1211915 |
| [6] | Lindqvist L, Pelletier J. Inhibitors of translation initiation as cancer therapeutics[J]. Future Med Chem,2009, 1 (9) : 1709 –1722. DOI:10.4155/fmc.09.122 |
| [7] | Chu J, Pelletier J. Targeting the eIF4A RNA helicase as an anti-neoplastic approach[J]. Biochim Biophys Acta,2015, 1849 (7) : 781 –91. DOI:10.1016/j.bbagrm.2014.09.006 |
| [8] | Hautbergue G M, Wilson SA. BLF1, the first Burkholderia pseudomallei toxin, connects inhibition of host protein synthesis with melioidosis[J]. Biochem Soc Trans,2012, 40 (4) : 842 –845. DOI:10.1042/BST20120057 |
| [9] | Fabbri A, Travaglione S, Ballan G, et al. The cytotoxic necrotizing factor 1 from E.coli: a janus toxin playing with cancer regulators[J]. Toxins (Basel),2013, 5 (8) : 1462 –1474. DOI:10.3390/toxins5081462 |
| [10] | Buetow L, Flatau G, Chiu K, et al. Structure of the Rho-activating domain of Escherichia coli cytotoxic necrotizing factor 1[J]. Nat Struct Biol,2001, 8 (7) : 584 –588. |
| [11] | From S, Plusa T. Today’s threat of ricin toxin[J]. Pol Merkur Lekarski,2015, 39 (231) : 162 –164. |
| [12] | Danhier F, Le-Breton A, Preat V. RGD-based strategies to target alpha(v) beta(3) integrin in cancer therapy and diagnosis[J]. Mol Pharm,2012, 9 (11) : 2961 –2973. DOI:10.1021/mp3002733 |
| [13] | Fauvel B, Yasri A. Antibodies directed against receptor tyrosine kinases: current and future strategies to fight cancer[J]. MAbs,2014, 6 (4) : 838 –851. DOI:10.4161/mabs.29089 |
| [14] | Kontermann R E, Brinkmann U. Bispecific antibody[J]. Drug Discov Today,2015, 20 (7) : 838 –847. DOI:10.1016/j.drudis.2015.02.008 |
| [15] | de-Bruyn M, Bremer E, Helfrich W. Antibody-based fusion proteins to target death receptors in cancer[J]. Cancer Lett,2013, 332 (2) : 175 –183. DOI:10.1016/j.canlet.2010.11.006 |



