结肠癌是全球最常见的恶性肿瘤之一[1]。早期结肠癌患者5年生存率可达90%,但对于晚期结肠癌,患者生存率仅为10%~15%[2]。因此,提高结肠癌早期诊断的效率是减少结肠癌患者死亡的关键环节。目前用于筛查结肠癌的分子标志物主要为糖链抗原(carbohydrate antigen,CA)、癌胚抗原(carcinoembryonic antigen,CEA)等。尽管这些分子标志物能较好地诊断晚期结肠癌,但对于早期结肠癌的诊断,其敏感性和特异性均较低[3]。
长链非编码RNA(long non-coding RNA,lncRNA) 是一类长度200~100 000 nt的单链RNA分子,不编码蛋白[4]。近年来,大量的研究表明lncRNA的表达失调与肿瘤的复发、转移以及患者的预后密切相关[5, 6, 7]。一些研究也指出lncRNA可能作为一类新的诊断癌症的生物标志物,如HOTAIR[8]、ncRuPAR[9]。已有研究表明在结肠癌组织中上调的lncRNAs,如CCAT1[10]、 HOTAIR[11]、 H19[12]。然而,少有文献报道血清中lncRNA的检测方法以及血清中lncRNA表达谱在结肠癌诊断中的应用[13]。因此,本研究拟从已报道的结肠癌组织中高表达的lncRNA HOTAIR出发,分析结肠癌患者血清中HOTAIR的表达及其在结肠癌诊断中的应用价值。
1 资料与方法 1.1 临床资料纳入标准:(1)年龄20~80岁,患者或家属同意;(2)活检或者手术证实为结肠癌(结肠癌组);(3)经内镜、CT、病理等辅助检查确定志愿者无结肠癌及癌前病变,无任何恶性肿瘤、感染性疾病、高血压、高血脂、糖尿病等病史。排除标准:(1)接受结直肠癌手术治疗或者放化疗后的患者;(2)转移性结肠癌。样本取自2014年7月至2015年11月期间在第三军医大学新桥医院消化内科与普通外科住院的结肠癌患者及志愿者,在纳入排除标准下共收集到10对结肠癌及癌旁组织,47例结肠癌患者血清及40例正常健康志愿者血清。10例结肠癌组织标本中,男性7例,女性3例,平均年龄63.4(46~80)岁;47例结肠癌血清样本中,男性31例,女性16例,平均年龄58.98(33~80)岁;40例志愿者血清样本中,男性25例,女性15例,平均年龄59.07(26~77)岁。见表 1。对于组织样本,所取癌旁组织与癌组织边缘的距离>5 cm,将组织剪成小块后,立即冻存于液氮中。 对于血清样本,收集患者及志愿者5 mL全血,1 000 r/min离心15 min,吸取血清至1.5 mL无酶离心管中,12 000 r/min离心5 min,吸取血清至新的1.5 mL无酶离心管中,-80 ℃保存。本研究符合第三军医大学新桥医院伦理委员会要求。
| 组别 | 总例数 | 男(例) | 女(例) | 平均年龄(岁) | CA199(例) | 分化类型(例) | T分期(例) | N分期(例) | M分期(例) | ||||||||||
| < 37(U/mL) | ≥37(U/mL) | 高 | 中 | 低 | T1 | T2 | T3 | T4 | N0 | N1 | N2 | N3 | M0 | M1 | |||||
| 结肠癌组织标本组 | 10 | 7 | 3 | 63.4 | 5 | 5 | 0 | 6 | 4 | 0 | 2 | 3 | 5 | 2 | 6 | 2 | 0 | 7 | 3 |
| 结肠癌血清样本组 | 47 | 31 | 16 | 58.98 | 30 | 17 | 10 | 26 | 11 | 2 | 7 | 16 | 22 | 13 | 18 | 12 | 4 | 37 | 10 |
| 正常志愿者血清组 | 40 | 25 | 15 | 59.07 | 40 | 0 | - | - | - | - | - | - | - | - | - | - | - | - | - |
采用TRIzol LS试剂(美国Invitrogen公司) 提取血清中的RNA。按照3 :1的比例加入750 μL TRIzol LS和250 μL 血清样品,加入10 μL 50 nmol/L的Cel-miR-39[14],充分混匀,加入200 μL氯仿,混匀,静置10 mim,12 000 r/min 离心15 min,吸取上清液于另一新的1.5 mL无酶离心管中,加入400 μL异丙醇,混匀,静置8 min,12 000 r/min 离心10 min,弃上清液,加入1 mL 75%乙醇洗涤,7 500 r/min离心5 min,弃上清液,重复离心,用10 μL 移液器汲出多余的乙醇,用20 μL 65 ℃无酶水溶解RNA,冻存于-80 ℃。采用TRIzol试剂(美国Invitrogen公司)提取组织中的RNA。先用液氮将组织碾碎,按照50~100 mg组织加入1 mL TRIzol的比例加入试剂,混匀,根据试剂说明书进行提取,用35 μL 65℃无酶水溶解RNA,冻存于-80℃。
1.3 qRT-PCR采用PrimeScriptTM RT Reagent Kit with gDNA Eraser试剂(大连TaKaRa公司)对总RNA进行逆转录,每20 μL体系逆转录1 μg RNA,逆转录反应试剂及步骤:加入7 μL 60 ng/μL RNA (血清中RNA含量较少,约60 ng/μL)、2 μL 5 × gDNA Eraser buffer、1 μL gDNA Eraser,混匀,45 ℃反应1 min,继续加入4 μL 5×PrimeScript Enzyme Buffer、1 μL PrimeScript Enzyme、1 μL PrimeScript RT Mix,4 μL Nuclease-free H2O,混匀,37 ℃反应15 min,获得cDNAs。采用SYBR Premix Ex Taq Ⅱ 试剂(大连TaKaRa公司)对合成的cDNA进行扩增,反应体系为10 μL,qPCR反应试剂及步骤:加入 5 μL 2 × SYBR® Premix Ex TaqTM、0.2 μL Primer Forward (10 pmol/μL)、 0.2 μL Primer Reverse (10 pmol/μL)、 0.2 μL ROX Dye Ⅱ、2.4 μL Nuclease-free H2O,混匀,采用ABI step one进行扩增,反应条件为:95 ℃反应2 min,40个循环于95 ℃反应15 s、58 ℃ 反应30 s,在58 ℃时采集荧光;溶解温度,从58 ℃ 逐渐增加至95 ℃,每增加0.5 ℃采集1次荧光。HOTAIR的5对不同区段的引物如下:P1上游引物 5′-CGCTTCGCAGTGGAATGGAA-3′,P1下游引物5′-CC-GTGGCA-TTTCTGGTCTTGT-3′; P2上游引物 5′-AAGACGGGCA-CTCACAGACA-3′,P2下游引物 5′- AGC-GTTCTCTGGGCGTTCAT-3′; P3上游引物 5′-ACAGAGTCCGTTCAGTGTCAGA-3′,P3下游引物 5′-ATT-GGGCTGG-GTCTACACAAGT-3′; P4上游引物 5′-TGC-TTCGTGCTGATTCCTAGAC-3′,P4下游引物 5′- TTGC-TCTGTGCTGCCAGTTAG-3′; P5上游引物 5′- GCCTGAACTTCCTCCTGCTATT-3′,P5下游引物 5′- ACAC-AAAGTGCATACCTACCCA-3′。GAPDH的引物如下:上游 5′-TGAAGGTCGGAGTCAACG GATT-3′,下游 5′-CTCGCTCCTGGAAGATG GTGAT-3′。Cel-miR-39的逆转录引物及PCR引物均购于上海吉玛公司。
1.4 统计学处理Mann-Whitney test用于比较结肠癌患者和正常志愿者血清中HOTAIR的表达;配对t检验用于比较结肠癌和癌旁组织中HOTAIR的表达;工作特征曲线(receiver-operating characteristic,ROC)用于分析血清中HOTAIR的表达值在结肠癌诊断中的意义;约登指数用于分析最佳切点值;Pearson相关性分析获得HOTAIR 的表达值与CA199值的相关性;所有统计在GraphPad Prism 6.0 (Graphpad Software Inc,Caligornia)软件上进行。
2 结果 2.1 LncRNA HOTAIR片段在血清中的表达检测由于HOTAIR的长度较长(2 370 bp),可能以片段形式存在于外周血中,所以我们设计了5对引物检测HOTAIR在血清中的表达,这5对引物分别针对HOTAIR的不同区段进行检测(图 1A)。采用这5对引物分别检测5例正常志愿者和5例结肠癌患者血清中HOTAIR的表达,发现Primer 1,4,5均能检测到HOTAIR在血清中的表达,且结肠癌患者血清中HOTAIR的表达显著高于正常志愿者(P<0.05,P<0.01,P<0.01)而Primer 2,3未能检测到HOTAIR的表达(图 1B)。因为Primer 5所检测到的HOTAIR表达差异有统计学意义,所以我们采用这对引物进行后续的研究。
 |
| A: 针对HOTAIR全长(2 370 bp)设计5对引物,扩增血清中HOTAIR不同区段的表达;B:引物1,3,5均能检出结肠癌患者及正常志愿者血清中HOTAIR片段的表达,且两者差异有统计学意义;a: P < 0.05, b: P < 0.01,与正常志愿者比较 图 1 LncRNA HOTAIR不同区段的引物设计及验证 |
为明确采用Primer 5检测的HOTAIR在结肠癌组织及患者血清中的表达,我们收集了10例结肠癌和癌旁组织样本,以及47例结肠癌患者血清和40例正常志愿者血清样本。结果显示,10例组织样本中,8例结肠癌组织中HOTAIR呈显著高表达(P<0.05,图 2A),且结肠癌患者血清中HOTAIR的表达显著高于正常志愿者(P<0.01,图 2B)。进一步采用工作特征曲线分析,发现血清中HOTAIR的表达值大于13.30时诊断结肠癌的敏感性为65.96%,特异性为85.00%,曲线下面积为0.7410 (图 2C),提示血清中HOTAIR的表达值可能用于检测结肠癌。
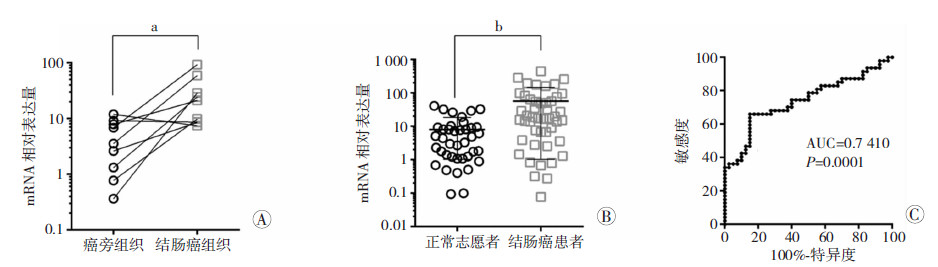 |
| A: 结肠癌组织中HOTAIR的表达 a: P<0.05,与癌旁组织比较;B: 结肠癌患者血清中HOTAIR的表达 b: P<0.01,与正常志愿者血清比较;C: 结肠癌患者血清样本中敏感性和特异性的相关性分析 图 2 结肠癌患者血清中LncRNA HOTAIR的表达 |
为进一步明确血清中HOTAIR的表达在诊断结肠癌中的意义,我们分析了其与患者临床资料的相关性,发现TNM Ⅰ/Ⅱ期与结肠癌患者血清中HOTAIR的表达差异无统计学意义(P=0.106 1),而Ⅲ/Ⅳ期患者显著高于正常志愿者(P=0.000 2),且Ⅲ/Ⅳ期显著高于Ⅰ/Ⅱ期 (P<0.05,图 3A)。同时,淋巴结转移及非转 移的结肠癌患者血清中HOTAIR的表达显著高于正常志愿者(P<0.01,P<0.000 1),且淋巴结转移患者显著高于非转移患者(P<0.05,图 3B)。进一步分析血清中HOTAIR的表达与CA199值的相关性,发现二者呈显著正相关(P<0.01,R2=0.147 1,图 3C)。
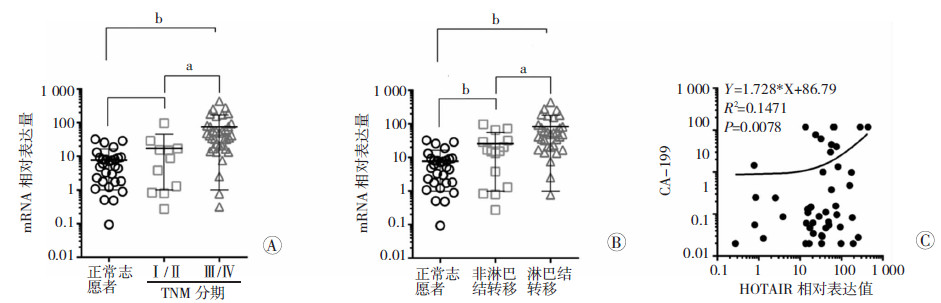 |
| A:结肠癌患者血清HOTAIR的表达 a: P<0.05,与Ⅰ/Ⅱ期比较; b: P<0.01,与正常志愿者比较;B: 淋巴结转移及非转移的结肠癌患者血清中HOTAIR的表达 a: P<0.05,与非淋巴结转移比较; b: P<0.01,与正常志愿者比较;C: 结肠癌患者血清中CA199与HOTAIR表达值的相关性分析 图 3 结肠癌患者血清中LncRNA HOTAIR的表达与临床指标的相关性分析 |
为明确Primer 5检测片段稳定存在于血清中,我们分别行室温放置数天和反复冻融数次后观察HOTAIR片段的稳定性,结果发现,采用Primer 5检测的HOTAIR片段稳定地存在于结肠癌患者血清中(图 4A、B)。
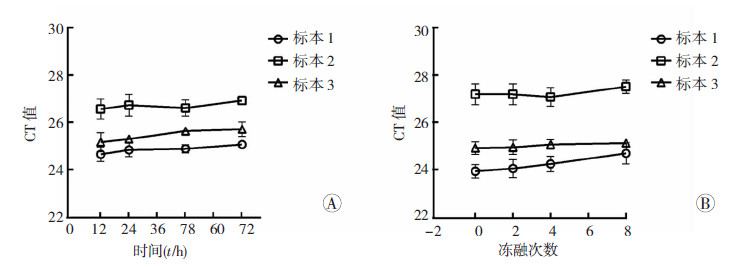 |
| A:不同时间检测结肠癌患者血清中HOTAIR的表达;B: 不同冻融次数检测结肠癌患者血清中HOTAIR的表达 图 4 结肠癌患者血清中LncRNA HOTAIR的稳定性分析 |
近年来,研究表明HOTAIR在消化系统肿瘤中高表达,但少有文献分析HOTAIR在结肠癌组织及患者血清中的表达情况[8, 15, 16, 17, 18]。Svoboda等[19]研究发现HOTAIR在结肠癌患者外周血中呈高表达且与患者不良预后密切相关,但其指出HOTAIR在外周血中的表达尽管差异有统计学意义,但不显著。最近的研究表明,因为lncRNA的长度较长,导致其容易断裂或不稳定,所以可能主要以片段的形式存在于外周血中,而Wang等[20]的研究采用多对引物对lncRNA进行扩增后,发现lncRNA的部分片段呈高表达且稳定地存在于外周血中。因此,本研究设计了5对针对HOTAIR不同区段的引物,结果发现Primer 5的扩增效果最为明显,而Primer 2,3都未能检测出HOTAIR在血清中的表达,提示HOTAIR在血清中可能以片段形式存在。
采用Primer 5检测HOTAIR在组织中的表达,发现大部分组织中HOTAIR呈高表达,与其在其他消化系统肿瘤中的表达情况一致,但Svoboda等[19]研究表明HOTAIR的表达在结肠癌组织与结肠正常黏膜之间差异没有统计学意义,可能与其采用的结肠正常黏膜组织或扩增引物有关,也可能和我们采用的结肠癌组织样本较少有关。进一步采用较大样本检测发现HOTAIR 在结肠癌患者血清中呈显著高表达,这与Svoboda等[19]的研究结果一致,不同的是本研究中HOTAIR的表达在评估结肠癌诊断中有较高敏感性和特异性,提示血清中HOTAIR的高表达可能是诊断结肠癌潜在生物标志,而得出这样的结论可能与不同人群的样本,以及采用不同的PCR引物有关。
本研究进一步分析发现血清中HOTAIR的表达与结肠癌TNM分期,淋巴结转移及CA199值密切相关。Wu等[11]研究发现HOTAIR在结肠癌组织中显著高表达,且与淋巴结转移,患者不良生存率等密切相关,并指出HOTAIR的表达影响结肠癌细胞的表皮间质转化(epithelial-mesenchymal transition,EMT)。这些结论均支持我们的观点,即HOTAIR的表达与结肠癌转移密切相关。不同的是,我们分析结肠癌患者血清中HOTAIR的表达,其意义在于可以通过非侵袭性方式获得HOTAIR的表达值,进而对结肠癌诊断进行评估。本研究还发现血清中HOTAIR的表达与CA199值存在显著的正相关,提示血清中HOTAIR的表达值可能与CA199对结肠癌进行联合诊断,进而提高诊断准确率。
通过对血清中HOTAIR的稳定性分析发现,不管是在室温放置数天或者反复冻融数次的情况下,HOTAIR的表达均比较稳定,表明采用HOTAIR Primer 5 能够稳定地检测HOTAIR在血清中的表达。由于本研究采用的患者样本数量较少,以及收集的样本时间较短,所以其他的临床指标未能分析,以及血清中HOTAIR的表达与患者生存率的相关性未能分析。因此,在下一步研究中,我们将扩大样本量,进一步分析血清中HOTAIR的表达值在诊断结肠癌或患者预后判断中的意义。
综上所述,本研究建立了稳定检测血清中HOTAIR 表达的方法,检测发现结肠癌患者血清中HOTAIR的表达显著高于正常志愿者,且与结肠癌TNM分期,淋巴结转移及CA199值密切相关,提示血清中HOTAIR的表达值可能作为生物标志诊断结肠癌。
| [1] | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012, 62(1): 10-29. DOI:10.3322/caac.20138 |
| [2] | Yokota J. Tumor progression and metastasis[J]. Carcinogenesis, 2000, 21(3): 497-503. |
| [3] | Vukobrat-Bijedic Z, Husic-Selimovic A, Sofic A, et al. Cancer antigens (CEA and CA199) as markers of advanced stage of colorectal carcinoma[J]. Med Arh, 2013, 67(6): 397-401. DOI:10.5455/medarh.2013.67.397-401 |
| [4] | Volders P J, Helsens K, Wang X, et al. LNCipedia: a database for annotated human lncRNA transcript sequences and structures[J]. Nucleic Acids Res, 2013, 41(Database issue): D246-D251. DOI:10.1093/nar/gks915 |
| [5] | Glover A R, Zhao J T, Ip J C, et al. Long noncoding RNA profiles of adrenocortical cancer can be used to predict recurrence[J]. Endocr Relat Cancer, 2015, 22(1): 99-109. DOI:10.1530/ERC-14-0457 |
| [6] | Liu B, Sun L, Liu Q, et al. A cytoplasmic NF-κB interacting long noncoding RNA blocks IκB phosphorylation and suppresses breast cancer metastasis[J]. Cancer Cell, 2015, 27(3): 370-381. DOI:10.1016/j.ccell.2015.02.004 |
| [7] | Han L, Zhang E B, Yin D D, et al. Low expression of long noncoding RNA PANDAR predicts a poor prognosis of non-small cell lung cancer and affects cell apoptosis by regulating Bcl-2[J]. Cell Death Dis, 2015, 6: e1665. DOI:10.1038/cddis.2015.30 |
| [8] | Lv X B, Lian G Y, Wang H R, et al. Long noncoding RNA HOTAIR is a prognostic marker for esophageal squamous cell carcinoma progression and survival[J]. PLoS One, 2013, 8(5): e63516. DOI:10.1371/journal.pone.0063516 |
| [9] | Liu L, Yan B, Yang Z, et al. ncRuPAR inhibits gastric cancer progression by down-regulating protease-activated receptor-1[J]. Tumour Biol, 2014, 35(8): 7821-7829. DOI:10.1007/s13277-014-2042-6 |
| [10] | Xiang J F, Yin Q F, Chen T, et al. Human colorectal cancer-specific CCAT1-L lncRNA regulates long-range chromatin interactions at the MYC locus[J]. Cell Res, 2014, 24(5): 513-531. DOI:10.1038/cr.2014.35 |
| [11] | Wu Z H, Wang X L, Tang H M, et al. Long non-coding RNA HOTAIR is a powerful predictor of metastasis and poor prognosis and is associated with epithelial-mesenchymal transition in colon cancer[J]. Oncol Rep, 2014, 32(1): 395-402. DOI:10.3892/or.2014.3186 |
| [12] | Tsang W P, Ng E K, Ng S S, et al. Oncofetal H19-derived miR-675 regulates tumor suppressor RB in human colorectal cancer[J]. Carcinogenesis, 2010, 31(3): 350-358. DOI:10.1093/carcin/bgp181 |
| [13] | Zeng S, Xiao Y F, Tang B, et al. Long Noncoding RNA in Digestive Tract Cancers: Function, Mechanism, and Potential Biomarker[J]. Oncologist, 2015, 20(8): 898-906. DOI:10.1634/theoncologist.2014-0475 |
| [14] | Li B S, Zhao Y L, Guo G, et al. Plasma microRNAs, miR-223, miR-21 and miR-218, as novel potential biomarkers for gastric cancer detection[J]. PLoS One, 2012, 7(7): e41629. DOI:10.1371/journal.pone.0041629 |
| [15] | Kim K, Jutooru I, Chadalapaka G, et al. HOTAIR is a negative prognostic factor and exhibits pro-oncogenic activity in pancreatic cancer[J]. Oncogene, 2013, 32(13): 1616-1625. DOI:10.1038/onc.2012.193 |
| [16] | Du M, Wang W, Jin H, et al. The association analysis of lncRNA HOTAIR genetic variants and gastric cancer risk in a Chinese population[J]. Oncotarget, 2015, 6(31): 31255-31262. DOI:10.18632/oncotarget.5158 |
| [17] | Endo H, Shiroki T, Nakagawa T, et al. Enhanced expression of long non-coding RNA HOTAIR is associated with the development of gastric cancer[J]. PLoS One, 2013, 8(10): e77070. DOI:10.1371/journal.pone.0077070 |
| [18] | Chen F J, Sun M, Li S Q, et al. Upregulation of the long non-coding RNA HOTAIR promotes esophageal squamous cell carcinoma metastasis and poor prognosis[J]. Mol Carcinog, 2013, 52(11): 908-915. DOI:10.1002/mc.21944 |
| [19] | Svoboda M, Slyskova J, Schneiderova M, et al. HOTAIR long non-coding RNA is a negative prognostic factor not only in primary tumors, but also in the blood of colorectal cancer patients[J]. Carcinogenesis, 2014, 35(7): 1510-1515. DOI:10.1093/carcin/bgu055 |
| [20] | Wang Y, Li Z, Zheng S, et al. Expression profile of long non-coding RNAs in pancreatic cancer and their clinical significance as biomarkers[J]. Oncotarget, 2015, 6(34): 35684-35698. DOI:10.18632/oncotarget.5533 |



