2400010重庆,重庆医科大学附属第二医院皮肤科 ;
3430070武 汉,广州军区武汉总院皮肤科 ;
4610083成都,成都军区总医院皮肤科 ;
5大学大坪医院野战外科研究所:整形美容科
2 Department of Dermatology, the Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400010 ;
3 Department of Dermatology, Wuhan General Hospital of Guangzhou Military Command, Wuhan, Hubei Province, 430070 ;
4 Department of Dermatology, General Hospital of Chengdu Military Command, Chengdu, Sichuan Province, 610083, China ;
5 Department of Plastic Surgery, Institute of Surgery Research, Daping Hospital, Third Military Medical University, Chongqing, 400042
近年来随着研究的不断深入,成纤维细胞(fibroblasts,Fbs)已成为重要的创伤修复细胞,人真皮成纤维细胞(human dermal fibroblasts,hFbs)和真皮间充质干细胞(dermal mesenchymal stem cells,DMSCs)具有部分相似的表面抗原,如CD14(-)、CD29(+)、CD31(-)、CD34(-)、CD44(+)和CD45(-)等,可以经诱导成脂、成软骨和成骨分化[1]。诱导Fbs成骨分化的方式多以纤维结合蛋白(fibronectin,FN)、生肌液或者骨形态发生蛋白(BMP-2)加TNF-α等化学诱导为主[2]。2006年何川等[3]首次采用组织工程方法构建藻酸丙二醇酯(PGA)网架探讨三维培养对Fbs成骨分化的影响,结果显示骨特异性标志骨钙素(OCN)和骨特异性碱性磷酸酶(B-AKP)均有表达,并产生大量细胞外基质形成骨样组织。另外有研究表明,将含有干细胞的三维结构置于灌注系统中施加剪切力刺激有利于干细胞向成骨分化[4]。但对于hFbs类似的研究甚少,本实验拟在通过构建hFbs胶原凝胶三维支架,探讨不同灌注速度产生的流体剪切力对细胞增殖及成骨分化的影响,为hFbs的增殖分化提供重要依据。
1 材料与方法 1.1 主要试剂与仪器地塞米松、VD3、β-甘油磷酸钠、抗坏血酸、茜素红S(Alizarin Red S,ARS)、Ⅱ型胶原酶均购于Sigma公司;分离酶(Roche公司)、胰蛋白酶(Gibco公司)、胎牛血清(FBS,Gibco公司)、Vimentin试剂盒(中杉公司)、葡萄糖试剂盒(恒远生物公司)、FQ-PCR试剂盒(TaKaRa公司)、荧光定量PCR仪(Bio-Rad公司)、青霉素与链霉素(山东鲁抗医药)、倒置显微镜(Olympus公司)、蠕动泵及硅胶管(重庆恒杰蠕动泵有限公司)、切片机(Leica 公司)。
1.2 实验方法 1.2.1 培养液及固定液配置hFbs培养基:DMEM高糖培养基添加5%小牛血清及100 U/mL双抗;成骨诱导液(osteogenesis induced medium,OIM)参考李冬梅等[5]方法增加了部分成分含量,最终配比为:10%胎牛血清、10 nmol/L地塞米松、100 nmol/L 25-(OH)2D3、5 nmol/L β-甘油磷酸钠、25 μmol抗坏血酸。
1.2.2 灌注装置该装置为本实验室已建立模型,由蠕动泵、无菌硅胶管、储液瓶、生物反应盒及培养盘构成[6],其中培养盘置于生物反应盒内,培养盘主要由以下几部分组成:静压槽、截流装置、培养室、培养板、后溢流台和泄流沟。工作原理是通过蠕动泵转动带动培养基从储液瓶流入静压槽,并产生稳定压头,再经截流装置进入培养室,从而在培养室中形成平面均匀流场,随后培养基经后溢流台至泄流沟,再通过蠕动泵带动返回储液瓶,如此反复循环。见图 1。经计算流体动力学(computational fluid dynamics,CFD)分析,低流速处理组(low flow velocity treatment group,LFV组)流体剪切力为8 mPa时相应流速是80 mL/min,高流速处理组(high flow velocity treatment group,HFV组)流体剪切力为23 mPa时相应流速是200 mL/min。
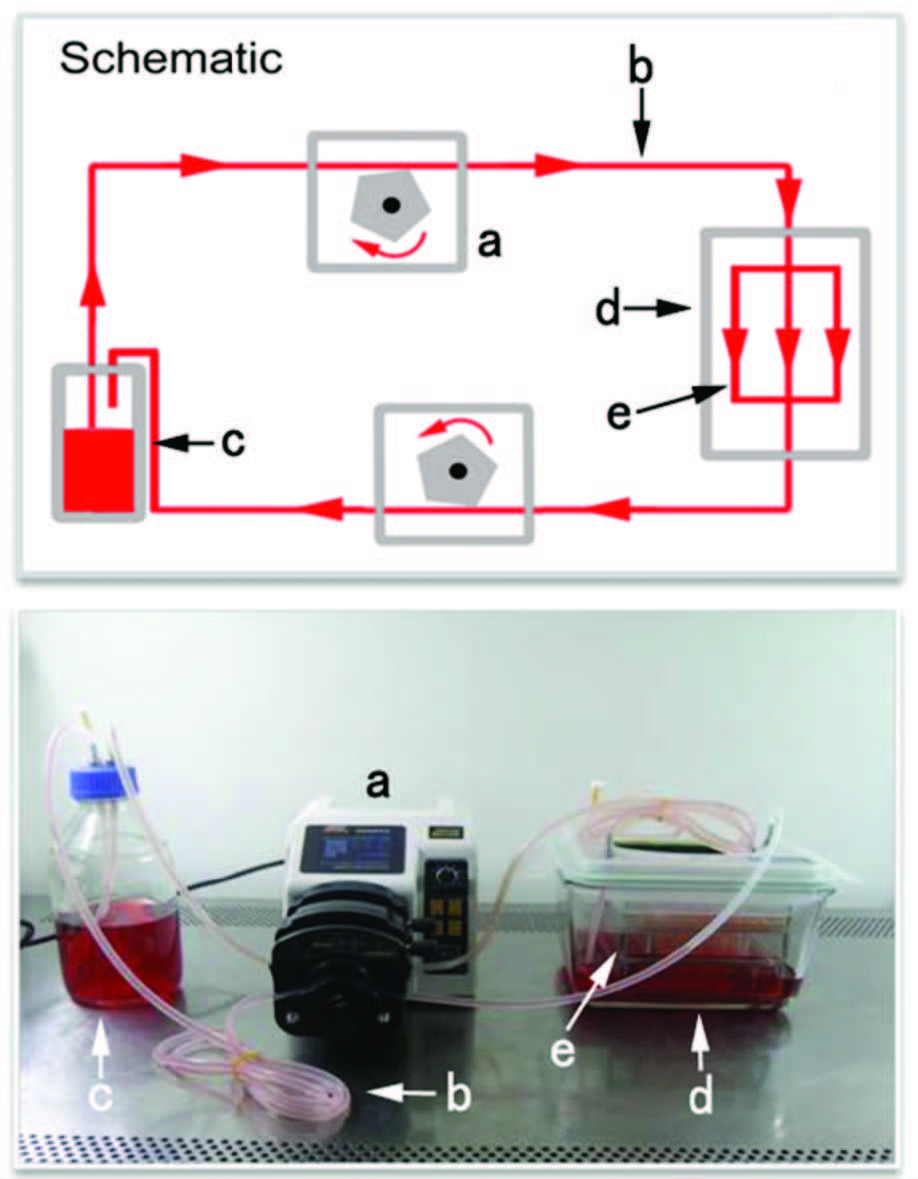
|
| A:模式图;B:实物图;a:蠕动泵;b:无菌硅胶管;c:储液瓶;d:生物反应盒;e:培养盘 图 1 生物反应器示意图 |
1.2.3 人真皮成纤维细胞的分离培养和鉴定
通过包皮环切术获取成人或儿童包皮(第三军医大学大坪医院野战外科研究所尿动力室,征得患者同意并通过大坪医院伦理委员会审查),标本用4 ℃ PBS缓冲液迅速转移至实验室进行hFbs分离提取[7],以后每隔3天换液1次,观察细胞融合至90%用胰酶消化传代。取第4代hFbs做细胞爬片,待细胞融合至90%以上进 行波形蛋白染色并统计阳性率,实验步骤参照vimentin 染色的试剂盒说明。
1.2.4 实验组设定按本实验室建立的方法构建胶原凝胶支架[8]:在冰浴条件下依次按比例加入浓缩DMEM、酸溶性鼠尾胶原、壳多糖、6-硫酸软骨素以及透明质酸,充分混匀后用NaOH溶液调pH值至7.2~7.4,取第3代hFbs细胞,按2×105/mL浓度和凝胶混匀,每孔接种2.5 mL到培养板中,每组16孔。实验组分为LFV组和HFV组,设置LFV组灌注流速为80 mL/min,HFV组灌注流速为200 mL/min,对照组为静态培养。LFV组和HFV组分别加入350 mL OIM,各组按设定流速每间隔5小时灌注30 min施加剪切力刺激。对照组每孔首次加OIM 1 mL,第2天支架收缩后每3天换液1次,每次3 mL OIM,换液总量与动 态相同均为350 mL。
1.2.5 HE染色及细胞计数各组在培养第3、6天和9天取材1次,每个时间点取2个支架,用4%多聚甲醛溶液固定24 h以上,常规脱水、浸蜡、包埋切片,苏木精-伊红染色,在倒置显微镜下观察照相,每组各时间点随机抽取5个视野计数细胞并进行统计分析。此外第21天取材1次行HE染色观察细胞生长状况,与茜素红染色做细胞形态对比。
1.2.6 茜素红染色各组在培养第21天取材1次观察细胞成骨分化情况,用4%多聚甲醛溶液固定 24 h 以上,常规脱水、浸蜡、包埋切片,0.1%茜素红-HCl液(pH=8.4)染色2 min,用PBS洗净杂色,在倒置显微镜下观察拍照,随机选取5个视野用Image Pro Plus6.0软件对各组茜素红结节面积进行统计学分析。
1.2.7 葡萄糖测定每间隔3天取0.5 mL灌注培养基于-80 ℃保存,按葡萄糖试剂盒说明书步骤于505 nm处检测样品光密度值[D(505)],每个检测样本重复3次。
1.2.8 FQ-PCR检测取各组诱导至第21天标本提取细胞RNA,参照GenBank数据库,使用Primer primer 5.0软件设计引物,实验步骤参照TaKaRa公司SYBR GREEN的试剂盒说明。ALP引物基因序列为:上游引物5′-CCAGTCTCATCTCCTGACCC-3′,下游引物5′-GGTGGTCTTGGAGTGAGTGA-3′;BMP-2引物基因序列为:上游引物:5′-TGTCTTCTAGCGTTGCTGCT-3′,下游引物:5′-CAACTCGAACTCGCTCAGGA-3′。
1.3 统计学方法采用SPSS 13.0软件进行统计学分析,数据均以x±s表示。组间比较采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果 2.1 原代hFbs的分离培养和鉴定结果原代细胞呈短梭形,胞核居于细胞中央,培养至7 d 左右细胞融合可达90%以上并变为长梭形,胰蛋白酶消化传代后细胞形态不发生改变,Vimentin染色阳性率达95%以上。见图 2。
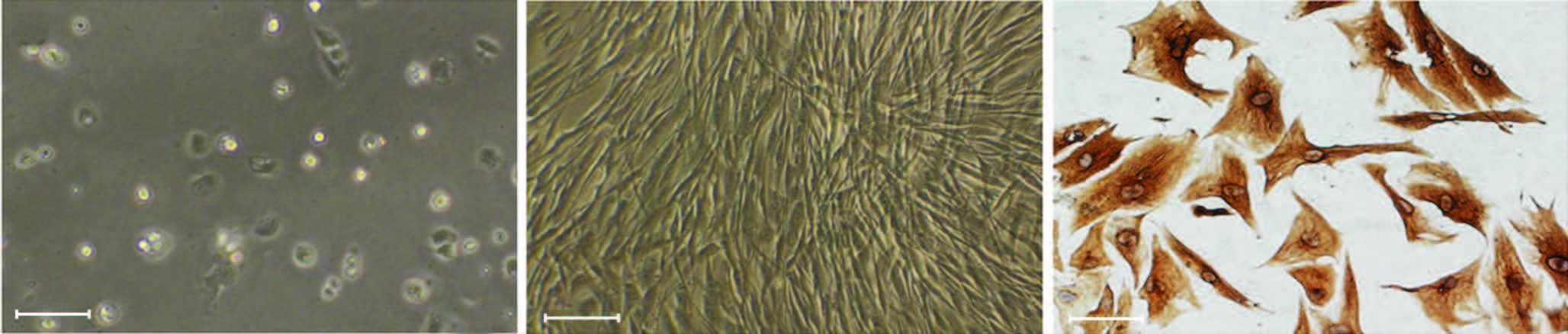
|
| A:提取的原代hFbs初次换液后;B:第3代hFbs呈集落样生长;C:第4代hFbsVimentin染色,细胞质呈棕色< 图 2 人真皮成纤维细胞原代细胞的分离培养 |
2.2 HE染色
HE染色检测不同培养条件细胞形态(图 3),标本随机选取5个高倍镜视野统计hFbs增殖情况(图 4)。 结果表明第3天各组细胞增殖差异不大,但第6天和9天 LFV组和HFV组细胞数量明显多于对照组,且LFV组细胞增殖多于HFV组,差异有统计学意义(P<0.05)。
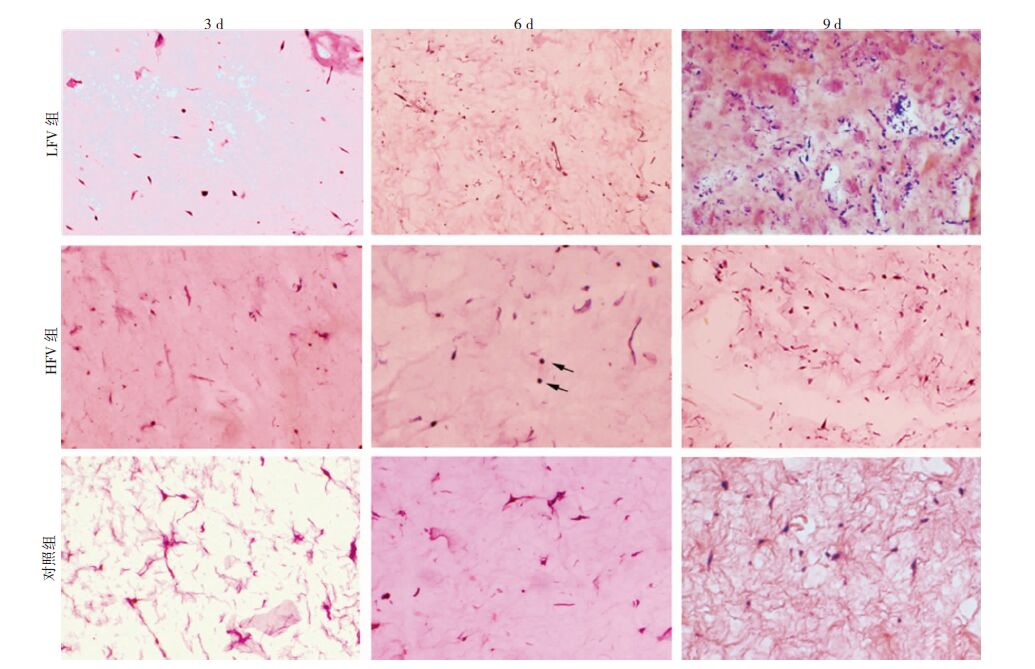
|
| ↑:示HFV组成骨诱导第6天时hFbs细胞呈小圆形,胞质固缩 图 3 各实验组凝胶支架HE染色观察 (×200) |
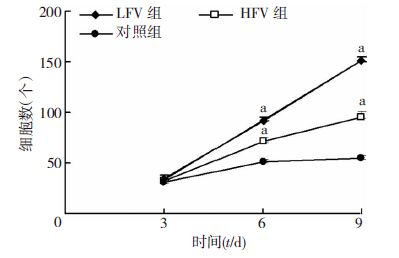
|
| a: P<0.05,与对照组同时点比较 图 4 各实验组凝胶支架细胞计数 (n=5) |
2.3 茜素红S染色
镜下观察3组矿化染色结果均为阳性,Image Pro Plus 6.0软件分析各组面积显示:HFV组为(3.212±0.325)cm2;LFV组为(1.128±0.148)cm2;对照组为(0.793±0.038)cm2,组间比较差异有统计学意义(P<0.05)。同时附上21 d各组HE染色,此时LFV组和HFV组支架中圆形细胞增多。见图 5。
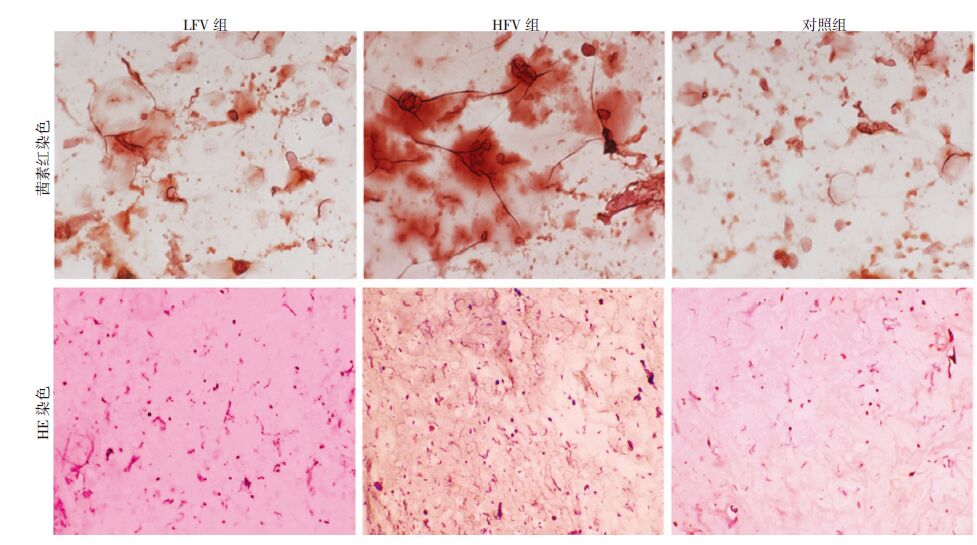
|
| 图 5 第21天各实验组凝胶支架茜素红染色(×400)及HE染色(×200)观察 |
2.4 葡萄糖测定
葡萄糖消耗量均进行性下降,但组间比较差异无统计学意义。从趋势线观察,大部分时间点LFV组和HFV组的葡萄糖消耗量多于对照组,且LFV组葡萄糖消耗量略多于HFV组。见图 6。
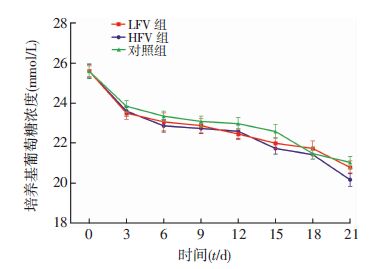
|
| 图 6 各实验组培养基中葡萄糖测定 (n=3) |
2.5 FQ-PCR检测结果
3组ALP及BMP-2基因均有表达,HFV组两种基因表达量均最多而对照组最少,且差异有统计学意义(P<0.05)。见图 7。
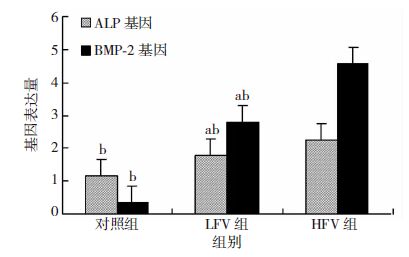
|
| 图 7 FQ-PCR检测各实验组hFbs成骨相关基因ALP、BMP-2的表达 (n=3) |
3 讨论
近年来研究发现包括hFbs在内的多种成纤维细胞[9-10]具有成骨分化潜质,并且表达多种成骨相关基因如:OCN、RUNX-2、BMP-2、ALP等。Toma等[11-12]证明hFbs特异性表达波形蛋白(Vimentin)而DMSCs不表达,因此波形蛋白可用于hFbs鉴定。目前Fbs成骨分化多局限于使用化学试剂或生长因子等方法进行二维平面诱导,但骨作为非均质性组织,上述方法只能证实Fbs具有成骨分化潜质,若要真正构建骨组织的生物结构则需要三维培养并施加适宜力学刺激。三维培养能模拟细胞在生物体内生长方式形成立体结构,有利于细胞定向分化和增殖[13],并且三维培养提供的细胞支架在成骨分化中不仅促进力-生化信号的转化作用,自身也能在力学刺激下发生改建[14]。剪切力作为力学刺激的重要方法,是参与骨骼重建的主要因素[15],并为细胞生长分化提供了适宜的微环境[16],其中包含的流体剪切力是利用液体冲击流动产生力学刺激,其大小与液体流速密切相关。之前的相关研究表明剪切力在5~100 mPa范围内时,能显著提高骨基质蛋白的分泌,例如骨钙素(OC)及骨连接素(ON)[17],因此剪切力对细胞成骨分化有重要调控作用。但关于剪切力对细胞成骨分化的确切机制目前尚不清楚,Kapur等[18]研究表明剪切力可通过包括依赖细胞外信号调节通路在内的多条竞争性信号转导通路干扰细胞向成骨分化,例如促进细胞内Ca2+水平升高,而Ca2+作为第二信使力学信号传导至细胞内引起一系列信号级联反应[19]。因此本实验拟在三维结构基础上探讨流体剪切力对hFbs成骨分化的作用,希望为hFbs成骨诱导提供更有效合理的方法和理论依据。
本实验设计了两个不同大小的流体剪切力,LFV组和HFV组ALP和BMP-2基因表达和矿化结节面积均优于对照组,同时HFV组成骨相关指标阳性最强并率先形成圆形固缩细胞,这表明流体剪切力刺激能促进hFbs成骨分化,较大流体剪切力对hFbs成骨分化作用更强,这与Liu等[20]的关于大鼠成骨细胞的诱导实验结果相符。Knoll等[21]对体外培养的成骨细胞施加不同水平力学刺激,发现较小的力学刺激作用后细胞增殖指数上升,而较大的力学刺激作用时细胞增殖指数反而下降,本实验第6和9天时LFV组细胞增殖多于HFV组,与Knoll等[21]实验结果一致,均说明较小的力学作用更能促进细胞增殖。相比传统静态换液,灌注培养有效克服了物理渗透的缓慢性,更能高效清除细胞代谢废物和补充营养达到促进细胞增殖的目的,同时刺激多条竞争性信号转导通路干扰细胞向成骨分化,因此LFV组和HFV组无论在细胞增殖或成骨分化表达两个方面均优于对照组。综上所述,三维培养和流体剪切力刺激对于构建hFbs成骨分化体系是可行的,本实验灌注过程中产生的流体剪切力对于细胞成骨分化是正向作力,且不同程度促进细胞增殖,但超过这次实验范围大小的流体剪切力诱导hFbs成骨分化作用是否加强尚不清楚。流体剪切力对hFbs增殖分化有双重影响,在较低流体剪切力作用下能促进细胞增殖,流体剪切力较高时则促进细胞向成骨分化并能缩短诱导时间。
另外,本实验OIM采用高糖培养基,有学者研究表明低浓度葡萄糖更适合诱导牙龈Fbs成骨分化[22],因此低浓度葡萄糖的三维培养能否诱导hFbs成骨仍需进一步研究。
| [1] | Lorenz K, Sicker M, Schmelzer E, et al. Multilineage differentiation potential of human dermal skin-derived fibroblasts[J]. ExpDermatol,2008, 17 (11) : 925 –932. DOI:10.1111/j.1600-0625.2008.00724.x |
| [2] | Noordin S, Masri B. Periprostheticosteolysis: genetics, mechanisms and potential therapeutic interventions[J]. CanJSurg,2012, 55 (6) : 408 –417. DOI:10.1503/cjs.003711 |
| [3] | 何川, 邓廉夫, 杨庆, 等. 诱导立体网架上成纤维细胞表达成骨表型及其机制的研究[J]. 中华外科杂志,2006, 44 (4) : 271 –274. |
| [4] | Liu L, Guo Y, Chen X, et al. Three-dimensional dynamic culture of preosteoblasts seeded in HA-CS/Col/nHAP composite scaffolds and treated with α-ZAL[J]. AciaBiochimBiophys Sin,2012, 44 (8) : 669 –677. DOI:10.1093/abbs/gms049 |
| [5] | 李冬梅, 杨水友, 李继承. 真皮成纤维细胞成骨分化的实验研究[J]. 中国组织化学与细胞化学杂志,2010, 19 (6) : 567 –571. DOI:10.3870/zgzzhx.2010.06.008 |
| [6] | 王洋, 蔡伟华, 伍津津, 等. 基于准静态平面流场的新型皮肤组织工程灌注式生物反应室设计与初步模拟[J]. 第三军医大学学报,2013, 35 (7) : 622 –626. DOI:10.16016/j.1000-5404.2013.07.010 |
| [7] | Wu J J, Liu R Q, Lu Y G, et al. Enzyme digestion to isolate and culture human scalp dermal papilla cells: a more efficient method[J]. Arch Dermatol Res,2005, 297 (2) : 60 –67. |
| [8] | 伍津津, 刘荣卿, 叶庆俏, 等. 人工皮肤组织培养模型的建立[J]. 重庆医学,1999, 28 (4) : 247 –248. |
| [9] | Ji J, Tong X, Huang X, et al. Patient-Derived Human Induced Pluripotent Stem Cells From Gingival Fibroblasts Composited With Defined Nanohydroxyapatite/Chitosan/Gelatin Porous Scaffolds as Potential Bone Graft Substitutes[J]. Stem Cells Transl Med,2016, 5 (1) : 95 –105. DOI:10.5966/sctm.2015-0139 |
| [10] | Yang M, Yuan H, Miao M, et al. The osteogenic potential of ligament fibroblasts is greater in ankylosing spondylitis patients than in patients with osteoarthritis[J]. Z Rheumatol,2015, 74 (4) : 340 –345. DOI:10.1007/s00393-014-1394-z |
| [11] | 骆建民, 王俐. 人真皮原代成纤维细胞的培养、鉴定及蛋白酶活性受体的表达[J]. 解剖学研究,2007, 29 (1) : 33 –37. DOI:10.3969/j.issn.1671-0770.2007.01.009 |
| [12] | Toma J G, Akhavan M, Fernandes K J, et al. Isolation of multipotent adult stem cells from the dermis of mammalian skin[J]. Nat Cell Biol,2001, 3 (9) : 778 –784. |
| [13] | 班宇, 伍颖颖. 流体细胞培养培养系统对三维培养的成骨细胞的影响[J]. 世界最新医学信息文摘: 电子版,2012, 12 (2) : 14 –18. DOI:10.3969/j.issn.1671-3141.2012.02.003 |
| [14] | Takai E, Costa K D, Shaheen A, et al. Osteoblast elastic modulus measured by atomic force microscopy is substrate dependent[J]. Ann Biomed Eng,2005, 33 (7) : 963 –971. |
| [15] | Stenvens H Y, Frangos J A. Bone cell responses to fluid flow[J]. Methods Mol Med,2003, 80 : 381 –398. |
| [16] | 吴丹, 丁寅, 王琪. 流体剪切力对大鼠成骨细胞增殖及细胞周期的影响[J]. 临床口腔医学杂志,2007, 23 (4) : 197 –199. DOI:10.3969/j.issn.1003-1634.2007.04.002 |
| [17] | Li D, Tang T, Lu J, et al. Effects of flow shear stress and mass transport on the construction of a large-scale tissue-engineered bone in a perfusion bioreactor[J]. Tissue EngPart A,2009, 15 (10) : 2773 –2783. DOI:10.1089/ten.TEA.2008.0540 |
| [18] | Kapur S, Baylink D J, Lau K H. Fluid flow shear stress stimulates human osteoblast proliferation and differentiation through multiple interacting and competing signal transduction pathways[J]. Bone,2003, 32 (3) : 241 –251. |
| [19] | Iqbal J, Zaidi M. Molecular regulation of mechanotransduction[J]. BiochemBiophys Res Commun,2005, 328 (3) : 751 –755. |
| [20] | Liu X, Zhang X, Lee I. A quantitative study on morphological responses of osteoblastic cells to fluid shear stress[J]. ActaBiochimBiophys Sin (Shanghai),2010, 42 (3) : 195 –201. |
| [21] | Knoll B I, McCarthy T L, Centrella M, et al. Strain-dependent control of transforming growth factor-beta function in osteoblasts in an in vitro model: biochemical events associated with distraction osteogenesis[J]. PlastReconstrSurg,2005, 116 (1) : 224 –233. |
| [22] | 陈嵩, 吕兰欣, 黄宁平, 等. 人牙龈成纤维细胞体外诱导 成骨分化的实验研究[J]. 医学研究生学报,2013, 26 (9) : 925 –927. DOI:10.3969/j.issn.1008-8199.2013.09.007 |



