2. 400038 重庆,第三军医大学:基础医学部实验动物学教研室
2. Department of Experimental Animals,College of Basic Medical Sciences, Third Military Medical University,Chongqing,400038, China
慢性HBV感染是我国最主要的人类慢性病毒感染,波及7%~10%左右的人口。近年来,多项基于大样本患者人群的全基因组关联研究(genome-wide association study,GWAS)发现HLA-DP、DQ、DR基因位点的遗传变异决定HBV的感染/清除、肝癌发生、疫苗应答等转归结局,从遗传流行病学角度证实了HLA-Ⅱ类分子在HBV保护性免疫中的重要作用[1, 2, 3, 4]。我们前期的GWAS研究发现HLA-DRB1*0803等位是重型乙型肝炎的保护等位。为了进一步研究HLA-DRB1*0803等位的保护效应及免疫遗传学机制,需要构建HLA-DRB1*0803等位转基因小鼠模型。本研究从头构建了一个pBR002-HLA-DRB1*0803转基因载体,在细胞水平对该载体进行了表达功能和抗原提呈功能的验证,为下一步构建HLA-DRB1*0803转基因小鼠提供前期基础。
1 材料与方法 1.1 材料DMEM培养基,OPTI-MEM无血清培养基,胎牛血清,TOYOBO 高效率反转录试剂盒购自日本东洋纺公司;质粒提取试剂盒购自宝生物工程(大连)有限公司;凝胶回收试剂盒、限制性内切酶XbaⅠ和HindⅢ购自美国Sigma 公司;Lipofectamine 2000转染试剂盒、T4 DNA Ligase连接酶购自美国Thermo Fisher Scientific公司。Anti-HLA-DR单克隆阻断抗体购自美国LifeSpan Biosciences公司(克隆号L243),抗HLA-DR多克隆抗体(N2C3)购自美国Gene Tex公司,cy3标记的山羊抗大鼠IgG抗体、Alexa Fluor 488标记山羊抗兔IgG (H+L)和辣根过氧化物酶标记山羊抗兔IgG(H+L)抗体购自碧云天生物技术有限公司。Percp-Cy5.5 anti-human CD3、FITC anti-human CD4、PE anti-human IFN-γ、PE-Cy7 anti-human IL-4、APC anti-human IL-17抗体、大鼠抗小鼠MHC Class Ⅱ (I-A/I-E)抗体购自美国eBioscience公司。
人WATANABE永生化B淋巴细胞株(基因型为HLA-DRB1*0803纯合子),购自美国华盛顿大学佛雷德·哈钦森癌症研究中心。pBR002-lacz载体购自上海生工公司。小鼠Eα promoter和兔β-globin内含子调控元件参照文献[5]序列,由赛业(广州)生物科技有限公司合成。PCR引物由华大生物股份有限公司合成。HBcAg肽池由上海耀强公司合成。DCS细胞(小鼠树突状细胞肉瘤细胞)和RMS-S-B 3501(小鼠B淋巴细胞系)均购自上海拜力生物科技有限公司。细胞培养条件:用T25培养瓶在37 ℃恒温,5% CO2的无菌条件下培养。培养基为DMEM+10% FBS。
1.2 pBR002-HLA-DRB1*0803转基因载体的构建TRIzol法提取人WATANABE永生化B淋巴细胞株的总RNA,然后反转录为cDNA。根据NCBI序列库HLA-DRB1*0803基因序列(NM_001243965.1),用Primer Premier 5.0设计PCR引物(上游引物为:5′-GTTCCCTCCATCTCCTTTAC-3′;下游引物为:5′-CTCAGGACCTGGTTGCTACT-3′)进行PCR扩增。目标产物片段连入PUC57载体,转化至感受态大肠杆菌DH5α,进行扩增得到PUC57-HLA-DRB1*0803质粒。小鼠Ea promoter用HindⅢ/Bsp1407Ⅰ做酶切;兔β-globin基因内含子用Bsp1407Ⅰ/XhoⅠ做酶切;克隆载体pBR002-lacz用HindⅢ/XhoⅠ酶切。然后将Ea promoter序列(-2 172 bp至+12 bp)、β-globin序列(内含子2及3′多聚腺苷位点)和酶切载体pBR002-lacz用T4 DNA Ligase连接酶连接,转入DH5α得到pBR002-EaP-BGLOBIN质粒。将前两步测序验证无误后的PUC57-HLA-DRB1*0803质粒和pBR002-EaP-BGLOBIN质粒用MfeⅠ和Bsu36Ⅰ(Eco81Ⅰ)双酶切,分别电泳回收目的条带,T4 DNA Ligase连接酶连接到pBR002酶切载体,转入DH5α扩增、测序验证,得到pBR002-HLA-DRB1*0803转基因载体。
1.3 pBR002-HLA-DRB1*0803转基因载体在细胞水平的表达将DCS细胞(小鼠树突状细胞肉瘤细胞)和RMS-S-B 3501细胞(小鼠B淋巴细胞系)以lipofectamine 2000 Transfection Reagent转染pBR002-HLA-DRB1*0803转基因载体,收集转染细胞1×106个,裂解细胞提取蛋白。经10% SDS聚丙烯酰胺凝胶(PAGE)电泳,转至PVDF膜上,经兔抗人HLA-DR多克隆抗体(N2C3)(1:1 000)4 ℃过夜,辣根过氧化物酶标记山羊抗兔IgG(H+L)抗体(1:500)37 ℃孵育1 h,ECL化学发光显色,记录结果。
在培养板中将已爬好的DCS细胞玻片用4%的多聚甲醛固定,分别经兔抗人HLA-DR多克隆抗体(N2C3)和小鼠MHC-AE多克隆抗体4 ℃孵育过夜,Alexa Fluor 488标记山羊抗兔IgG (H+L) 37 ℃孵育1 h,DAPI避光孵育5 min染核,封片,激光共聚焦显微镜观察。
1.4 pBR002-HLA-DRB1*0803转基因载体转染DCS 细胞后的抗原肽提呈功能观察CD4+ T细胞体外抗原特异性刺激及HLA-DR阻断步骤参照文献[6, 7, 8]报道的方法。经患者知情同意,从西南医院感染科收集6例慢性乙型肝炎患者全血10 mL。外周血PBMC分离培养,用SBT法进行HLA-DRB1基因分型,筛选出1例HLA- DRB1*0803的慢性乙型肝炎患者。PBMC用培养基稀释成1×106/mL,移至48孔板培养,每孔1 mL。每孔细胞中加 10 μg/mL的HBV衣壳蛋白(HbcAg)肽池1 μL刺激8 d。 第8天取步骤1.3中转染pBR002-HLA-DRB1*0803转基因载体的DCS细胞1×105个加入到培养的PBMC细胞内,维持HBcAg肽池继续刺激7 d,过程中根据细胞状态隔天换液,视情况补加IL-2。第15天各孔再次加入转染后的DCS细胞1×105个,然后分成2组,HLA-DR阻断组和对照组,阻断组加入10 μL的Anti-HLA-DR单克隆阻断抗体孵育1 h,对照组加等体积培养基。然后每孔加HBcAg肽池、低剂量PMA(25 ng/mL)、离子霉素(500 ng/mL)刺激6 h。孵育最后1 h后加入莫能霉素(0.7 μL/mL)。细胞吸入流式管中,PBS洗涤后以PBS 100 μL重悬,加入表面标记抗体Percp-Cy5.5 anti-human CD3、FITC anti-human CD4各2 μL,混匀,4 ℃避光30 min。PBS洗涤后加入200 μL固定剂重悬,4 ℃ 避光20 min。加入100 μL 1×通透液、细胞因子抗体PE anti-human IFN-γ、PE-Cy7 anti-human IL-4、APC anti-human IL-17各2 μL,混匀,4 ℃避光20 min。PBS洗涤后150 μL PBS重悬,流式检测,用FlowJo 7.6软件分析结果。流式设门:先利用SSC-A与FSC-A在细胞群中设立淋巴细胞门,然后用Percp-Cy5.5与FITC来定义CD3+CD4+阳性细胞群,再从CD3+CD4+阳性细胞群中分别用PE、PE-Cy7、APC定义产IFN-γ、IL-4、IL-17的CD3+CD4+ T细胞的数量。
2 结果 2.1 pBR002-HLA-DRB1*0803转基因载体的构建和验证WATANABE细胞总RNA的反转录PCR产物经1%琼脂糖凝胶电泳检测,可见一大小约1 600 bp的条带,该条带相对分子质量与HLA-DRB1*0803基因mRNA编码区扩增长度一致。分别测序比对验证无误后,将小鼠Eα promoter、兔β-globin内含子和DRB1 *0803 cDNA三段序列按顺序连接至pBR002-lacz载体上,构建成功的pBR002-HLA-DRB1*0803转基因载体示意图谱见图 1。经EcoRⅠ/BsrGⅠ双酶切验证和测序验证,载体序列包含小鼠HLA-DRB1*0803 cDNA序列、Eαpromoter序列、兔β-globin基因内含子序列,符合设计构想。
 |
| 紫色部分为小鼠Eαpromoter序列,蓝色部分为断开的兔β-globin 基因内含子序列,橙色部分为在β-globin内含子的EcoRⅠ位点插入的HLA-DRB1*0803 cDNA序列 图 1 构建的pBR002-HLA-DRB1*0803转基因载体示意图谱 |
从图 2可以看出,转染pBR002-HLA-DRB1*0803转基因载体的小鼠B细胞株RMS-S-B 3501细胞(D组)和小鼠DC细胞株DCS细胞(H组)有大小约为29×103的目的蛋白条带;内参为GAPDH,检测条带大小约为36×103。相比RMS-S-B 3501细胞,DCS细胞转染后的表达效率较强。
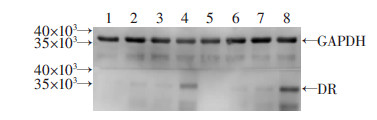 |
| 1~4:RMS-S-B 3501细胞;5~8:DCS细胞;1、5:培养基空白对照;2、6: lipofectamine 2 000空白对照;3、7:pBR002-HLA-DRB1*0803转基因载体对照;4、8:pBR002-HLA-DRB1*0803转基因载体+lipofectamine 2000 图 2 Western blot检测HLA-DRB1蛋白表达 |
从图 3可以看到,转染pBR002-HLA-DRB1*0803转基因载体的小鼠DCS细胞,细胞质内可见很强的HLA-DRB1特异性荧光,而未转染的DCS细胞内无HLA-DRB1蛋白荧光信号,表明本研究构建的pBR002-HLA-DRB1*0803转基因载体能高效表达HLA-DRB1蛋白。从图 4可以看出,小鼠自身MHC-Ⅱ蛋白主要表达于细胞膜(红色荧光),而转入的人HLA-DRB1蛋白主要表达于细胞质(绿色荧光)。
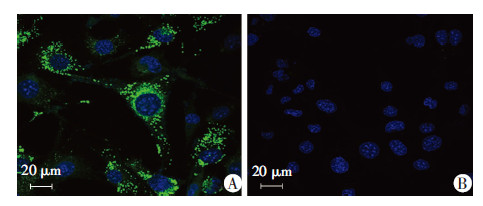 |
| A:HLA-DRB1蛋白;B:未转染的DCS细胞(阴性对照) 图 3 激光共聚焦显微镜观察pBR002-HLA-DRB1*0803转基因载体转染后的DCS细胞HLA-DRB1蛋白的表达 |
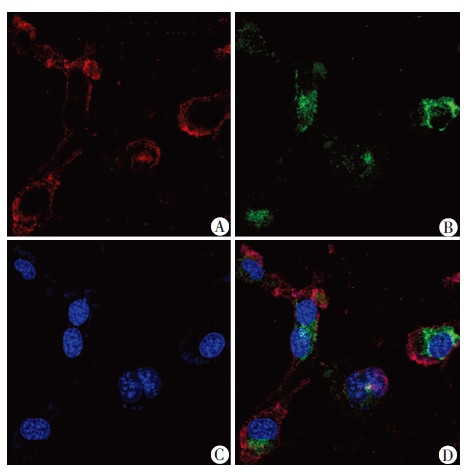 |
| A:MHC-Ⅱ蛋白;B:HLA-DRB1蛋白;C:DAPI染色;D:A、B、C融合图像 图 4 激光共聚焦显微镜观察pBR002-HLA-DRB1*0803转基因载体转染后的DCS细胞HLA-DRB1蛋白和小鼠自身MHC-AE蛋白的表达(×500) |
pBR002-HLA-DRB1*0803转基因载体转染DCS细胞后,负载HbcAg表位肽,与HLA-DRB1*0803阳性的慢性乙型肝炎患者PBMC孵育。根据T细胞增殖第15天是否添加HLA-DR单抗阻断分为阻断组和未阻断组,分别上流式检测后结果见图 5。CD4+ T细胞亚群分析结果表明,和阻断HLA-DR相比,未阻断HLA-DR条件下产IFN-γ的CD4+ T细胞亚群比例由6.68%提高到了10.4%,产IL-4的CD4+ T细胞亚群比例由2.57%提高到了6.05%,产IL-17的CD4+ T细胞亚群比例由2.90%降低到了1.08%,3类细胞的比例均发生了明显的变化。
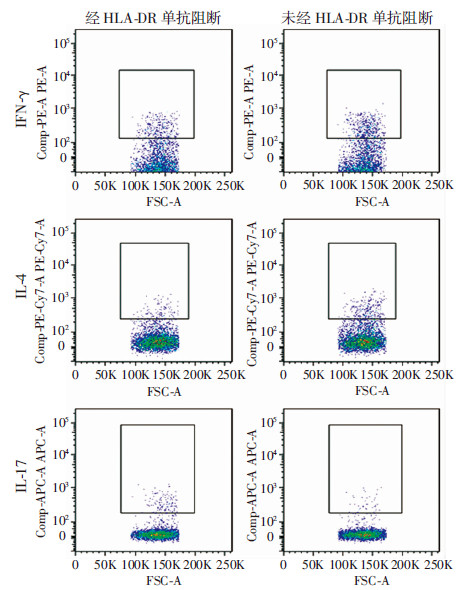 |
| 图 5 流式细胞检测转染pBR002-HLA-DRB1*0803转基因 载体DCS细胞对人CD4+ T细胞的极化作用 |
HLA转基因鼠的研究由来已久,1991年构建出第1个HLA-Ⅱ类分子(HLA-DQ6)转基因鼠,HLA-DQ分子能表达于目标器官,并且对小鼠T细胞repertoire产生显著的影响,能激发出HLA限制的特异性T细胞反应[9]。多发性硬化、类风湿关节炎易感的HLA-DR和DQ等位转基因鼠,在给予人特异性自身抗原刺激后,能很好地模拟多发性硬化、类风湿关节炎的疾病特点(严重程度、性别差异),大大提高了人们对多发性硬化、类风湿关节炎等疾病机制的认识[10]。但是,国外实验室基于欧美人群优势等位建立的少数几个等位的HLA转基因小鼠品系(HLA-A*0201,B35,B7,Cw3,DRB1*0301,DRB1*0401,DQB1*0801,DQB1*0601等),涉及知识产权问题,同时,欧美人群和中国人群的HLA等位基因频率有非常显著的差异。例如,国外的HLA-A2转基因鼠为A*0201,此等位在欧美白人中占46%,识别HBcAg的经典表位为18-27,而中国人群中HLA-A基因等位主要是A*0203、A*0206、A*0207,并不识别HBcAg的18-27表位[11]。因此,非常有必要建立中国人群特异的HLA等位转基因小鼠品系。
我们选择了中国人群中频率较高的HLA-DRB1 *0803等位进行转基因载体构建。国外学者在pDOI-5质粒中按特定顺序插入小鼠Eα promoter、兔β-globin基因内含子序列和人类HLA-Ⅱ类基因构建转基因载体,用受精卵注射的方法得到的转基因小鼠体内可以检测到HLA-Ⅱ类基因在组织和细胞水平特异性的表达[12]。小鼠Eα promoter可使RNA聚合酶特异性识别和结合;兔β-globin基因内含子序列的作用是提供一个内含子以及聚腺苷酸化信号,前者被认为有助于转录本从细胞核内的导出[13]。因无法获取pDOI-5-HLA-Ⅱ转基因载体质粒,本研究改用pBR002-lacz载体从头构建。pBR002-lacz载体是由经典的真核表达载体pBR322改造而来,携带有氨苄青霉素和四环素的抗性,且增加了一个lacZ基因标签,相对pDOI-5质粒来说具有蛋白表达量大,易于与感受态细胞转化,筛选方便,分子量小且拷贝数多等优点。
构建的载体是否可以稳定地表达外源性蛋白,以及外源性蛋白是否具有生物学活性,是判断一个表达载体成功与否的关键。本研究分别选择了Western blot和免疫荧光的方法对目的蛋白进行检测。结果证实,经过pBR002-HLA-DRB1*0803转基因载体转染的小鼠DCS细胞及RMS-S-B 3501细胞均有HLA-DRB1蛋白产生。为了检测经该载体转染进小鼠DCS 细胞产生的目的蛋白是否具有人类HLA-Ⅱ类分子的抗原递呈功能,我们进行了体外CD4+ T细胞刺激实验。从实验结果来看,未阻断DR组相比阻断DR组的IFN-γ和IL-4的比例明显增高,IL-17的比例明显降低,表明转染载体表达的HLA-DRB1具有抗原提呈活性。
文献[13]报道小鼠的MHC-Ⅱ分子的α链可与人HLA-Ⅱ的β链形成异源二聚体。本研究虽然成功构建了pBR002-HLA-DRB1*0803转基因载体,但其转染DCS细胞后表达的HLA-DRB1蛋白主要停留于细胞质,表明与小鼠的MHC-Ⅱ分子的α链没有充分结合。可能尚需同时引入HLA-DRA形成同源二聚体才能完成胞膜定位,从而更好地发挥抗原提呈功能。同时,有待注射小鼠受精卵后构建活体转基因小鼠,才能进一步观察其人源化免疫学效应[14]。
| [1] | Kamatani Y, Wattanapokayakit S, Ochi H, et al. A genome-wide association study identifies variants in the HLA-DP locus associated with chronic hepatitis B in Asians[J]. Nat Genet, 2009, 41(5): 591-595. DOI: 10.1038/ng.348 |
| [2] | Hu Z, Liu Y, Zhai X, et al. New loci associated with chronic hepatitis B virus infection in Han Chinese[J]. Nat Genet, 2013, 45(12): 1499-1503. DOI: 10.1038/ng.2809 |
| [3] | Jiang D K, Sun J, Cao G, et al. Genetic variants in STAT4 and HLA-DQ genes confer risk of hepatitis B virus-related hepatocellular carcinoma[J]. Nat Genet, 2013, 45(1): 72-75. DOI: 10.1038/ng.2483 |
| [4] | Png E, Thalamuthu A, Ong R T, et al. A genome-wide association study of hepatitis B vaccine response in an Indonesian population reveals multiple independent risk variants in the HLA region[J]. Hum Mol Genet, 2011, 20(19): 3893-3898. DOI: 10.1093/hmg/ddr302 |
| [5] | Kouskoff V, Fehling H J, Lemeur M, et al. A vector driving the expression of foreign cDNAs in the MHC class Ⅱ-positive cells of transgenic mice[J]. J Immunol Methods, 1993, 166(2): 287-291. |
| [6] | Kennedy P T, Sandalova E, Jo J, et al. Preserved T-cell function in children and young adults with immune-tolerant chronic hepatitis B[J]. Gastroenterology, 2012, 143(3): 637-645. DOI: 10. 1053/ j.gastro.2012.06.009 |
| [7] | Chen L, Li B, Yang W C, et al. A dominant CD4(+) T-cell response to Helicobacter pylori reduces risk for gastric disease in humans[J]. Gastroenterology, 2013, 144(3): 591-600. DOI: 10.1053/j.gastro. 2012.12.002 |
| [8] | 李辉文, 何韦韦, 谭文婷, 等. HLA-DRB1*0803与HLA-DRB1*0901等位特异性HBcAg表位肽的筛查与鉴定[J]. 第三军医大学学报, 2015, 37(9): 833-838. DOI: 10.16016/j.1000-5404. 201501091. |
| [9] | Zhou P, Anderson G D, Savarirayan S, et al. Thymic deletion of V beta 11+, V beta 5+ T cells in H-2E negative, HLA-DQ beta+ single transgenic mice[J]. J Immunol, 1991, 146(3): 854-859. |
| [10] | Luckey D, Bastakoty D, Mangalam A K. Role of HLA class Ⅱ genes in susceptibility and resistance to multiple sclerosis: studies using HLA transgenic mice[J]. J Autoimmun, 2011, 37(2): 122-128. DOI: 10.1016/j.jaut.2011.05.001 |
| [11] | Desmond C P, Bartholomeusz A, Gaudieri S, et al. A systematic review of T-cell epitopes in hepatitis B virus: identification, genotypic variation and relevance to antiviral therapeutics[J]. Antivir Ther, 2008, 13(2): 161-175. |
| [12] | Ru Z, Xiao W, Pajot A, et al. Development of a humanized HLA-A2.1/DP4 transgenic mouse model and the use of this model to map HLA-DP4-restricted epitopes of HBV envelope protein[J]. PLoS One, 2012, 7(3): e32247. DOI: 10.1371/journal.pone.0032247 |
| [13] | Zhu G, Flies D B, Tamada K, et al. Progressive depletion of peripheral B lymphocytes in 4-1BB (CD137) ligand/I-Ealpha)-transgenic mice[J]. J Immunol, 2001, 167(5): 2671-2676. |
| [14] | Taneja V, David C S. Role of HLA class Ⅱ genes in susceptibility/resistance to inflammatory arthritis: studies with humanized mice[J]. Immunol Rev, 2010, 233(1): 62-78. DOI: 10.1111/j.0105-2896. 2009.00858.x |



