脂质代谢紊乱,如甘油三酯过度合成和堆积、胆固醇内稳态失调等,可引起高血脂、脂肪肝、肥胖症及动脉粥样硬化(atherosclerosis,As)等多种代谢相关疾病,严重威胁人类健康[1, 2]。
核受体LXRβ(liverXreceptorsβ,肝X受体β)是核受体超家族成员LXR的一种亚型,作为一种转录因子,其可被天然配体氧化固醇类和人工合成配体激活,从而对靶基因的表达进行调控而发挥功能[3]。近年研究发现,LXRβ与胆固醇代谢平衡、胆汁酸代谢和炎症反应等过程密切相关[4, 5, 6]。尤其在脂肪酸合成过程中,活化LXRβ可激活脂肪酸合酶(fatty acid synthase,FAS)、乙酰CoA羧化酶(acetyl-CoA carboxylase,ACC)的转录,从而促进脂肪酸合成[7, 8]。因此,若能抑制LXRβ的表达,将有利于抑制脂肪酸的过度合成,从而缓解甘油三酯增多导致的相关代谢疾病。
微小RNA (microRNAs,miRs)是非编码小分子RNA,其通过抑制靶基因表达而与多种疾病密切相关[9]。研究表明,miR-7在脂代谢中发挥重要作用,其可促进动脉粥样硬化的形成,尤其是在胆固醇的逆向转运方面具有重要作用[10]。而最近研究发现,miR-7能抑制脂质生成[11],但其具体作用机制尚不清楚。既然LXRβ能促进脂肪酸合成,而miR-7可抑制脂质生成,且microRNA可通过抑制靶基因表达而发挥作用,那么miR-7在抑制脂质生成过程中能否抑制LXRβ表达尚少见报道。我们通过生物信息学预测发现,在LXRβ mRNA的3′-UTR上存在miR-7的可能结合位点。因此,我们对miR-7调节LXRβ表达及在脂质生成中的作用进行了研究,以期为阐明LXRβ的表达调控机制积累资料,为脂质代谢相关疾病的治疗寻找新的靶点。
1 材料与方法 1.1 材料与试剂人HepG2细胞株购自美国ATCC,胎牛血清(美国赛默飞公司),高糖细胞培养基DMEM(美国赛默飞公司),二甲基亚砜(美国西格玛公司),LXR激动剂TO901317、GW3965(美国西格玛公司),CCK-8(日本同仁化学研究公司),TRIzol试剂(美国英杰公司),琼脂糖、M-MLV反转录酶(美国英俊公司),rTaq酶、Real-time PCR检测试剂盒(大连宝生物公司),dNTP(美国普洛麦格公司),Complete Cocktail蛋白酶抑制剂(德国罗氏公司),细胞总蛋白抽提试剂盒、BCA蛋白浓度测定试剂盒(南京碧云天公司),封闭蛋白干粉(武汉博士德公司),兔抗LXRβ多抗(美国艾博抗公司),鼠抗β-actin单抗(美国圣克鲁斯公司),HRP标记的山羊抗兔IgG抗体(美国皮尔斯公司),HRP标记的山羊抗小鼠IgG抗体(美国皮尔斯公司),PVDF膜、ECL 化学发光底物试剂盒(美国皮尔斯公司),引物用 Primer Premier 5.0软件设计,由上海生工公司合成。其余试剂均为国产分析纯。基因引物序列见表 1。
| 基因名称 | 引物序列(5′→3′) | 片段大小(bp) |
| LXRβ | 上游:AGCAGCAGGAGTCACAGTCA | 123 |
| 下游:GTTCTTGAGCCGCTGTTAGC | ||
| β-actin | 上游:GTGAAGGTGACAGCAGTCGGTT | 137 |
| 下游:GAAGTGGGGTGGCTTTTAGGA | ||
| FAS | 上游:CAGTCAGGCTCACAAACGAA | 127 |
| 下游:TTCCGAGATTCCATCCTACG | ||
| ACC | 上游:CATGCGGTCTATCCGTAGGT | 158 |
| 下游:TGTTGTTGTTTGGTCCTCCA |
人肝癌HepG2细胞用含10%胎牛血清、双抗(100 U/mL青霉素、100 μg/mL链霉素),DMEM培养基在孵箱37 ℃ 5% CO2培养,每3天左右换液传代。细胞达对数生长期时铺板,参照LipofectamineTM 2000说明书进行瞬时转染miR-7和miR-7 inhibitors对照,24 h后,进行Real-time PCR、Western blot检测,以DMSO作为空白对照,所有实验重复3次。
1.3 总RNA提取将逆转录细胞培养至对数生长期,按细胞密度1×105/mL进行接种,采用TRIzol法提取激动剂处理24 h的细胞总RNA,用核酸检测仪测RNA浓度,并测定D(260)/D(280)比值,按 M-MLV 说明书进行逆转录反应得到cDNA。
1.4 Real-time PCR检测取1.3所得cDNA,采用Real-time PCR试剂盒测定LXRβ mRNA表达水平变化。反应体系:SYBR Green (2×)10 μL,LXRβ或β-actin上下游引物(10 μmol/L) 各1 μL,β-actin上下游引物(10 μmol/L)各 1 μL,cDNA 0.3 μL,补超纯水至20 μL,每个样品设3复孔,置Bio-Rad Real-time PCR仪扩增,设定反应条件: 95 ℃ 预变性30 s;95 ℃ 30 s,60 ℃ 30 s,扩增40个循环。反应结束后用Bio-Rad IQ5软件对结果进行分析,以β-actin为内参,计算目的基因的相对表达水平。
1.5 Western blot检测参照文献[12]方法,用含蛋白酶抑制剂的细胞裂解液提取总蛋白,按照BCA法测定蛋白浓度,蛋白煮沸变性制备浓度为15%的胶,每孔上样40 μg,恒定电流100 mA电泳,转移1 h至PVDF膜,按照目的蛋白的分子量截取相应大小的PVDF膜,37℃脱脂奶粉封闭1 h,一抗工作浓度为1 ∶1 000,4 ℃孵过夜,PBST洗涤4次,6 min/次,相应的二抗工作浓度为1 ∶10 000,37 ℃孵育1 h,PBST洗涤4次,6 min/次,ECL化学发光显影。
1.6 生物信息学分析PCR扩增LXRβ的3′-UTR区域通过Targetscan和miRanda等生物信息学网站分析显示,在LXRβ mRNA的3′-UTR上存在miR-7的可能结合位点,以HepG2细胞基因组DNA为模板,PCR扩增包含有 miR-7可能结合位点的LXRβ的3′-UTR区域(161 bp)。
1.7 荧光素酶报告基因检测荧光素酶报告基因检测将从基因组扩增得到的LXRβ 3′-UTR片段插入pMIR-REPORT的SacⅠ和HindⅢ酶切位点之间,构建pMIR/LXRβ重组质粒。细胞以1×105密度接种于48孔板中,转入pMIR-REPORT或pMIR/LXRβ重组质粒,同时共转染各种mimics或mimics inhibitors。24 h后测定Luc活性和β-gal活性,以各孔Luc活性对相应β-gal活性进行标化后计算各组实验中荧光素酶相对活性,每个样品设3复孔。
1.8 miR-7对LXRβ下游脂质代谢相关基因的作用待细胞至对数生长期,按细胞密度以1×105密度接种,转染miR-7培养12 h,分别加入GW3965(2 μmol/L)或TO901317(5 μmol/L)处理24 h,收集细胞提取RNA,逆转录并进行Real-time PCR检测。
1.9 细胞内甘油三酯测定细胞处理同1.8,收集细胞,加入0.2 mL磷酸盐缓冲液,冰水浴条件下超声破碎(300 W功率,5 s/次,间隔30 s,重复3次),匀浆液按照甘油三酯测试盒采用酶标仪比色法进行甘油三酯的测定计算。
1.10 统计学分析采用GraphPad Prism 5统计软件分析,数据以x±s表示,各组间均数比较用单因素方差分析。
2 结果 2.1 MiR-7结合在LXRβ mRNA的3′-UTR生物信息学网站(Targetscan和miRanda)分析显示,在LXRβ mRNA的3′-UTR上存在miR-7的可能结合位点(图 1)。
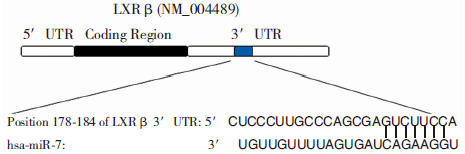 |
| 图 1 生物信息学预测miR-7在LXRβ 3′-UTR区的结合位点 |
以miR-7 mimics或NC mimics(80 nmol/L)转染HepG2细胞,24 h后收集细胞提取总RNA和总蛋白,Real-time PCR、Western blot检测结果显示:miR-7可显著抑制LXRβ的mRNA和蛋白表达(P<0.05,图 2)。
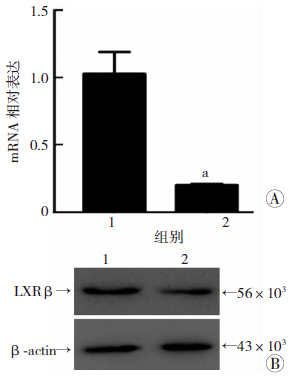 |
| A:Real-time PCR检测LXRβ的表达;B:Western blot检测LXRβ的表达 1:转染NC mimics组;2:转染miR-7 mimics组;a:P<0.05,与转染NC mimics组比较 图 2 过表达miR-7抑制HepG2细胞LXRβ的表达 |
将pMIR/LXRβ-7和miR-7 mimics或miR-7inhibitors共转染HepG2细胞,24 h后进行荧光素酶活性测定,如图 3所示,过表达miR-7(即miR-7 mimics)能显著抑制pMIR/LXRβ-7活性(P<0.05,图 3A);而过表达miR-7 inhibitors可以拮抗内源性miR-7的作用,使pMIR/LXRβ-7的活性增高(图 3B);并且过表达mir-7对pMIR/LXRβ-7的抑制作用在miR-7 inhibitors也过表达的情况下,该抑制作用可被拮抗(图 3C)。上述结果表明,miR-7能特异地结合在LXRβ mRNA的3′-UTR。
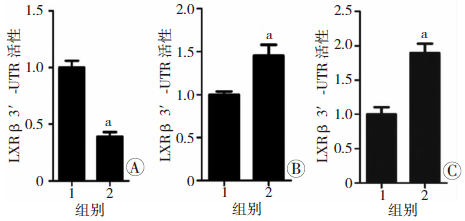 |
| A:双荧光素酶检测过表达miR-7对LXRβ 3′-UTR 活性的影响 1:转染NC mimics组;2:转染miR-7 mimics组;B:双荧光素酶检测抑制miR-7对LXRβ 3′-UTR 活性的影响 1:转染NC mimics inhibitors组;2:转染miR7 mimics inhibitors组;C:双荧光素酶检测miR-7 mimics和inhibitors同时转染对LXR 3′-UTR 活性的影响 1:同时转染miR-7和NC mimics inhibitors;2:同时转染miR-7和miR 7 mimics inhibitors;a:P<0.05,与1组比较 图 3 MiR-7对LXRβ mRNA 3′-UTR报告基因活性的影响 |
将pMIR/LXRα和miR-7 mimics共转染HepG2细胞后进行Luc报告基因活性检测,发现miR-7对pMIR/LXRα的活性并没有显著影响(图 4),以上结果表明miR-7能特异性地结合在LXRβ mRNA 3′-UTR。
 |
| 1:转染NC mimics组;2:转染miR-7 mimics组 图 4 过表达MiR-7对pMIR/LXRα mRNA 3′-UTR的活性无影响 |
用miR-7 mimics或NC mimics(80 nmol/L)转染HepG2细胞。12 h后,分别加入GW3965(2 μmol/L)和TO901317(5 μmol/L)处理24 h。Real-time PCR检测结果表明,miR-7能显 著抑制LXRβ激动剂诱导的脂 质生成相关基因FAS和ACC mRNA的表达(P<0.05,图 5)。
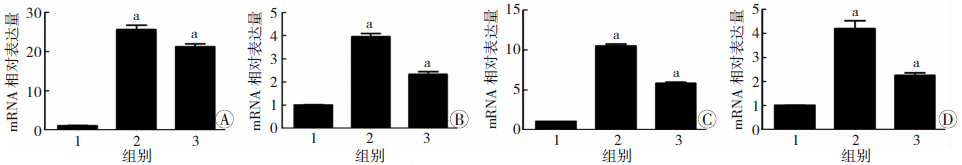 |
| A-B:Real-time PCR检测miR-7对GW3965诱导FAS表达的影响 1:转染NC mimics后以DMSO处理组;2:转染NC mimics后以GW3965(2 μmol/L)处理组;3:转染miR-7 mimics后以GW3965(2 μmol/L)处理组;C-D:Real-time PCR检测miR-7对TO901317诱导ACC表达的影响 1:转染NC mimics后以DMSO处理组;2:转染NC mimics后以TO901317(5 μmol/L)处理组;3:转染miR-7 mimics后以TO901317(5 μmol/L)处理组;a:P<0.05,与1组比较 图 5 过表达MiR-7抑制GW3965、TO901317诱导的FAS和ACC表达 |
将miR-7 mimics或NC mimics(80 nmol/L)转染HepG2细胞后,以GW3965(2 μmol/L)和TO901317(5 μmol/L)处 理12 h,然后检测细胞内甘油三酯含量,结果表明,GW3965(2 μmol/L)和TO901317(5 μmol/L) 能明显促进甘油三酯生成,而miR-7 mimics能抑制该诱导作用(图 6)。
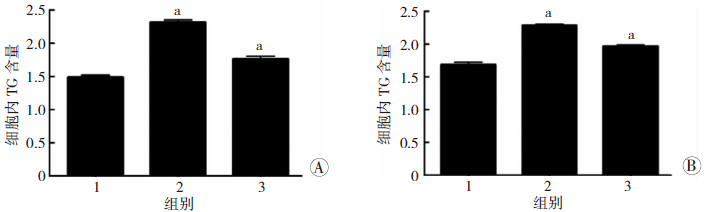 |
| A:miR-7对GW3965诱导甘油三酯升高的影响 1:转染NC mimics后以DMSO处理组;2:转染NC mimics后以GW3965(2 μmol/L)处理组;3:转染miR-7 mimics后以GW3965(2 μmol/L)处理组;B:miR-7对TO901317诱导甘油三酯升高的影响 1:转染NC mimics后以DMSO处理组;2:转染NC mimics后以TO901317(5 μmol/L)处理组;3:转染miR-7 mimics后以TO901317(5 μmol/L)处理组;a:P<,与1组比较 图 6 过表达MiR-7抑制GW3965、TO901317诱导的HepG2细胞甘油三酯水平变化 |
甘油三酯过度合成和堆积导致的肝脂肪性变(hepatic steatosis)与脂肪性肝炎、肝纤维化,甚至是肝癌密切相关,抑制甘油三酯的过度合成将有利于这些疾病的防治。LXRβ是调节甘油三酯合成的重要分子,其活化后可增强FAS、ACC的表达而促进脂肪酸的合成,进而与脂质生成堆积相关疾病的发生、发展密切相关。因此,通过下调LXRβ的表达而抑制脂肪酸的过度合成,将有利于缓解甘油三酯合成或堆积导致的相关代谢疾病。近年研究表明,LXRβ一方面通过配体激活后调控下游靶基因而具有调节代谢、抗炎、抗肿瘤等重要作用[13, 14]。另一方面,其自身表达或活性也可受到调控,如PPAR、ROR、ORP1S等都可以调控LXRβ的表达。而作为转录后调节基因表达的一种重要方式——microRNA,能否调节LXRβ的表达,尚不清楚。
MiR-7抑制脂质生成是近年发现的一项新功能,但其具体分子机制尚不清楚。MiR调节基因表达时,常结合在靶基因3′-UTR而降解mRNA或抑制翻译,且目前的生物信息学预测软件或网站也多集中于预测miR与靶基因3′-UTR的结合。近年研究发现,miR也可结合在靶基因的ORF区发挥作用,但相应的预测软件或网站尚不成熟。因此,在本研究中,我们通过网站(Targetscan和Pictar)进行生物信息学预测miR-7与LXRβ mRNA的3′-UTR结合位点,结果发现,在Targetscan 和Pictar网站中,LXRβ mRNA的3′-UTR区都有miR-7的可能结合位点,其结合位点在LXRβ mRNA的3′-UTR 178-184(图 1)。
本研究中,过表达miR-7可抑制LXRβ mRNA及蛋白的表达(图 2A),在探讨其机制时,我们发现,过表达miR-7能够显著抑制LXRβ 3′-UTR的报告基因活性,而miR-7的inhibitors可通过拮抗内源性的miR-7使LXRβ的3′-UTR活性升高(图 3B);并且过表达miR-7对LXRβ 3′-UTR的抑制作用能被其对应的miR-7 inhibitors拮抗(图 3C)。然而,过表达miR-7对LXRα 3′-UTR的活性并没有影响(图 4),上述结果表明miR-7能特异地结合在LXRβ的3′-UTR区,从而抑制LXRβ的表达。
在研究miR-7抑制LXRβ表达与其抑制脂质生成的关系时,我们选择了脂肪酸合酶(FAS)、乙酰CoA羧化酶(ACC)两个基因。它们不但在脂肪酸合成中发挥重要作用,而且是LXRβ直接靶基因,结果显示,miR-7能够抑制LXRβ激动剂诱导的FAS、ACC的表达(图 5)。该结果表明通过下调LXRβ而抑制FAS、ACC的表达可能是miR-7抑制脂质生成的新机制,该研究为进一步揭示miR-7在脂质生成中的作用及表达调控机制积累新的理论资料;乃至为探索甘油三酯过度合成导致的相关疾病的防治中,针对过表达miR-7抑制“LXRβ→FAS、ACC通路”而抗脂质生成提供科学依据。
| [1] | Bouchi R, Takeuchi T, Akihisa M, et al. High visceral fat with low subcutaneous fat accumulation asadeterminant of atherosclerosis in patients with type 2 diabetes[J]. Cardiovasc Diabetol, 2015, 14: 136. DOI: 10.1186/s12933-015-0302-4 |
| [2] | Saponaro C, Gaggini M, Carli F, et al. The Subtle Balance between Lipolysis and Lipogenesis:ACritical Point in Metabolic Homeostasis[J]. Nutrients, 2015, 7(11): 9453- 9474. DOI: 10.3390/nu7115475 |
| [3] | Bovenga F, Sabba C, Moschetta A. Uncoupling nuclear receptor LXR and cholesterol metabolism in cancer[J]. Cell Metab, 2015, 21(4): 517-526. DOI: 10.1016/j.cmet. 2015.03.002 |
| [4] | BradleyMN, Hong C, Chen M, et al. Ligand activation of LXR beta reverses atherosclerosis and cellular cholesterol overload in mice lacking LXR alpha and apoE[J].JClin Invest, 2007, 117(8): 2337-2346. |
| [5] | Archer A, Stolarczyk E, DoriaML, et al. LXR activation by GW3965 alters fat tissue distribution and adipose tissue inflammation in ob/ob female mice[J].JLipid Res, 2013, 54(5): 1300-1311. DOI: 10.1194/jlr.M033977 |
| [6] | Schmuth M, Moosbrugger-Martinz V, Blunder S, et al. Role of PPAR, LXR, and PXR in epidermal homeostasis and inflammation[J]. Biochim Biophys Acta, 2014, 1841(3): 463-473. DOI: 10.1016/j.bbalip.2013.11.012 |
| [7] | HessvikNP, BoekschotenMV, BaltzersenMA, et al. LXR{beta} is the dominant LXR subtype in skeletal muscle regulating lipogenesis and cholesterol efflux[J]. AmJPhysiol Endocrinol Metab, 2010, 298(3): E602-E613. DOI: 10.1152/ajpendo.00553.2009 |
| [8] | Hogmoen-AstrandOA, Gikling I, Sylte I, et al. Development of new LXR modulators that regulate LXR target genes and reduce lipogenesis in human cell models[J]. EurJMed Chem, 2014, 74: 258-263. DOI: 10.1016/j.ejmech.2014.01.003 |
| [9] | Aalaei-AndabiliSH, Rezaei N. MicroRNAs (MiRs) precisely regulate immune system development and function in immunosenescence process[J]. Int Rev Immunol, 2016, 35(1): 57-66. DOI: 10.3109/08830185.2015.1077828 |
| [10] | He Y, Lin L, Cao J, et al. Up-regulated miR-93 contributes to coronary atherosclerosis pathogenesis through targeting ABCA1[J]. IntJClin Exp Med, 2015, 8(1): 674-681. |
| [11] | Larsen L, RosenstierneMW, GaarnLW, et al. Expression and localization of microRNAs in perinatal rat pancreas: role of miR-21 in regulation of cholesterol metabolism[J]. PLoS One, 2011, 6(10): e25997. DOI: 10.1371/journal.pone. 0025997 |
| [12] | He F, Li J, Mu Y, et al. Downregulation of endothelin-1 by farnesoidXreceptor in vascular endothelial cells[J]. Circ Res, 2006, 98(2): 192-199. |
| [13] | Weiss K, Mihaly J, Liebisch G, et al. Effect of synthetic ligands of PPAR alpha, beta/delta, gamma, RAR, RXR and LXR on the fatty acid composition of phospholipids in mice[J]. Lipids, 2011, 46(11): 1013-1020. DOI: 10.1007/ s11745- 011-3593-6 |
| [14] | HessvikNP, BakkeSS, Smith R, et al. The liverXreceptor modulator 22(S)-hydroxycholesterol exerts cell-type specific effects on lipid and glucose metabolism [J].JSteroid Biochem Mol Biol. 2012,128(3-5):154-164. DOI: 10.1016/j.jsbmb.2011.10.006 |



