2. 400016重庆,重庆医科大学:附属第一医院老年科 ;
3. 400016重庆,重庆医科大学:基础医学院生理学教研室
2. Department of Geriatrics, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China ;
3. Department of Physiology, College of Basic Medical Sciences, Chongqing Medical University
抑郁症具有高患病率、高复发率、高自杀率的特点[1],是一种严重的精神疾病,发病率高达16~20%[2],到2020年可能成为仅次于冠心病的第二大疾病。而目前的临床一线抗抑郁药物,在治疗时虽然可以改善抑郁症患者症状,但是仅对部分患者有效,起效慢,复发率高且需要长期治疗[3],这些情况提示,抑郁症可能存在更加复杂的病理生理过程,迫切需要我们对抑郁症的发病机制进行更深入的研究。
近年来,越来越多的研究表明大脑各个脑区的神经结构在抑郁症患者和模型动物身上都发生了不同程度的变化[4-5]。其中海马作为情感行为的结构基础,其在抑郁症发病过程中极易受到损伤[6-7]。核磁共振成像研究发现,抑郁症会导致左侧海马体积的迅速下降[6]。在海马结构中,齿状回(dentate gyrus,DG)的改变成为近年来抑郁症的研究热点:文献[8]报道抑郁患者海马DG体积显著下降与重度抑郁症患者的记忆力降低有关。由此可见,DG在抑郁症发生发展过程中意义重大。此外,文献[9]报道抑郁症的行为学变化与海马突触超微结构水平的重建有关,他们推测突触密度降低导致的海马功能障碍可能是抑郁症发生的重要形态学基础之一。可见突触的改变在抑郁症的发病机制中至关重要。然而,过去的研究多为定性和半定量的研究,运用现代体视学方法对抑郁症动物模型海马DG内突触的改变进行准确的三维定量研究,国内、外尚少见报道。因此,我们采用现代体视学方法与免疫组织化学染色相结合的方法定量研究抑郁症CUS模型大鼠海马DG总体积和DG内突触密度、突触总数的改变,以期进一步认识抑郁症海马DG结构的改变,为抑郁症发病机制的研究提供形态学依据。
1 材料与方法 1.1 实验动物选取4~5周龄,体质量100~150 g的雄性SD大鼠。CUS组大鼠给予4周的慢性应激,对照组正常喂养,不给予任何干预。2周的糖水基线筛选和4周的CUS应激,最终得到对照组15只和CUS组23只。
1.2 实验方法 1.2.1 慢性不可预知应激模型的建立根据参考文献[11-12],对CUS组采取的应激种类有:夹尾(1 min)、热水浴(45 ℃,5 min)、冷水浴(4 ℃,5 min)、禁食(≤24 h)、禁水(≤24 h)、昼夜颠倒(连续做24~48 h,通宵照明,关灯3 h)、潮湿垫料(≤24 h)、无垫料(≤24 h)、行为限制(≥1 h)、倾斜(45°,≤24 h)、电击 (强度1.0 ~ 1.5 mA,5 min);噪音(85~95分贝,≥3 h)、 频闪 (夜间进行,≥3 h)。每天采用3种应激,每周不重复。应激时间持续4周。
1.2.2 体质量测量每7天对大鼠进行1次体质量的测量,评估应激建模对大鼠体质量的影响。
1.2.3 糖水偏好实验用于评估动物抑郁症核心症状快感缺失的程度[11]。快感缺失的出现,是抑郁症动物模型造模成功的标志。建模前对大鼠进行糖水适应性训练7 d,建模后每7 d 对大鼠进行糖水偏好实验。实验前禁食禁水24 h,给予大鼠1%蔗糖水和纯水各1瓶,24 h 后称量。按公式计算大鼠糖水消耗量和糖水偏好百分比。
| $糖水偏好百分比=\frac{糖水消耗\left( g \right)}{总液体消耗\left( g \right)}\times 100%$ |
旷场试验用于评价实验动物在新异环境中的自主行为、探究行为与紧张度[13]。实验设备规格:长×宽×高=50 cm×50 cm×40 cm。将大鼠放置于方形旷场测试箱的中央,通过电脑软件监控系统记录5 min内大鼠在旷场测试箱内垂直活动和水平活动的次数,在中央区域活动时间和活动路程,在测试箱内活动的总路程和平均速度。
1.2.5 高架十字迷宫实验旷场实验结束后,对两组大鼠进行高架十字迷宫实验,测试两组大鼠是否存在焦虑行为。实验设备规格:长×宽×高=50 cm×10 cm× 40 cm。将大鼠头朝开臂方向放在中心区域后,实验者离开,通过电脑软件监控系统记录5 min内大鼠在高架十字迷宫活动的总路程及平均速度,进入开臂的次数及在开臂滞留的时间和路程,进入闭臂的次数及在闭臂滞留的时间和路程。
1.2.6 标本取材与固定每组随机选取5只大鼠。1%戊巴比妥钠腹腔注射麻醉剖开胸腹腔,迅速暴露心脏,将连接灌注泵的针头经心尖刺入左心室,剪开右心耳。给予生理盐水灌注,流速30 mL/min,至流出液由红色变为澄清液。肝脏颜色变浅时,换用4%多聚甲醛以20 mL/min的速度灌注150~200 mL,以颈部变硬为灌注良好的标志。灌注后取出脑组织,分离左右半脑,置于多聚甲醛固定液浸泡。
1.2.7 免疫组织化学染色随机抽取每只大鼠的一侧大脑半球依次进入梯度蔗糖水中脱水(10%、20%、30%蔗糖水各24 h),使用冰冻切片机以 60 μm 为间距从大脑冠状面依次进行连续组织切片。从第1张出现海马组织的切片开始,按 1/6 的抽样分数进行抽样,即在前6张组织切片中随机抽取一张,此后每6张抽一张。切片用0.01 mol/L PBS液漂洗30 min、PBS液37 ℃复温30 min、0.3%Tween-20(0.01 mol/L PBS配置)漂洗5 min×12次;0.3%Tween-20、0.1%鱼明胶、5%山羊血清、1%胎牛血清37 ℃封闭3 h,加入1 ∶2 000 抗spinophilin单克隆抗体(abcam)常温孵育24 h、4 ℃孵育48 h。用0.3%Tween-20漂洗5 min×12次、1 ∶200免疫胶体金试剂(Electron Microscopy Sciences)4 ℃孵育过夜。次日取出后用0.3%Tween-20和0.01 mol/L PBS各漂洗5 min×6次、2%戊二醛避光固定10 min、0.01 mol/L PBS 和去离子水各漂洗5 min×6次、银增强试剂盒(Electron Microscopy Sciences)避光显色30 min、去离子水10 min×3次、0.01 mol/L PBS液漂洗10 min×3次、贴片、风干、复染、返蓝、脱水、透明、封片。
1.2.8 定性观察选取两组动物切片DG相同部位,1 000倍光镜下观察两组动物的突触密度差异情况。
1.2.9 海马分区在40倍镜下,采用体视学系统(NewCAST,Olympus,Glostrup,Denmark),画出海马DG边界(图 1)。
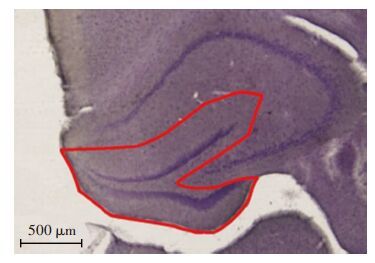
|
| 图 1 光镜下定义海马DG边界示意图 (Spinophilin免疫组化染色,红线为DG边界) |
1.2.10 突触的体视学计数
组织切片分区后,在体视学系统中应用光学分合法计数DG突触总数目。在100倍油镜下(Olympus,BX51,Japan),每张切片上随机选取1~3个位置测量切片的厚度,即切片上表面与下表面之间的距离。当镜下视野第一次清晰聚焦在时为上表面,设为0;当切片最后一次清晰聚焦为下表面,此时Z轴上显示的刻度即为切片的厚度。然后在NewCAST系统中统一设置切片面积抽样分数0.003 57% ,测试框面积4.75 μm 2,测试框高度 15 μm,切片保护高度3 μm,对海马组织DG进行抽样计数。体视学无偏计数框的计数原则为:如果突触完全落在无偏计数框内或只与上线和右线相交,而不与左线及其延长线、下线和右线延长线相交时,则被计数(图 2)。
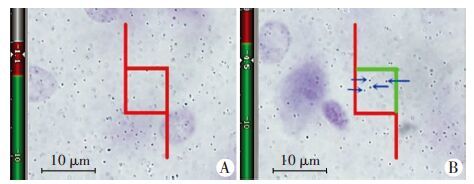
|
| A: 1.1 μm位置(保护高度内); B: 4.5 μm位置(保护高度以下)Spinophilin免疫组化染色,银增强显色后突触呈黑色小点状 ↑: 示即时清晰聚焦的突触 图 2 光学体视框计数海马DG突触数量的示意图 |
按照光学分合法计算海马DG突触总数目的公式(2)如下[14]:
| ${{\text{N}}_{\left( \text{total} \right)}}\text{=}\sum{{{\text{Q}}^{\text{-}}}}\text{ }\!\!\times\!\!\text{ 1/ssf }\!\!\times\!\!\text{ 1/asf }\!\!\times\!\!\text{ 1/tsf}$ | (2) |
ΣQ—为海马DG内计数的突触总数目;ssf为 1/6,即组织切片的抽样分数;asf为0.00357%,即组织切片内海马DG面积抽样分数;tsf为组织切片内海马DG厚度抽样分数(H/T),其中H为15 μm,即光学体视框的测试高度;T为免疫组化染色后组织切片平均厚度25 μm。
1.2.11 海马DG突触数目密度和DG体积的计算分别用公式(3) (4) 算DG突触数目密度NV(突触/DG)和DG体积V(DG)[17]:
| ${{\text{N}}_{\text{V}}}=\sum{{{\text{Q}}^{\text{-}}}}/\sum{{\text{{V}'}}}$ | (3) |
Nv为DG突触数目密度,ΣQ—为运用体视框计数的突触总数目,ΣV’为体视框的总体积。
| ${{\text{V}}_{\left( \text{DG} \right)}}\text{=}{{\text{N}}_{\left( \text{突触,DG} \right)}}\text{/}{{\text{N}}_{\text{V}\left( \text{突触/DG} \right)}}$ | (4) |
V(DG)为DG体积,N(突触,DG)为DG突触总数目,NV(突触/DG)为DG内突触数目密度。
1.3 统计学处理实验数据以 x±s表示,使用SPSS 19.0统计软件对数据进行统计学分析。重复测量数据采用重复数据方差分析进行检验。经过正态分布检验后,对符合正态分布的资料进行独立样本t检验进行组间数据比较,对不符合正态分布的资料采用非参数检验中的两独立样本的Wilcoxon 秩和检验(Mann-Whitney U 检验)。检验水准α=0.05。
2 结果 2.1 大鼠体质量变化应激干预开始后,对照组大鼠平均体质量逐渐增加,而CUS组大鼠平均体质量增加速度逐渐下降,应激干预第3周开始,CUS组大鼠平均体质量显著低于对照组(P<0.05,图 3)。
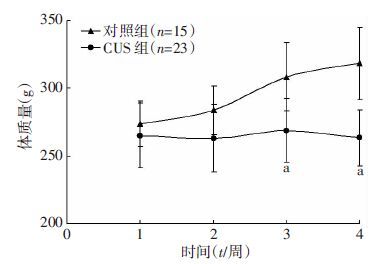
|
| a:P<0.05,与对照组比较 图 3 2组大鼠应激4周期间体质量曲线分析 ( x±s) |
2.2 糖水偏好百分比
在干预过程中,对照组大鼠的糖水偏好稳定在90%左右,而CUS组大鼠其糖水偏好从应激干预开始逐渐下降,并从第2周开始显著低于对照组 (第2周 P<0.05,第3、4周P<0.01,图 4)。
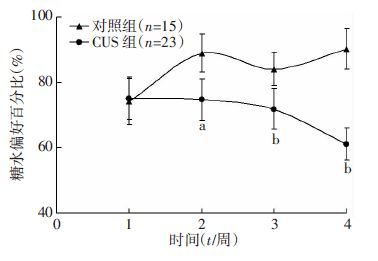
|
| a:P<0.05,b:P<0.01,与对照组比较 图 4 2组大鼠应激4周期间糖水偏好改变曲线分析 ( x±s) |
2.3 旷场试验结果
CUS组大鼠活动总路程、平均速度较对照组有所下降,但差异没有统计学意义。而CUS组大鼠中央区域路程、中央区域时间比和中央区域路程比均较对照组显著性降低 (P<0.05,表 1)。
| 组别 | n | 总路程(cm) | 速度(cm/s) | 中央活动路程(cm) | 中央活动时间(s) | 中央路程比(%) | 中央时间比(%) |
| 对照组 | 15 | 2375.38±442.24 | 7.92±1.48 | 151.03±124.72 | 15.93±14.71 | 5.99±4.43 | 5.31±4.90 |
| CUS组 | 23 | 2268.61±895.29 | 7.56±2.98 | 89.39±50.65 | 9.03±5.84 | 3.98±1.95 | 3.01±1.95 |
2.4 高架十字迷宫实验结果
在高架十字迷宫实验中,对照组和CUS组大鼠在迷宫内活动的总路程、平均速度、进臂总次数、开臂滞留时间、开臂的路程、开臂进入次数、开臂滞留时间百分比、开臂的路程百分比、开臂进入次数百分比、闭臂滞留时间、闭臂的路程、闭臂进入次数、闭臂滞留时间百分比、闭臂的路程百分比、闭臂进入次数百分比差异均无统计学意义(P>0.05,表 2)。
| 组别 | n | 总路程(mm) | 速度(mm/s) | 进臂总次数 | 开臂滞留时间(s) | 开臂的路程(mm) | 开臂进入次数 | 开臂滞留时间百分比(%) | 闭臂的路程(mm) | 开臂的路程百分比(%) | 开臂进入次数百分比(%) | 闭臂滞留时间(s) | 闭臂进入次数 | 闭臂滞留时间百分比(%) | 闭臂的路程百分比(%) | 闭臂进入次数百分比(%) |
| 对照组 | 15 | 8 930.33±729.34 | 29.77±7.29 | 7.33±1.49 | 24.75±5.14 | 1 386.18±226.26 | 2.00±0.33 | 6.19±5.75 | 6787.77±787.93 | 12.62±10.73 | 20.69±6.39 | 263.18±12.27 | 5.33±1.49 | 87.74±4.10 | 74.62±8.72 | 31.54±14.37 |
| CUS组 | 23 | 8 777.60±638.63 | 28.28±2.13 | 10.50±1.73 | 30.10±7.65 | 1 307.16±293.23 | 2.86±0.46 | 10.05±2.56 | 6543.70±85.64 | 15.76±4.12 | 16.13±2.87 | 247.58±33.91 | 7.63±1.47 | 82.61±11.33 | 73.90±14.91 | 34.26±13.47 |
2.5 形态学定性结果
100倍镜下可见,与对照组大鼠海马DG内突触相比,CUS组海马DG内突触分布较为稀疏(图 5)。

|
| A:对照组; B:CUS组 图 5 光镜观察对照组和CUS组大鼠应激4周后突触变化 |
2.6 体视学定量结果
CUS模型组(16287.75±2717.14 μm3)与对照组的DG体积(16091.81±2346.91 μm3)差异无统计学意义 (P>0.05) 与对照组大鼠(0.15±0.03 /μm3)相比,CUS组大鼠海马DG突触数目密度(0.48±0.13 /μm3) 显著下降(P<0.05) 与对照组大鼠(2.103 3×109)相比,CUS组大鼠海马DG突触总数(6.713 5×108)显著下降(P<0.05)
3 讨论一直以来,针对抑郁症患者的研究主要来源于影像学研究以及尸检结果,由于标本数量有限,且无法进行抑郁症机制的系统深入研究,因此,抑郁症动物被广泛应用于抑郁症的病理生理及发病机制研究中[15]。在本实验中,慢性应激干预后的部分SD大鼠糖水偏好百分比显著性低于对照组,提示这部分SD大鼠具有愉快感缺失的典型抑郁症状,是成功的CUS模型。此外,本实验还对各组SD大鼠进行了旷场试验和高架十字迷宫实验。旷场实验结果显示,与对照组相比,CUS组大鼠自发性活动明显减少,而两组大鼠在高架十字迷宫实验中表现差异并无统计学意义。以上结果表明,本实验中选为CUS组的SD大鼠表现出快感缺失和自发活动减少等抑郁样行为[16],但是不伴有焦虑情绪——这符合临床上只有部分抑郁症患者伴有焦虑情绪的情况[17]。本实验中CUS组大鼠体质量显著下降,这一改变也与临床抑郁症患者的表现相符合。以上的行为学实验结果表明,CUS模型建立成功并能良好的模拟人类抑郁症的核心症状——快感缺失。
海马结构的改变在抑郁症发生发展和治疗过程中具有重要作用,缓解、甚至逆转海马结构的病理改变对抑郁症的治疗及预后意义重大[18]。近期有影像学研究发现,重度抑郁症患者海马DG体积显著下降,而海马结构总体积及其他亚区体积差异并无统计学意义,且DG体积下降程度与重度抑郁症患者的记忆力下降程度有关。而本实验中,通过新的无偏体视学方法测得抑郁症CUS模型大鼠在4周应激之后,DG总体积萎缩不显著。我们分析,造成这一差异的原因可能有以下三方面:(1)影像学方法适合活体研究,但通过影像学成像技术获取的海马数据仍然是间接的、不准确的,在影像学图片上,难以定义海马内各亚区边界,更无法对海马及其各亚区的超微结构改变进行定量研究,而本实验用1 000倍光镜下海马内细胞带的形态变化为标准定义边界的,并用三维体视学定量方法做研究,得出的结果更为准确;(2)并非所有抑郁症都存在海马体积的萎缩;(2)影像学研究对象为抑郁症患者,本实验研究对象为抑郁症CUS模型大鼠,模拟的是抑郁症早期改变,此时DG体积可能尚未发生改变。因此,我们推测,抑郁症海马内突触等超微结构的改变可能比海马体积的萎缩更加重要。
近年来,抑郁症形态学机制的研究更倾向于调节突触可塑性的突触自稳态机制被破坏这一假说。有学者认为,这一机制被破坏导致了突触形态稳定性的降低、突触联系减少[19]。基于此,本实验将抑郁症的突触改变作为主要研究内容。目前常用的突触前或突触后成分的标记物有Synapsin、PSD-95等,而本实验中采用的标记物为Spinophilin。Spinophilin是一种神经细胞骨架蛋白,可以调节兴奋性突触传递和树突棘的形态,它特异性结合在突触的末梢,而该处是突触改变最为敏感迅速的部分;高达93%的突触包含Spinophilin。故而用它来作为免疫组化染色中突触的标志物,特异性较高,是目前较公认的突触标志物。对比其他常用标记物Synapsin与PSD-95二者都是与突触的蛋白转运更为相关,而本实验定量研究计数的是DG所有的突触数目,因此,本实验结果更接近真实、客观的DG突触总数目。
在本实验中,我们通过运用无偏体视学方法进行精确定量,发现CUS模型大鼠DG突触数目密度、突触总数都有显著下降。目前也有其他团队对海马突触改变与抑郁症关系进行研究,但存在以下各方面的问题:通过突触信号蛋白水平减低间接说明突触减少的方法属定性研究,无法真正对突触进行定量;转基因模型存在局限性,目前的研究结果认为抑郁症是一种多基因疾病,受到环境中的生物、心理和社会因素共同作用[20];抑郁症获得性无助模型仅使用了电击的单一刺激方式,刺激方式持续而有规律,缺乏不可预知性,建模时间上也较短,难以模拟导致抑郁症的慢性刺激方式;嗅球切除模型和卵巢切除模型等都为有创模型,无法排除创伤、感染等诸多因素对动物行为学和突触改变的影响;少数选用慢性应激模型,也未对DG进行研究;且由于大脑、海马都为三维立体结构,而切片为二维平面信息,受突触分布的影响,使得不同切片方向和不同切片部位得到不同的结果,因此仅使用定性、半定量和不准确的定量方法,无法对海马DG突触的情况进行更加真实客观的反映。
综上所述,本研究运用无偏体视学方法对抑郁症模型大鼠海马DG突触进行了定量研究,为抑郁症大鼠海马DG突触改变提供了形态学数据。本研究结果显示大鼠海马DG突触减少、突触密度降低,而DG体积无明显萎缩,这提示大鼠海马DG突触减少可能是抑郁症发病重要的神经结构基础。以此为切入点深入研究抑郁症突触改变机制以及抗抑郁治疗中的突触改变及机制,可能为抑郁症研究和防治提供新的治疗靶点和思路。
| [1] | American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders (DSM-5)[M]. Washington: American Psychiatric Association, 2013 : 155 -188. |
| [2] | Kupfer D J, Frank E, Phillips M L. Major depressive disorder: new clinical, neurobiological, and treatment perspectives[J]. Lancet,2012, 379 (9820) : 1045 –1055. DOI:10.1016/S0140-6736(11)60602-8 |
| [3] | Cai X, Kallarackal A J, Kvarta M D, et al. Local potentiation of excitatory synapses by serotonin and its alteration in rodent models of depression[J]. Nat Neurosci,2013, 16 (4) : 464 –472. DOI:10.1038/nn.3355 |
| [4] | Duric V, Banasr M, Stockmeier C A, et al. Altered expression of synapse and glutamate related genes in post-mortem hippocampus of depressed subjects[J]. Int J Neuropsychopharmacol,2013, 16 (1) : 69 –82. DOI:10.1017/S1461145712000016 |
| [5] | Toga A W, Clark K A, Thompson P M, et al. Mapping the human connectome[J]. Neurosurgery,2012, 71 (1) : 1 –5. DOI:10.1227/NEU.0b013e318258e9ff |
| [6] | Stein J L, Medland S E, Vasquez A A, et al. Identification of common variants associated with human hippocampal and intracranial volumes[J]. Nat Genet,2012, 44 (5) : 552 –561. DOI:10.1038/ng.2250 |
| [7] | Eisch A J, Petrik D. Depression and hippocampal neurogenesis: a road to remission?[J]. Science,2012, 338 (6103) : 72 –75. DOI:10.1126/science.1222941 |
| [8] | den-Heijer T, Tiemeier H, Luijendijk H J, et al. A study of the bidirectional association between hippocampal volume on magnetic resonance imaging and depression in the elderly[J]. Biol Psychiatry,2011, 70 (2) : 191 –197. DOI:10.1016/j.biopsych.2011.04.014 |
| [9] | Travis S, Coupland N J, Silversone P H, et al. Dentate gyrus volume and memory performance in major depressive disorder[J]. J Affect Disord,2014, 172 : 159 –164. DOI:10.1016/j.jad.2014.09.048 |
| [10] | Hajszan T, Dow A, Warner-Schmidt J L, et al. Remodeling of hippocampal spine synapses in the rat learned helplessness model of depression[J]. Biol Psychiatry,2009, 65 (5) : 392 –400. DOI:10.1016/j.biopsych.2008.09.031 |
| [11] | Seney M L, Walsh C, Stolakis R, et al. Neonatal testosterone partially organizes sex differences in stress-induced emotionality in mice[J]. Neurobiol Dis,2012, 46 (2) : 486 –96. DOI:10.1016/j.nbd.2012.02.014 |
| [12] | Son H, Banasr M, Choi M, et al. Neuritin produces antidepressant actions and blocks the neuronal and behavioral deficits caused by chronic stress[J]. Proc Natl Acad Sci U S A,2012, 109 (28) : 11378 –11383. DOI:10.1073/pnas.1201191109 |
| [13] | Grissom E M, Hawley W R, Bromley-Dulfano S S, et al. Learning strategy is influenced by trait anxiety and early rearing conditions in prepubertal male, but not prepubertal female rats[J]. Neurobiol Learning Mem,2012, 98 (2) : 174 –181. DOI:10.1016/j.nlm.2012.06.001 |
| [14] | Padurariu M, Ciobica A, Mavroudis I, et al. Hippocampal neuronal loss in the CA1 and CA3 areas of Alzheimer's disease patients[J]. Psychiatr Danub,2012, 24 (2) : 152 –158. |
| [15] | Krishnan V, Nestler E J. Animal models of depression: molecular perspectives[J]. Curr Top Behav Neurosci,2011, 7 : 121 –47. DOI:10.1007/7854_2010_108 |
| [16] | Snyder J S, Soumier A, Brewer M, et al. Adult hippocampal neurogenesis buffers stress responses and depressive behaviour[J]. Nature,2011, 476 (7361) : 458 –461. DOI:10.1038/nature10287 |
| [17] | Johansson R, Carlbring P, Heedman A, et al. Depression, anxiety and their comorbidity in the Swedish general population: point prevalence and the effect on health-related quality of life[J]. PeerJ,2013, 1 : e98 . DOI:10.7717/peerj.98 |
| [18] | Taylor W D, McQuoid D R, Payne M E, et al. Hippocampus atrophy and the longitudinal course of late-life depression[J]. Am J Geriatr Psychiatry,2014, 22 (12) : 1504 –1512. DOI:10.1016/j.jagp.2013.11.004 |
| [19] | Duman R S, Aghajanian G K. Synaptic dysfunction in depression: potential therapeutic targets[J]. Science,2012, 338 (6103) : 68 –72. DOI:10.1126/science.1222939 |
| [20] | Karayiorgou M, Flint J, Gogos J A, et al. The best of times, the worst of times for psychiatric disease[J]. Nat Neurosci,2012, 15 (6) : 811 –812. DOI:10.1038/nn.3115 |



