2. 400038 重庆,第三军医大学高原军事医学系高原生理学与高原生物学教研室
2. Department of High Altitude Physiology and Biology, College of High Altitude Military Medicine, Third Military Medical University, Chongqing, 400038, China
血管内皮通透性的改变是很多疾病的病理基础。缺氧是临床常见的病理过程,是多种疾病的重要致病因素。研究表明:缺氧可以改变内皮细胞之间的连接作用,破坏血管内皮的完整性,但机制不十分清楚。目前已经明确缺氧刺激VEGF表达以及缺氧刺激产生的炎性因子在介导内皮细胞通透性增加中起重要作用[1],但它们是通过影响细胞连接复合物的形成和稳定起作用。如何保护血管内皮的完整性,抑制缺氧导致的血管内皮细胞高通透性,仍然缺乏有效的措施。
丁酸钠(sodium butyrate,NaB)是一种短链脂肪酸,可以通过肠道菌群对纤维性食物的消化间接产生。以往的研究表明:通过抑制缺氧以及炎症因子刺激的血管平滑肌细胞增殖,丁酸钠在动脉粥样硬化和血管重构的防治中发挥作用[2]。丁酸钠也可以通过抑制NF-κB的核转位,进一步抑制NF-κB调节的炎性因子TNF-α、IL-1β的生成,减轻急性肺损伤小鼠模型发生肺组织损伤及肺水肿的程度[3]。此外,研究还表明:丁酸钠在维持细胞屏障功能方面起作用,它可以通过保护盲肠结扎穿孔小鼠的肠屏障功能,减少了因腹膜炎所致的动物死亡率[4]。
那么,丁酸钠对缺氧所致的血管内皮细胞通透性改变有何影响?是否在维持缺氧血管内皮完整性中发挥作用?目前尚不清楚。本研究以缺氧导致通透性增加的单层血管内皮细胞为实验模型,检测丁酸钠对缺氧血管内皮细胞通透性改变的影响,并探讨其可能的作用机制。
1 材料与方法 1.1 材料人脐静脉内皮细胞(HUVECss)由陈德伟博士惠赠;细胞培养基DMEM(Hyclone公司); 尿素细胞裂解液[自制,尿素8 mol/L;1 mol/L Tris (pH=6.8) 200 μL; 20%SDS 1 mL;甘油2 mL;DTT(1 mol/L)100 μL;Triton-X100 200 μL;PMSF (1 mol/L) 200 μL裂解时加入];抗delta 1 catenin 抗体(p120)(Ab92514,abcam公司);抗β-catenin抗体(AC106,碧云天公司);Anti β-actin 抗体(A01010-2,艾美捷公司);辣根酶标山羊抗兔(ZB-2301,中杉金桥公司)、辣根酶标山羊抗鼠(ZB-2305,中杉金桥公司);FITC标记山羊抗兔IgG(H+L)(A0562,碧云天公司);Transwell小室(3460,Corning公司);Quantichrom BcG Albumin Assay Kit(BioAssay Systems)。
1.2 方法 1.2.1 实验分组人脐静脉内皮细胞(human umbelical vein endothelial cells,HUVECs)分为常氧组 (21%O2)、缺氧组(1%O2)及缺氧+丁酸钠组(n=3),缺氧+丁酸钠组分为0、0.3、1、3 mmol/L 4个剂量组(n=3)。
1.2.2 Transwell小室检测单层内皮通透性HUVECs 以10×104的密度接种于预先平衡的Transwell膜上,待长满整个Transwell小室的底膜,将上室换成含2%血清牛蛋白(BSA)的培养基,进行相应的实验处理。在各时间点,回收Transwell小室的上、下室液体,用Quantichrom BcG Albumin Assay Kit试剂盒,检测各室液体中BSA浓度,单层内皮通透性计算公式:(下室BSA浓度-培养基BSA浓度)×下室液体体积/(上室BSA浓度-培养基BSA浓度)×上室液体体积×100%。
1.2.3 Western blot检测蛋白表达收集各实验组处理的HUVECs细胞,用适量含尿素的细胞裂解液裂解细胞,细胞刮刮取裂解细胞回收到相应EP管中,冰上超声60 s,12 000×g,离心30 min,回收上清即为细胞总蛋白。BCA法测定蛋白浓度。取20 μg蛋白样品,加入1/4体积的SDS-PAGE蛋白上样缓冲液(5×),100 ℃煮蛋白10 min,上样,行SDS聚丙烯酰胺凝胶电泳(5%积层胶和10%分离胶组成)。待溴酚蓝至胶底部时,停止电泳,取出凝胶,采用湿转法,100 V电压转印1 h。取出PVDF膜,用含5%脱脂牛奶的TBST溶液(含0.1%Tween-20的TBS)室温封闭1 h。分别加入抗p120抗体(1 ∶5 000)、抗β-catenin抗体(1 ∶1 000),抗Actin抗体(1 ∶5 000),4 ℃孵育过夜。TBST洗涤3次后,加入辣根酶标山羊抗兔抗体(1 ∶2 000),室温孵育1 h,TBST洗涤3次,SuperSignal West Femto显色,Bio-Rad凝胶成像仪显影照相。采用Quantityone软件分析条带灰度值。
1.2.4 免疫荧光化学技术检测蛋白表达HUVECs 以3×105接种于细胞玻片,放置培养皿中培养过夜。在进行相应处理后,吸弃残液,PBS洗3次,用4 ℃预冷的4%多聚甲醛固定15 min。取出固定好的细胞玻片,PBS洗3次,山羊工作血清封闭1 h。各细胞玻片滴上一抗稀释液(抗p120抗体用TBST以1 ∶200稀释、抗β-catenin抗体用TBST以1 ∶200稀释),4 ℃孵育过夜。取出细胞玻片,复温15 min,PBS洗涤3次,滴上二抗稀释液[FITC标记山羊抗兔IgG(H+L)用TBST以1 ∶200稀释],避光孵育1 h,PBS洗涤3次,纯水洗3次,DAPI避光染色5 min,纯水洗4次。以细胞玻片的细胞面朝下,用Dako封片剂封片于载玻片上,激光共聚焦显微镜观察照相。
1.3 统计学分析采用SPSS 19.00统计软件,实验数据用x ±s表示,各组均数的比较用单因素方差分析。
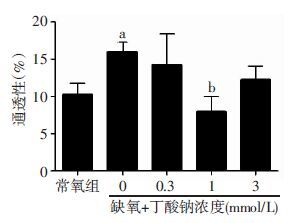
2 结果 2.1 丁酸钠对缺氧12 h血管内皮细胞通透性的影响缺氧(1%O2)12 h时,培养的单层内皮细胞的通透性显著增高,与常氧(21%O2)组相比,差异具有统计学意义(P<0.05);在缺氧复合丁酸钠作用下,与单纯缺氧组比较,1 mmol/L丁酸钠处理的单层内皮细胞的通透性降低,差异具有统计学意义(P<0.05,图 1)。结果表明:缺氧导致单层内皮通透性增加,而丁酸钠对缺氧导致的内皮细胞通透性增加具有抑制作用。
|
| a:P<0.05,与常氧组比较;b:P<0.05,与缺氧组(0 mmol/L 丁酸钠)比较 图 1 丁酸钠抑制缺氧条件下血管内皮细胞通透性的增加 |
2.2 缺氧对血管内皮细胞p120和β-catenin蛋白表达的影响
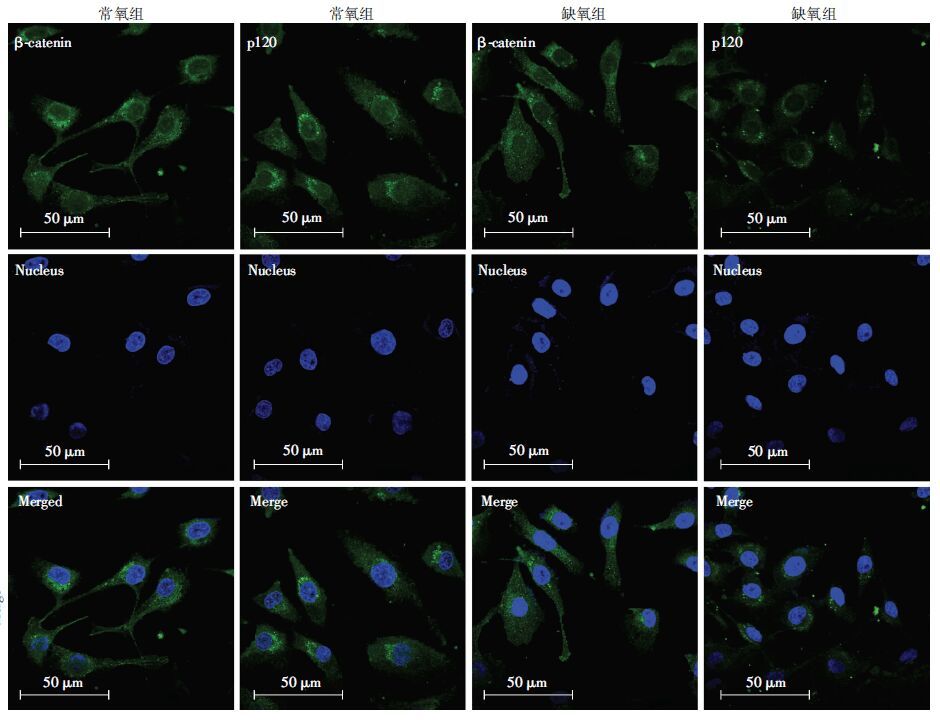
缺氧(1%O2)条件下,血管内皮细胞p120蛋白表达降低,与常氧(21%O2)组比较,差异具有统计学意义(1.157±0.087 vs 0.640±0.220,P<0.05),而β-catenin蛋白表达与常氧组(21%O2)比较,变化不明显(1.050±0.390 vs 0.876±0.400,P>0.05,图 2);免疫荧光染色实验发现:与常氧组(21%O2)比较,缺氧12 h后,p120蛋白分布及其 荧光强度显著降低,而β-catenin蛋白的分布及荧光强度无明显变化(图 3)。结果表明:缺氧抑制血管内皮细胞p120蛋白表达,这可能与单层内皮细胞通透性增加有关。

|
| 图 2 Western blot检测缺氧12 h对血管内皮细胞p120、β-catenin蛋白表达的影响 |
|
| 图 3 免疫荧光化学技术检测缺氧对血管内皮细胞p120、β-catenin蛋白表达的影响 |

|
| 1: 常氧组; 2~5: 分别为缺氧+0、0.3、1、3 mmol/L丁酸钠组 A: Western blot检测;B:半定量分析 a: P< 0.05,与常氧组比较;b: P<0.05,与缺氧组(0 mmol/L丁酸钠)比较 图 4 Western blot检测缺氧12 h丁酸钠对血管内皮细胞p120蛋白表达的影响 |
2.3 丁酸钠对缺氧条件下血管内皮细胞p120表达的影响
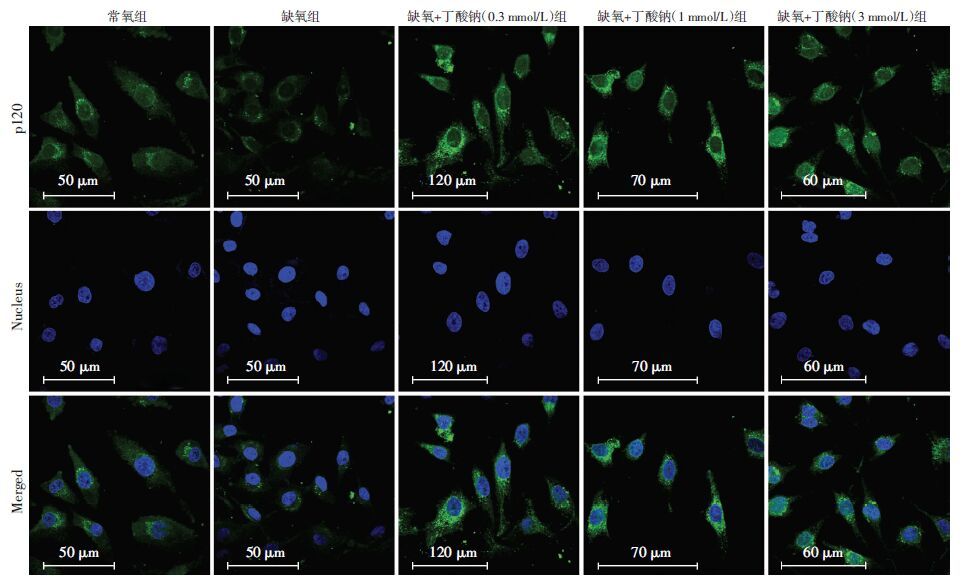
在缺氧复合丁酸钠作用下,与单纯缺氧组相比,1 mmol/L 丁酸钠处理的血管内皮细胞p120蛋白表达增高,差异有统计学意义(P<0.05,图 4)。免疫荧光 染色实验显示:与单纯缺氧组相比,缺氧复合1 mmol/L 丁酸钠处理的血管内皮细胞中,p120蛋白荧光强度增高(图 5)。
|
| 图 5 免疫荧光化学技术检测缺氧12 h丁酸钠对血管内皮细胞p120蛋白表达的影响 |
3 讨论
本研究证实丁酸钠能降低缺氧导致的血管内皮通透性的增加,对维持缺氧条件血管内皮的完整性具有保护作用。丁酸钠可以由结肠腔内细菌酵解膳食纤维生成,在血液中以一定的浓度存在,被认为是膳食纤维对心血管起保护作用的重要分子。并且,丁酸钠在生理浓度下无细胞毒性[5]。本研究从血管内皮细胞通透性角度,进一步揭示了丁酸钠在心血管疾病防治中的作用。
血管内皮通透性主要受细胞间连接复合物的调节,包括紧密连接和黏附连接[6]。以往的研究认为:缺氧可以通过影响紧密连接来增加内皮通透性。Koto等[7]发现,缺氧导致紧密连接蛋白Claudin-5表达降低,引起神经血管内皮细胞通透性增高[7];有研究发现:黄芩苷通过增加脑血管内皮细胞的紧密连接蛋白Claudin-5、ZO-1表达,抑制缺氧血脑屏障通透性增高[8]。而缺氧对血管内皮细胞间黏附连接的影响鲜有报道。黏附连接由内皮细胞特异性钙黏蛋白所构成,它在膜内胞浆段与连环蛋白p120、β-catenin或者γ连环蛋白(γ-catenin)绑定,再借助α-catenin与肌动蛋白细胞骨架相连,构成完整黏附连接结构[6, 9]。研究发现黏附连接钙黏蛋白(VE-cadherin)可以上调Claudin-5表达以及ZO-1分布,促进紧密连接的形成[10]。因此,黏附连接不仅从细胞间影响细胞连接,也可通过影响细胞形态来调节细胞通透性,是调节细胞内皮通透性的重要结构。
本研究发现:缺氧条件下,黏附连接蛋白p120表达显著减少,而β-catenin表达没有变化。以往的研究表明:p120蛋白减少会导致由VE-cadherin、β-catenin、α-catenin 和actin所形成的黏附连接复合物不稳定,改变细胞间的缝隙距离,导致细胞通透性的增加[10]。我们进一步分析了丁酸钠对缺氧p120表达的影响。结果发现:丁酸钠抑制缺氧条件下p120蛋白水平的降低,相应地,缺氧所致的内皮通透性的增加被抑制。这些结果提示:缺氧通过抑制p120表达,破坏内皮细胞间黏附连接复合物结构,导致内皮通透性增加,丁酸钠通过干预这一过程来发挥保护作用。已有研究表明:丁酸钠对细胞紧密连接具有调节作用,能增加肠上皮细胞中occludin-1和Claudin-1的表达[11-12]。鉴于黏附链接对紧密连接的影响,我们认为:黏附链接的破坏可能是缺氧对内皮细胞通透性影响的较早事件,干预这一过程对维持内皮完整性有重要意义。因此,进一步解释缺氧条件下p120表达的变化机制及其对细胞紧密连接的影响,具有重要意义。
目前比较明确的是,p120蛋白亚硝基化能降低其蛋白稳定性,并与内皮细胞通透性的改变直接相关[3]。亚硝基化是一种氧化还原依赖的蛋白翻译后修饰,通过一氧化氮(NO)作用于蛋白质半胱氨酸巯基-SH生成-SNO,影响蛋白质活性、表达、定位,从而调节蛋白质功能[13-16]。因此,我们推测缺氧可能通过影响p120蛋白的亚硝基化修饰状态,降低p120蛋白的稳定性,而丁酸钠抑制了这一变化过程。这一假设将有待于我们下一步的深入研究。
综上所述,我们的研究证实缺氧导致的血管内皮细胞黏附连接蛋白p120表达降低,是内皮细胞通透性增加的重要机制;丁酸钠通过增加缺氧条件下p120蛋白的表达,维持细胞黏附连接复合物的稳定性,抑制缺氧所致的内皮细胞通透性增加。本研究不仅为丁酸钠运用于心血管保护提供了新的实验依据,也提示干预缺氧导致的p120蛋白表达的下调是预防和治疗血管通透性相关疾病的有效措施。
| [1] | Duran W N, Breslin J W, Sanchez F A. The NO cascade, eNOS location, and microvascular permeability[J]. Cardiovasc Res,2010, 87 (2) : 254 –261. DOI:10.1093/cvr/cvq139 |
| [2] | Cantoni S, Galletti M, Zambelli F, et al. Sodium butyrate inhibits platelet-derived growth factor-induced proliferation and migration in pulmonary artery smooth muscle cells through Akt inhibition[J]. FEBS J,2013, 280 (9) : 2042 –2055. DOI:10.1111/febs.12227 |
| [3] | 倪云峰. 丁酸钠在急性肺损伤中保护作用与机制的研究[D]. 西安: 第四军医大学, 2011. |
| [4] | Han X, Song H, Wang Y, et al. Sodium butyrate protects the intestinal barrier function in peritonitic mice[J]. Int J Clin Exp Med,2015, 8 (3) : 4000 –4007. |
| [5] | Perrine S P, Wargin W A, Boosalis M S, et al. Evaluation of safety and pharmacokinetics of sodium 2, 2 dimethylbutyrate, a novel short chain fatty acid derivative, in a phase 1, double-blind, placebo-controlled, single-dose, and repeat-dose studies in healthy volunteers[J]. J Clin Pharmacol,2011, 51 (8) : 1186 –1194. DOI:10.1177/0091270010379810 |
| [6] | Azzi S, Hebda J K, Gavard J. Vascular permeability and drug delivery in cancers[J]. Front Oncol,2013, 3 : 211 . DOI:10.3389/fonc.2013.00211 |
| [7] | Koto T, Takubo K, Ishida S, et al. Hypoxia disrupts the barrier function of neural blood vessels through changes in the expression of claudin-5 in endothelial cells[J]. Am J Pathol,2007, 170 (4) : 1389 –1397. DOI:10.2353/ajpath.2007.060693 |
| [8] | Zhu H, Wang Z, Xing Y, et al. Baicalin reduces the permeability of the blood-brain barrier during hypoxia in vitro by increasing the expression of tight junction proteins in brain microvascular endothelial cells[J]. J Ethnopharmacol,2012, 141 (2) : 714 –720. DOI:10.1016/j.jep.2011.08.063 |
| [9] | Lander H M, Grant A M, Albrecht T, et al. Endothelial cell permeability and adherens junction disruption induced by junin virus infection[J]. Am J Trop Med Hyg,2014, 90 (6) : 993 –1002. DOI:10.4269/ajtmh.13-0382 |
| [10] | Dejana E, Vestweber D. The role of VE-cadherin in vascular morphogenesis and permeability control[J]. Prog Mol Biol Transl Sci,2013, 116 : 119 –144. DOI:10.1016/B978-0-12-394311-8.00006-6 |
| [11] | Wang H B, Wang P Y, Wang X, et al. Butyrate enhances intestinal epithelial barrier function via up-regulation of tight junction protein Claudin-1 transcription[J]. Dig Dis Sci,2012, 57 (12) : 3126 –3135. DOI:10.1007/s10620-012-2259-4 |
| [12] | Ma X, Fan P X, Li L S, et al. Butyrate promotes the recovering of intestinal wound healing through its positive effect on the tight junctions[J]. J Anim Sci,2012, 90 (Suppl 4) : 266 –268. DOI:10.2527/jas.50965 |
| [13] | Marin N, Zamorano P, Carrasco R, et al. S-Nitrosation of β-catenin and p120 catenin: a novel regulatory mechanism in endothelial hyperpermeability[J]. Circ Res,2012, 111 (5) : 553 –563. DOI:10.1161/CIRCRESAHA.112.274548 |
| [14] | Iyer A K, Rojanasakul Y, Azad N. Nitrosothiol signaling and protein nitrosation in cell death[J]. Nitric Oxide,2014, 42 : 9 –18. DOI:10.1016/j.niox.2014.07.002 |
| [15] | 张晓静, 丛斌. 蛋白质巯基亚硝基化对细胞功能的调控作用[J]. 中国病理生理杂志,2011, 27 (11) : 2237 –2240. DOI:10.3969/j.issn.1000-4718.2011.11.040 |
| [16] | 罗雨虹. β-Catenin和p120的S亚硝基化: 内皮高通透性的一种新的调控机制[J]. 生理科学进展,2014, 45 (2) : 161 . |



