2. 400038 重庆,第三军医大学基础医学部医学遗传学教研室
2. Department of Medical Genetics, College of Basic Medical Sciences, Third Military Medical University, Chongqing, 400038, China
心血管疾病是世界范围内人类致残和过早死亡的主要原因之一,其基础病理是动脉粥样硬化。血管平滑肌细胞(vascular smooth muscle cells,VSMCs)是血管中的一种重要细胞,其迁移、增殖与许多心血管疾病密切相关,但是机制尚未完全弄清[1, 2]。流行病学调查结果发现雌激素与雌激素受体结合可以发挥保护血管的作用[3, 4],有研究发现动脉粥样硬化患者血中雌激素受体甲基化程度增加,但是两者因果关系尚不明确。随着表观遗传学的发展,有学者发现基因甲基化的改变与VSMCs增殖相关[5, 6]。我们及其他团队发现胰岛素成为心血管疾病又一新的危险因素[7, 8]。胰岛素与雌激素受体之间是否有一定关联尚不确定。本研究利用小鼠动脉粥样硬化模型及大鼠VSMCs,探讨胰岛素对小鼠血管病理改变的影响及其在致动脉粥样硬化过程中对雌激素受体α(estrogen receptor α,ER-α)表达调控的作用。
1 材料与方法 1.1 材料Apoe/Lepr基因双敲小鼠(购自The Jackson Laboratory),高表达ER-α慢病毒LV5-Esr1(Rat)NM_012689.1、空载病毒LV5NC(吉玛基因公司),大鼠VSMCs细胞株(第三军医大学基础医学部医学遗传学教研室保存),5-Aza-2′-deoxycytidine(Sigma公司,A3656-5MG),细胞培养用胰岛素(Roche公司,12284300),新生牛血清(哈里生物),DMEM高糖培养基(HyClone公司,SH30022.01B),TriPure Isolation Reagent(Roche公司,93956520),蛋白内参GAPDH(康成公司,KC-5G5),ER-α抗体(Merck Millipore公司,04-227),DNA甲基化转移酶3a(DNMT3a)抗体(Abnova公司,PAB19684),二抗(山羊抗兔IgG、兔抗山羊IgG,北京中杉公司),Allele in one mouse tail dectlysis buffer(Allele Biotechnology公司,MT10133),iTaqTM Universal SYBR Green Supermix(Bio-Rad公司,172- 5124),反转录试剂PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)(TaKaRa公司,RR047A)等。
1.2 方法 1.2.1 动物饲养与分组将8周龄的Apoe/Lepr基因双敲小鼠(不分性别)按随机数字表法分为2组,每组4只,分别给予以下处理:①高脂饮食(配方:1%胆固醇+5%高脂+94%基础饲料),每周5次腹腔注射生理盐水0.2 mL;②高脂饮食+胰岛素4 IU,每周给予胰岛素腹腔注射5次。小鼠在饲养3个月后取其腹主动脉,用4%多聚甲醛浸泡,4 ℃保存。饲养于第三军医大学中心实验室SPF级动物房,温度20~25 ℃,湿度40%~70 %,光照12 h/d,动物实验遵循《实验动物关怀和使用指导》要求。
1.2.2 HE染色及免疫组化将收集的血管标本梯度酒精脱色,石蜡包埋切片行HE染色,常规脱蜡和酒精水化后,苏木精染色5 min,水洗10 min,0.5 %盐酸酒精分色3~5 s,水洗10 min,伊红染色3 min,水洗10 min,37 ℃烘干后中性树脂封片。切片行ER-α及α-平滑肌肌动蛋白(smooth muscle actin-α,α-SMA)免疫组化染色,常规脱蜡和酒精水化,抗原修复后,0.3%Triton X-100孵育30 min,洗涤后与含有兔抗ER-α、α-SMA(1 ∶100)的一抗工作液4 ℃孵育过夜。漂洗后与生物泛素化的羊抗兔IgG(1 ∶200)37 ℃孵育2 h:漂洗后与SABC复合物37 ℃孵育1 h,漂洗后DAB显色,37 ℃烘干,苏木精复染,中性树脂封片。
1.2.3 细胞培养及分组大鼠VSMCs培养于含10%血清、1%抗生素的DMEM高糖培养基的完全培养基中,接种密度(1×104~2×104)/瓶,培养条件为37 ℃、5% CO2,使用胰岛素干预前用含1 %血清DMEM培养基饥饿处理12 h。分组:①对照组;②实验组1,用含完全培养基+胰岛素(1×10-7mol/L)处理;③实验组2,用含完全培养基+5-Aza(1×10-5mol/L)+胰岛素(1×10-7mol/L)处理。2个实验组处理24、48、72 h后,收集细胞进行检测。
1.2.4 RT-PCR检测TRIzol提取细胞总RNA,按照PrimeScript RT reagent Kit with gDNA Eraser说明书反转录合成cDNA。RT-PCR扩增引物序列如下:GAPDH(148 bp)上游引物:5′-TACCCACGGCAAGTTCAA-3′,下游引物:5′-GCCAGTAGACTCCACGACAT-3′;DNMT3a(259 bp)上游引物:5′-AAGGAAGTTTACACCGACAT-3′,下游引物:5′-TCTTACAGTTCTGGCACATT-3′;ER-α(276 bp)上游引物:5′-AGTGAAGCCTCAATGATGGG-3′,下游引物:5′-GAGCAAGTTAGGAGCAAACAG-3′。定量PCR反应体系总量为10 μL,包含0.5 μL cDNA,0.5 μL引物,5 μL SYBR green Master Mix,4 μL DEPC水。反应条件为:95 ℃预变性5 min;然后95 ℃ 10 s,58 ℃ 20 s,72 ℃ 30 s,40个循环;最后72 ℃延伸5 min。
1.2.5 Western blot检测收集细胞后,4 ℃预冷的PBS洗涤3次,加入120 μL含蛋白酶抑制剂的RIPA裂解液吹打并超声破碎细胞,加入30 μL 5×SDS-PAGE蛋白上样缓冲液后,煮沸8 min。蛋白上样进行SDS-PAGE电泳并转至PVDF膜上。将膜用3%的脱脂奶粉4 ℃封闭2 h后,分别放入含DNMT3a、ER-α、 GAPDH抗体中4 ℃孵育,PBST洗膜后加入辣根过氧化物酶标记的二抗,室温孵育,PBST洗膜后ECL显色曝光并测灰度值。
1.2.6 慢病毒感染培养瓶中接种VSMCs约1×104/瓶,次日换液后分别加入50 μL LV5-Esr1或LV5NC补足2 mL完全培养基,放入培养箱中培养,24 h后换液,72 h后观察荧光表达情况,收集细胞后进行下一步处理。
1.2.7 细胞增殖迁移检测收集细胞于Ep管中,PBS洗涤3次,70 %的乙醇重悬后-20 ℃过夜保存。上机前用PBS洗涤3次后PI染色,室温避光孵育后,流式细胞仪检测细胞周期。
将感染慢病毒的细胞接种至6孔板中(预先在6孔板背部划3条平行线),分为感染ER-α高表达病毒(阳性对照)组,感染空载病毒(阴性对照)组,未感染慢病毒(空白对照)组,细胞数为(1×104~2×104)/孔,培养24 h后,用1 mL枪头在每孔中画3条平行线(垂直于背部的3条平行线),用PBS清洗后,加入培养基,显微镜下拍照,培养24 h后,显微镜下拍照。
1.3 统计学分析采用SPSS 17.0统计软件,两两比较以秩和检验、独立样本t检验进行统计学分析,采用Quantity one、Image Pro Plus软件进行灰度分析。
2 结果 2.1 小鼠血管组织病理改变及ER-α、α-SMA蛋白表达小鼠给予腹腔注射胰岛素处理后,实验组与对照组比较,血糖[(8.9±2)vs(7.6±1.2)mmol/L]及体质量[(44.3±4.9)vs(49±4.2)g]差异无统计学意义(P>0.05)。将免疫组化结果细胞中细胞核ER-α染色程度按照等级资料分类统计及胞质中α-SMA染色使用Image Pro Plus统计后,与对照组比较,实验组VSMCs细胞核中ER-α蛋白及细胞质中α-SMA蛋白表达明显降低(76.13±39.16 vs 284.24±86.25,P<0.05,图 1)。HE染色结果显示:实验组血管中出现了明显的动脉粥样斑块,管壁增厚,细胞核走向紊乱(图 2)。
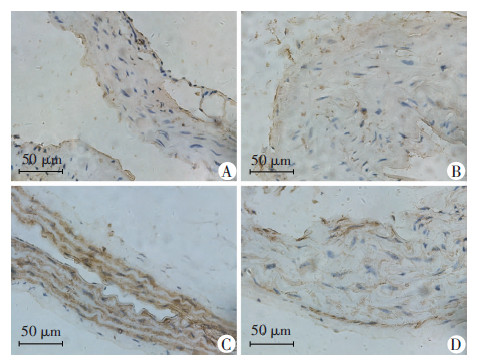 |
| A、B分别为对照组、实验组ER-α蛋白表达;C、D分别为对照组、实验组α-SMA蛋白表达图 1 免疫组化检测VSMCs中ER-α、α-SMA蛋白表达 (SABC) |
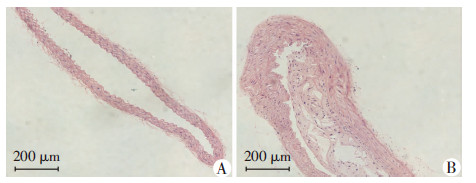 |
| A:对照组;B:实验组图 2 HE染色观察2组小鼠血管动脉粥样硬化的发生 |
随着胰岛素干预VSMCs时间的增加,ER-α的mRNA和蛋白表达都降低,胰岛素处理VSMCs后,ER-α的表达与对照组相比有降低,且差异有统计学意义(P<0.01);而DNMT3a的mRNA和蛋白表达都呈升高趋势,胰岛素处理VSMCs后,甲基化酶的表达与对照组相比升高,且差异有统计学意义(P<0.01),ER-α的表达与DNMT3a的表达呈现出明显的负相关性(图 3、4)。
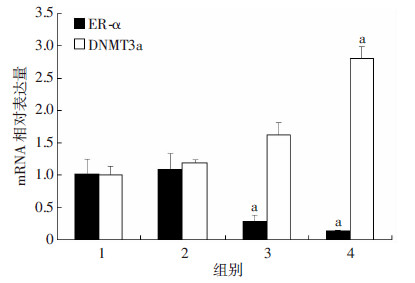 |
| 1:对照组;2:胰岛素干预24 h;3:胰岛素干预48 h;4:胰岛素干预72 h;a:P<0.01,与对照组比较图 3 RT-PCR检测胰岛素干预不同时间对VSMCs中ER-α、DNMT3a表达的影响 |
 |
| 1:对照组;2:胰岛素干预24 h;3:胰岛素干预48 h;4:胰岛素干预72 h A:Western blot检测;B:半定量分析 a:P<0.01,与对照组比较图 4 Western blot检测胰岛素干预不同时间对VSMCs中ER-α、DNMT3a表达的影响 |
单用5-Aza或胰岛素和5-Aza共同干预VSMCs时,ER-α mRNA和蛋白表达与对照组比较差异无统计学意义(P>0.05,图 5、6)。
 |
| 1:对照组;2:5-Aza干预72 h;3:胰岛素与5-Aza干预24 h;4:胰岛素与5-Aza干预48 h;5:胰岛素与5-Aza干预72 h 图 5 RT-PCR检测胰岛素与5-Aza干预不同时间对VSMCs中ER-α mRNA表达的影响 |
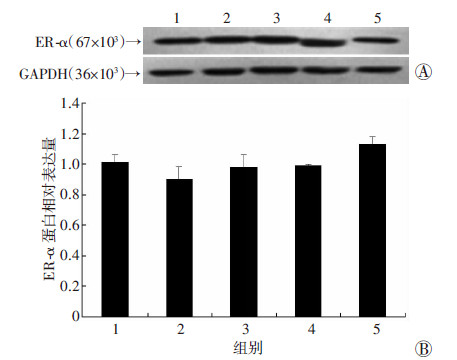 |
| 1:对照组;2:5-Aza干预72 h;3:胰岛素与5-Aza干预24 h;4:胰岛素与5-Aza干预48 h;5:胰岛素与5-Aza干预72 h A: Western blot检测;B:半定量分析图 6 Western blot检测胰岛素与5-Aza干预不同时间对VSMCs中ER-α蛋白表达的影响 |
慢病毒感染VSMCs后发出绿色荧光,其感染效率在90%以上(图 7)。流式细胞仪检测细胞周期结果(图 8)显示:感染ER-α高表达病毒组与空白对照组及感染空载病毒组相比,S期细胞数比例明显减低,且差异具有统计学意义(P<0.05)。划痕实验结果(图 9)示:感染ER-α高表达病毒组平滑肌细胞迁移能力明显低于空白对照组及感染空载病毒组。说明ER-α具有抑制细胞迁移、增殖的作用。
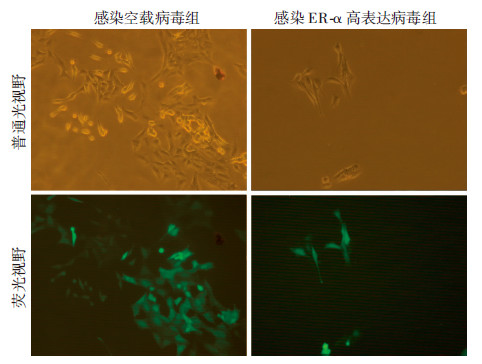 |
| 图 7 荧光显微镜下观察VSMCs慢病毒感染情况(×100) |
 |
| 1:空白对照组;2:感染空载病毒组;3:感染ER-α高表达病毒组;a:P<0.05,与空白对照组比较图 8 流式细胞仪检测ER-α对VSMCs增殖的影响 |
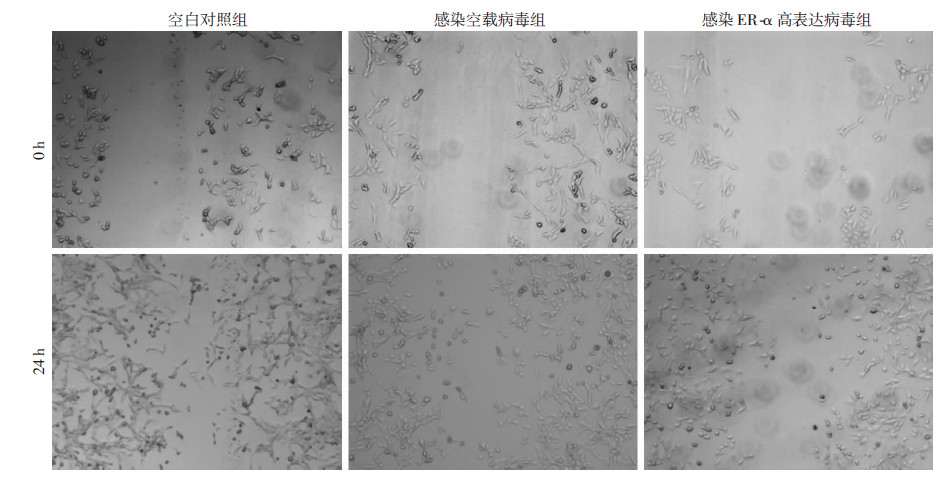 |
| 图 9 划痕实验检测ER-α对VSMCs迁移的影响 (×50) |
动脉粥样硬化是由多种细胞参与的复杂疾病,研究发现VSMCs表型转化是导致动脉粥样硬化的重要原因,世系追踪研究提出确切证据,成年动物的VSMCs保持显著的可塑性[9, 10],当遭遇血管损伤、细胞因子、生长因子或者疾病时可以进行可逆的表型转化[11],由收缩表型转化为合成分泌表型,这种可塑性的危害在于其表型转化受到环境因素的影响。
胰岛素作为一种生长因子及胞外环境,其维持血管平滑肌静默同时也适当的促进其迁移,通过测定α-SMA的含量可以判断VSMCs是收缩表型还是合成表型,因为α-SMA是收缩表型的标志,其在收缩表型VSMCs中高表达而在合成分泌表型VSMCs中低表达[11, 12]。本课题组的研究发现超生理剂量的胰岛素可促进VSMCs的表型转化,由分化的静止收缩表型去分化,转化为具有增殖迁移功能的合成分泌表型[13]。在合成分泌表型VSMCs的中常见有脂滴和髓样结构,其收缩功能降低而分泌功能亢进,导致血管舒张收缩功能异常,加速大中血管动脉粥样硬化斑块的形成与发展[14, 15]。
早期研究发现内源性雌激素具有降低心血管疾病危险的作用[16],但是随着人们对雌激素的关注,有人发出质疑的声音。有学者研究发现:绝经期后女性使用雌激素治疗并不能对心血管系统产生有利影响,相反会带来部分损害。在临床实践中,我们团队也发现:对绝经期的妇女给予服用雌激素替代品后可以达到一定的预防动脉粥样硬化的作用,当给予已经患有动脉粥样硬化的患者雌激素后,并不能治疗动脉粥样硬化。由于雌激素通过与雌激素受体结合发挥生物学效应,有学者提出假设:当动脉粥样硬化发生时,雌激素与雌激素受体之间的结合受到某种限制,只有早期使用雌激素治疗才能使雌激素充分与雌激素受体结合,发挥血管保护作用[17, 18]。
本研究结果表明:胰岛素可以使VSMCs表型发生转化,α-SMA表达下调,同时胰岛素通过上调DNA甲基化酶的表达,促使ER-α表达下调,使其抑制VSMCs增殖的能力减弱,进而使VSMCs增殖迁移能力增强,促进动脉粥样硬化的发生。后续研究中,我们将进一步探讨胰岛素如何促使VSMCs表型转化及ER-α如何调控细胞增殖及迁移,从而为预防动脉粥样硬化的发生提供实验依据,最终使心血管疾病患者受益。
| [1] | Adhikari N, Basi D L, Townsend D, et al. Heparan sulfate Ndst1 regulates vascular smooth muscle cell proliferation, vessel size and vascular remodeling[J]. J Mol Cell Cardiol, 2010, 49(2): 287-293. DOI:10.1016/j.yjmcc.2010.02.022 |
| [2] | Jia G, Cheng G, Gangahar D M, et al. Involvement of connexin 43 in angiotensin Ⅱ-induced migration and proliferation of saphenous vein smooth muscle cells via the MAPK-AP-1 signaling pathway[J]. J Mol Cell Cardiol, 2008, 44(5): 882-890. DOI:10.1016/j.yjmcc.2008.03.002 |
| [3] | Li Q Y, Chen L, Zhu Y H, et al. Involvement of estrogen receptor-β in farrerol inhibition of rat thoracic aorta vascular smooth muscle cell proliferation[J]. Acta Pharmacol Sin, 2011, 32(4): 433-440. DOI:10.1038/aps.2011.1 |
| [4] | Nevzati E, Shafighi M, Bakhtian K D, et al. Estrogen induces nitric oxide production via nitric oxide synthase activation in endothelial cells[J]. Acta Neurochir Suppl, 2015, 120: 141-145. DOI:10.1007/978-3-319-04981-6_24 |
| [5] | Valencia-Morales Mdel P, Zaina S, Heyn H, et al. The DNA methylation drift of the atherosclerotic aorta increases with lesion progression[J]. BMC Med Genomics, 2015, 8: 7. DOI:10.1186/s12920-015-0085-1 |
| [6] | Ning Y, Huang H, Dong Y, et al. 5-Aza-2′-deoxycytidine inhibited PDGF-induced rat airway smooth muscle cell phenotypic switching[J]. Arch Toxicol, 2013, 87(5): 871-881. DOI:10.1007/s00204-012-1008-y |
| [7] | Byrne C D, Targher G. Ectopic fat, insulin resistance, and nonalcoholic fatty liver disease: implications for cardiovascular disease[J]. Arterioscler Thromb Vasc Biol, 2014, 34(6): 1155 -1161. DOI:10.1161/ATVBAHA.114.303034 |
| [8] | Purnell J Q, Zinman B, Brunzell J D, et al. The effect of excess weight gain with intensive diabetes treatment on cardiovascular disease risk factors and atherosclerosis in type 1 diabetes mellitus: results from the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications Study (DCCT/EDIC) study[J]. Circulation, 2013, 127(2): 180-187. DOI:10.1161/CIRCULATIONAHA.111.077487 |
| [9] | Bentzon J F, Sondergaard C S, Kassem M, et al. Smooth muscle cells healing atherosclerotic plaque disruptions are of local, not blood, origin in apolipoprotein E knockout mice[J]. Circulation, 2007, 116(18): 2053-2061. |
| [10] | Alexander M R, Owens G K. Epigenetic control of smooth muscle cell differentiation and phenotypic switching in vascular development and disease[J]. Ann Rev Physiol, 2012, 74: 13-40. DOI:10.1146/annurev-physiol-012110-142315 |
| [11] | Owens G K, Kumar M S, Wamhoff B R. Molecular regulation of vascular smooth muscle cell differentiation in development and disease[J]. Physiol Rev, 2004, 84(3): 767-801. DOI:10.1152/physrev.00041.2003 |
| [12] | Sobue K, Hayashi KI, Nishida W. Expressional regulation of smooth muscle cell-specific genes in association with phenotypic modulation[J]. Mol Cell Biochem, 1999, 190(1/2): 105-118. |
| [13] | 王旭开,王燕,何作云,等. 胰岛素对大鼠血管平滑肌细胞表型的影响[J]. 第二军医大学学报, 2003, 24(10): 1090-1094. |
| [14] | Chakrabarti S, Morton J S, Davidge S T. Mechanisms of estrogen effects on the endothelium: an overview[J]. Can J Cardiol, 2014, 30(7): 705-712. DOI:10.1016/j.cjca.2013.08.006 |
| [15] | von-der-Thusen J H, Borensztajn K S, Moimas S, et al. IGF-1 has plaque-stabilizing effects in atherosclerosis by altering vascular smooth muscle cell phenotype[J]. Am J Pathol, 2011, 178(2): 924-934. DOI:10.1016/j.ajpath.2010.10.007 |
| [16] | dos Santos R L, da Silva F B, Ribeiro R F, et al. Sex hormones in the cardiovascular system[J]. Hormone molecular biology and clinical investigation. 2014, 18(2): 89-103. DOI:10.1515/hmbci-2013-0048 |
| [17] | Clarkson T B, Appt S E. Controversies about HRT: lessons from monkey models[J]. Maturitas, 2005, 51(1): 64-74. DOI:10.1016/j.maturitas.2005.02.016 |
| [18] | Kim G H, Ryan J J, Archer S L. The role of redox signaling in epigenetics and cardiovascular disease[J]. Antioxid Redox Signal, 2013, 18(15): 1920-1936. DOI:10.1089/ars.2012.4926 |



