2. 400038 重庆,第三军医大学西南医院:神经外科;
3. 400038 重庆,第三军医大学西南医院:临床心理科
2. Department of Neurosurgery ;
3. Department of Clinical Psychology, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
躯体形式障碍(somatoform disorders,SFD)目前尚无确切定义,国际疾病分类法第十版(international classification of diseases version 10,ICD-10)和美国精神疾病诊断与统计手册第4版(diagnostic and statistical manual for mental disorders version Ⅳ,DSM-Ⅳ)将医学上不能解释的躯体化症状归类为躯体形式障碍部分[1]。其主要特征是患者持久地担心或相信躯体化症状,不断要求予以医学检查,即使检查结果阴性或者临床医师反复说明并无躯体病变基础,仍不能缓解患者的担心和躯体化症状。SFD患者反复求医行为不仅严重影响自身与家人的生活、学习、工作,还造成家庭巨大经济负担和社会医疗资源浪费,而目前各项常用影像学检查往往未发现阳性结果,国内外有关躯体形式障碍的影像学研究较少[2],能够在活体状态下检测大脑的功能磁共振成像(functional magnetic resonance imaging ,fMRI)研究为SFD的诊断提供了新的影像学检查方法。
低频振幅(amplitude of low frequency fluctuation,ALFF)作为静息态功能磁共振成像(resting-state functional magnetic resonance imaging,rs-fMRI)的分析方法之一,从能量的角度反映大脑神经元自发活动的强度[3],已在儿童注意缺陷多动障碍(attention deficit hyperactivity disorder,ADHD)[4, 5]、创伤后应激障碍[6, 7]、强迫症[5, 6, 7]、癫痫[8]、精神分裂症[9]等神经精神疾病的研究中得到验证。大量文献提示SFD患者可能存在大脑神经元自发活动的改变,ALFF技术作为脑功能局部活动强度指标,可以很好地反映大脑自发活动改变。所以本研究拟运用基于低频振幅算法的fMRI技术对SFD患者的脑功能进行研究,与健康对照进行对比,观察SFD患者脑功能信号变化,寻找SFD患者的特征性脑功能改变,探讨SFD患者神经生理基础特点。
1 资料与方法 1.1 临床资料 1.1.1 研究对象招募2014年6月至2015年6月在我院心理科门诊初次就诊,并由两名从事5年以上临床工作的心理科专业医生确诊为躯体形式障碍的患者21例(SFD组),其纳入标准:①符合美国精神疾病诊断与统计手册第4版修订版(DSM-Ⅳ-IR)躯体形式障碍的诊断标准;②未行正规心理及药物治疗;③简易精神状态检查表(minimum mental state examination ,MMSE)评分>24分;④蒙特利尔认知评估量表(montreal cognitive assessment,MoCA)评分<26分; 年龄在18~70岁,受教育程度在5年以上,均为右利手。同时社会招募年龄、性别、受教育水平、利手与SFD组相匹配的正常对照(normal control ,NC)组21例(表 1)。排除标准:①脑外伤、出血、梗死、神经退行性疾病、肿瘤以及重大躯体疾病;②其他神经症性障碍如焦虑、惊恐障碍或强迫症、抑郁症、精神分裂症、偏执性精神病;③酒精药物依赖史以及精神病史;④磁共振检查禁忌证;⑤未取得知情同意或正在参加其他临床试验的受试者。本研究在我院伦理委员会审查并通过,所有受试者在参与试验前签署知情同意书。
| 组别 | 性别(例) | 年龄(岁,x±s) | 受教育年限(年,x±s) | 病程(月,x±s) | MMSE评分(分, x±s) | MoCA评分(分, x±s) | SCL-90评分(分, x±s) | |
| 男 | 女 | |||||||
| SFD组 | 9 | 12 | 38.86±13.17 | 9.81±4.16 | 55.57±79.67 | 26.67±0.73 | 20.90±1.48 | 220.86±29.56 |
| NC组 | 9 | 12 | 39.33±11.22 | 10.90±4.37 | - | 28.90±0.70 | 27.29±0.78 a | - |
| a: P<0.05,与SFD组比较 | ||||||||
由两名从事5年以上临床工作的心理科专业医师完成。该量表主要用于反映有躯体疾病患者和精神病人的心理症状,是当前使用最为广泛的精神障碍和心理疾病门诊检查量表。包括90个条目,共9个分量表,采取 5级评分标准,因子分超过2分为阳性,说明可能存在心理障碍。
1.2 MR数据采集采用3.0T磁共振成像系统(Trio Tim system; Siemens,Erlangen,Germany),标准正交头颅线圈,使用专用无磁耳机、橡皮耳塞降噪,海绵垫固定头部。详细告知受试者实验流程及注意事项,叮嘱受试者保持清醒并闭眼,扫描过程中尽量克服头动,扫描时关闭检查室及核磁体腔内灯光。首先采集T1WI、T2WI及FLAIR图像以排除脑器质性病变及神经退行性改变;然后采集静息态功能成像数据,通过平面回波成像序列,轴位扫描,具体参数为TR 2 000 ms,TE 30 ms,层厚3 mm,无层间距,共36层,240个时间点,翻转角90°,视野192 mm×192 mm,矩阵64×64,体素大小3 mm×3 mm×3 mm;3D-T1WI结构像通过三维磁化准备快速梯度回波序列采集,矢状位扫描,具体参数为TR 1 900 ms,TE 2.52 ms,层厚1 mm,层间距1/3 mm,层数176,翻转角9°,视野256 mm×256 mm,矩阵256×256,体素大小1 mm×1 mm×1 mm。
1.3 MR数据处理MR原始数据的预处理在MATLAB(version 2012a; The MathWorks,Inc.,Riddick,MA,USA)操作平台下,采用基于SPM8(http://www.fil.ion.ucl.ac.uk/spm/)的静息态数据处理助手软件DPARSF v2.3(http://www.restfmri.net/forum/DPARSF)[10]完成,具体步骤如下:将DICOM格式的原始数据转化为NIFTI格式,剔除每名受试者静息态数据前10个扫描时间点,然后依次进行时间校正,头动校正,采用DARTEL算法进行空间标准化,去线性漂移。头动位移>2 mm或者角度>2°的受试者被排除。预处理后的数据经全宽半高6 mm高斯平滑核进行平滑,然后计算ALFF值,最后完成低频滤波(频段0.01~0.08 Hz),去除头动参数、脑白质和脑脊液等协变量的影响。
1.4 统计学分析 1.4.1 临床资料统计使用SPSS软件(version 22.0;IBM SPSS,Inc.,Chicago,IL,USA)对两组受试者的年龄、受教育水平、MMSE及MoCA评分行两独立样本t检验,对性别行χ2检验。SFD组病程及SCL-90行描述性统计。
1.4.2 ALFF统计采用REST1.8[11]自带统计分析软件对两组受试者的ALFF map行单样本t检验和两样本t检验,并采用AlphaSim(P<0.01,体素数>40)进行多重比较校正。其中单样本t检验与全脑均值1做比较,得到ALFF值显著高于全脑均值的脑区;两样本t检验得到两组间ALFF值存在显著差异的脑区。
1.4.3 相关性分析提取SFD组ALFF值存在显著差异的脑区的时间序列信号与病程、SCL-90量表评分做Pearson相关分析,与MoCA量表评分做Spearman相关分析,由SPSS(version 22.0; IBM SPSS,Inc.,Chicago,IL,USA)软件完成。
2 结果 2.1 一般资料SFD组与NC组受试者在年龄、性别、受教育程度及MMSE评分均无统计学差异(P>0.05),MoCA评分存在统计学差异(P<0.05)。
2.2 ALFF结果比较单样本t检验显示,SFD组腹内侧前额叶(ventromedial prefrontal cortex,VMPFC)、前扣带皮层(anterior cingulated cortex,ACC)、脑干、小脑等脑区的ALFF值显著高于全脑平均水平,颞叶、中央前后回等脑区的ALFF值显著低于全脑平均水平,结果由rest view呈现(图 1)。两组受试者的两样本t检验显示:SFD组较NC组ALFF值增高的脑区:双侧前额叶、双侧前扣带回;SFD组较NC组ALFF值降低的脑区:右侧颞叶颞中回、左侧岛叶颞岛交界区、左侧旁中央小叶双侧中央后回(表 2)。结果由Brainnet Viewer(http://www.nitrc.org/projects/bnv/)呈现(图 2)。
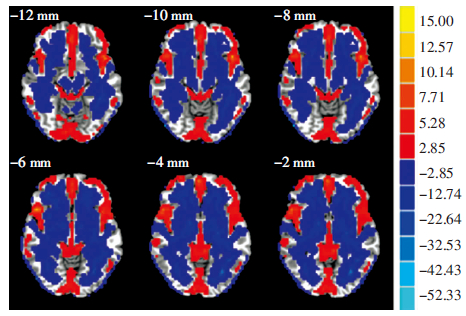
|
| 红色代表ALFF增高区域,颜色越往上近黄色ALFF增高越明显;蓝色代表ALFF减低区域,颜色越往下近绿色ALFF降低越明显 图 1 rest view显示SFD组较全脑平均水平ALFF值有差异的脑区 (P<0.01,AlphaSim校正) |
| 脑区 | MNI | t | 体素数 | BA分区 | ||
| X | Y | Z | ||||
| 右侧腹内前额叶皮层 | 24 | 48 | 3 | 4.01 | 157 | BA11
BA46 |
| 左侧腹内前额皮层 | -16 | 46 | 1 | 4.66 | 201 | BA11 |
| 右侧前扣带皮层 | 9 | 31 | 16 | 4.21 | 76 | BA24
BA32 |
| 左侧前扣带皮层 | -13 | 41 | 20 | 4.8 | 98 | BA32 |
| 右侧颞叶颞中回 | 48 | -63 | 6 | -4.16 | 53 | BA37 |
| 左侧岛叶颞岛交界区 | -36 | -30 | 18 | -4.55 | 61 | BA48 |
| 左侧旁中央小叶 | -3 | -21 | 66 | -4.21 | 1 385 | BA4 |
| 左侧中央后回 | -42 | -23 | -56 | -3.48 | 304 | BA3 |
| 右侧中央后回 | 52 | -8 | 33 | -2.25 | 217 | BA3 |
| MNI:Montreal Neurological Institute; BA为Brodmann分区; AlphaSim校正,P<0.01 | ||||||

|
| 红色代表ALFF增高区域,颜色越往右近红色ALFF增高越明显;蓝色代表ALFF减低区域,颜色越往左近蓝色ALFF降低越明显; A:双侧前额叶;B:双侧前扣带回;C:右颞中回;D:左岛叶颞岛交界区;E:左侧旁中央小叶;F:左侧中央后回;G:右侧中央后回 图 2 braime viewer显示与NC组比较SFD组ALFF值有显著差异的脑区(P<0.01,AlphaSim校正) |
SFD组MoCA评分与左侧腹内侧前额叶呈显著负相关(r=-0.564,P=0.008),SCL-90评分与左侧岛叶ALFF值呈显著负相关(r=-0.505,P=0.020),病程与右侧颞叶ALFF值呈显著负相关(r=-0.514,P=0.017)。病程、MMSE、MoCA、SCL-90评分与其他脑区的ALFF值未见显著相关性。
3 讨论SFD临床表现复杂,发病机制尚未完全阐明,各学科对该病的研究进程缓慢。近年来,神经影像学技术为探索SFD发病机制提供了可能[12]。采用fMRI技术对阿尔茨海默病[13]、焦虑症[14]、转换障碍[15]等疾病研究,已经成功探测到了多个脑区的异常活动,而对SFD的研究及文献报道较少。
本研究中SFD组ALFF值增高的脑区包括:双侧前额叶、双侧前扣带回。这些脑区和默认模式网络脑区(default mode network,DMN)有高度的重叠性,提示SFD患者存在高级认知功能损伤。所有ALFF值增高的脑区中,双侧前额叶增加的体素最大。额叶在人脑的学习记忆、情绪处理等认知功能中起着重要的作用[16]。当把额叶分为前内侧、背外侧以及后侧三部分时,腹内侧前额叶与前扣带皮层在解剖关系上联系密切。本研究中双侧VMPFC在静息状态下ALFF值增高,提示大脑神经元自发活动增强,可能与VMPFC、ACC等脑区协同作用加强学习记忆以及处理负性情绪的能力有关。以往研究表明,躯体形式障碍患者随着病程的发生发展,各项认知功能均有不同程度的损伤,本研究中SFD组MoCA评分与左侧VMPFC呈显著负相关关系,这一结果也进一步证实了VMPFC在SFD认知损害发生过程中的重要代偿作用。
前扣带皮层是认知控制网络的重要节点[16],认知控制网络主要由背侧前额叶皮层、扣带回前部组成,主要执行冲突监测功能,属于高级认知功能[17]。本研究中双侧背外侧前扣带皮层(dACC)的ALFF值增高,可能与SFD患者认知损伤导致前扣带皮层代偿性加强认知功能以及降低错误反应冲突相关。以往研究表明,前扣带皮层除了涉及认知控制和冲突监测功能以外,还参与痛觉信息加工[18]、移情共情[19]等任务,我们推测本研究中双侧dACC自发性活动增强还与SFD患者长期疼痛以及共情缺失相关。
本研究中ALFF值降低脑区有:右侧颞叶颞中回、左侧岛叶、左侧旁中央小叶及双侧中央后回。右侧颞叶颞中回、梭状回以及左侧岛叶是边缘系统的重要组成部分,涉及记忆存储[13]、语言编码[20]、躯体感觉处理[21]等功能。岛叶是大脑第五叶,在解剖关系上,与扣带回额叶、部分顶叶、部分颞叶、基底核、背侧丘脑相连,在躯体感觉、运动、语言编码等方面发挥着关键作用。SFD患者普遍伴有躯体疼痛的临床症状,左侧岛叶ALFF值降低说明岛叶等躯体感觉处理脑区的神经元自发活动被抑制。SCL-90评分与左侧岛叶ALFF值呈显著负相关,这也证实了SFD患者处理躯体感觉的脑岛功能受限,疼痛得不到功能脑区有效的处理,导致患者长久的感觉疼痛不适。本研究中右侧颞叶ALFF值与病程呈显著负相关,提示随着SFD的发生、发展,颞叶的记忆存储、语言编码等认知功能逐渐受到损害,并且这种损害随着病程进展而加重。
综上所述,ALFF技术有效地反映了躯体形式障碍患者存在的广泛的脑功能异常活动改变,发生改变的脑区包括前额叶、前扣带回皮层、颞叶、岛叶,涉及认知控制、冲突监测、情绪处理、记忆存储、语言编码、躯体感觉处理等功能脑区,这些异常脑活动可部分阐述躯体形式障碍的神经生理基础,为进一步探讨躯体形式障碍发生、发展的神经机制提供了新的参考依据。
| [1] | Hilderink P H, Collard R, Rosmalen J G, et al. Prevalence of somatoform disorders and medically unexplained symptoms in old age populations in comparison with younger age groups: a systematic review[J]. Ageing Res Rev, 2013, 12(1): 151-156. DOI: 10.1016/j.arr.2012.04.004 |
| [2] | 孙达亮, 施慎逊. 躯体形式障碍神经影像学研究进展[J]. 精神医学杂志, 2013, 26(5): 394-396. DOI: 10.3969/j.issn.1009-7201.2013.05.025 |
| [3] | Yang H, Long X Y, Yang Y, et al. Amplitude of low frequency fluctuation within visual areas revealed by resting-state functional MRI[J]. Neuroimage, 2007, 36(1): 144-152. DOI: 10.1016/j.neuroimage.2007.01.054 |
| [4] | Zang Y F, He Y, Zhu C Z, et al. Altered baseline brain activity in children with ADHD revealed by resting-state functional MRI[J]. Brain Dev, 2007, 29(2): 83-91. DOI: 10.1016/j.braindev.2006.07.002 |
| [5] | Brem S, Grunblatt E, Drechsler R, et al. The neurobiological link between OCD and ADHD[J]. Atten Defic Hyperact Disord, 2014, 6(3): 175-202. DOI: 10.1007/s12402-014-0146-x |
| [6] | Cisler J M, Steele J S, Lenow J K, et al. Functional reorganization of neural networks during repeated exposure to the traumatic memory in posttraumatic stress disorder: an exploratory fMRI study[J]. J Psychiatr Res, 2014, 48(1): 47-55. DOI: 10.1016/j.jpsychires.2013.09.013 |
| [7] | Bing X, Ming-Guo Q, Ye Z, et al. Alterations in the cortical thickness and the amplitude of low-frequency fluctuation in patients with post-traumatic stress disorder[J]. Brain Res, 2013, 1490: 225-232. DOI: 10.1016/j.brainres.2012.10.048 |
| [8] | Zhang Z, Lu G, Zhong Y, et al. fMRI study of mesial temporal lobe epilepsy using amplitude of low-frequency fluctuation analysis[J]. Hum Brain Mapp, 2010, 31(12): 1851-1861. DOI: 10.1002/hbm.20982 |
| [9] | Hoptman M J, Zuo X N, Butler P D, et al. Amplitude of low-frequency oscillations in schizophrenia: a resting state fMRI study[J]. Schizophr Res, 2010, 117(1): 13-20. DOI: 10.1016/j.schres.2009.09.030 |
| [10] | Chao-Gan Y, Yu-Feng Z. DPARSF: A MATLAB Toolbox for “Pipeline” Data Analysis of Resting-State fMRI[J]. Front Syst Neurosci, 2010, 4: 13. DOI: 10.3389/fnsys.2010.00013 |
| [11] | Song X W, Dong Z Y, Long X Y, et al. REST: a toolkit for resting-state functional magnetic resonance imaging data processing[J]. PLoS One, 2011, 6(9): e25031. DOI: 10.1371/journal.pone.0025031 |
| [12] | Browning M, Fletcher P, Sharpe M. Can neuroimaging help us to understand and classify somatoform disorders? A systematic and critical review[J]. Psychosom Med, 2011, 73(2): 173-184. DOI: 10.1097/PSY.0b013e31820824f6 |
| [13] | Wang Z, Yan C, Zhao C, et al. Spatial patterns of intrinsic brain activity in mild cognitive impairment and Alzheimer's disease: a resting-state functional MRI study[J]. Hum Brain Mapp, 2011, 32(10): 1720-1740. DOI: 10.1002/hbm.21140 |
| [14] | Peterson A, Thome J, Frewen P, et al. Resting-state neuroimaging studies: a new way of identifying differences and similarities among the anxiety disorders[J]. Can J Psychiatry, 2014, 59(6): 294-300. |
| [15] | Burke M J, Ghaffar O, Staines W R, et al. Functional neuroimaging of conversion disorder: the role of ancillary activation[J]. Neuroimage Clin, 2014, 6: 333-339. DOI: 10.1016/ j.nicl.2014.09.016 |
| [16] | Li W, Qin W, Liu H, et al. Subregions of the human superior frontal gyrus and their connections[J]. Neuroimage, 2013, 78: 46-58. DOI: 10.1016/j.neuroimage.2013.04.011 |
| [17] | Nomura E M, Gratton C, Visser R M, et al. Double dissociation of two cognitive control networks in patients with focal brain lesions[J]. Proc Natl Acad Sci USA, 2010, 107(26): 12017-12022. DOI: 10.1073/pnas.1002431107 |
| [18] | Zeidan F, Martucci K T, Kraft R A, et al. Brain mechanisms supporting the modulation of pain by mindfulness meditation[J]. J Neurosci, 2011, 31(14): 5540-5548. DOI: 10.1523/JNEUROSCI. 5791-10.2011 |
| [19] | Takeuchi H, Taki Y, Nouchi R, et al. Association between resting-state functional connectivity and empathizing/systemizing [J]. Neuroimage, 2014, 99: 312-322. DOI: 10.1016/j.neuroimage. 2014.05.031 |
| [20] | Kong A P, Abutalebi J, Lam K S, et al. Executive and language control in the multilingual brain[J]. Behav Neurol, 2014, 2014: 527951. DOI: 10.1155/2014/527951 |
| [21] | Stephani C, Fernandez-Baca-Vaca G, Maciunas R, et al. Functional neuroanatomy of the insular lobe[J]. Brain Struct Funct, 2011, 216(2): 137-149. DOI: 10.1007/s00429-010-0296-3 |



