2. 400037 重庆,第三军医大学新桥医院:急诊科 ;
3. Department of Chemistry, Purdue University, West Lafayette, IN 47907, USA
2. Department of Emergency, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037, China ;
3. Department of Chemistry, Purdue University, West Lafayette, IN 47907, USA
肺动脉高压(pulmonary arterial hypertension,PAH)是一种以肺血管压力增高为主要特征的临床综合征,在各种损伤因素的长期作用下,肺血管的内膜、中膜及外膜细胞增殖,管壁增厚,并有血管周围炎症及局部血栓形成,最终导致肺血管腔狭窄,肺动脉压力增高。它的持续发展会导致一系列的心肺疾病,包括慢性阻塞性肺疾病(COPD)、肺源性心脏病等,其最终结果会导致右心负荷增加,右心衰竭甚至死亡[1]。肺血管重构是肺动脉高压最重要的病理基础[2],以往的研究表明,肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells, PASMCs)的异常增殖和凋亡失衡在肺血管重构中发挥关键作用[3],并且近来的研究证实,自噬对哺乳动物细胞具有强大的调控机制,自噬在肺血管疾病发病机制中扮演重要作用[4],并且自噬缺乏与衰老、肿瘤、神经退行性病变、炎症、动脉粥样硬化等多种疾病相关[5]。那么通过自噬调控PASMCs的增殖进而逆转肺血管重构,是治疗PAH、COPD、肺心病的一个重要方向。
哺乳动物雷帕霉素蛋白(mammalian target of rapamycin,mTOR),一种丝氨酸/苏氨酸蛋白激酶,是细胞应对生理条件及环境压力时调控自噬及生长的关键成分。研究表明,mTOR激活可以抑制细胞自噬,促进其增殖[6],这些都表明了以mTOR作为靶点是治疗上述心肺疾病的新策略。而纳米载体因其转染效率高、低毒等特点被广泛应用于基因靶向治疗中。本实验旨在通过构建能够高效转载mTOR小干扰RNA的新型核酸纳米载体,将其转入肺动脉平滑肌细胞,观察纳米载药系统的转染效率,并研究其对肺动脉平滑肌细胞自噬和增殖的作用。
1 材料与方法 1.1 主要试剂SD大鼠由第三军医大学实验动物中心提供,胎牛血清(美国GIBCO公司),高糖DMEM(美国Hyclone公司),Opti-MEM(美国Invitrogen公司),0.25%胰蛋白酶(美国Hyclone公司),DAPI染色液(中国江苏碧云天生物技术研究所),X-tremeGENE siRNA转染试剂(瑞士罗氏公司),Cyto-ID®Green自噬染色试剂盒(美国Enzo Life Sciences公司),细胞总蛋白提取试剂盒M-PER Mammalian Protein ExtractionReagent(Thermo fishe公司),兔抗大鼠p-mTOR、LC3B多克隆抗体及β-actin单克隆抗体(美国Cell Signaling Technology公司),辣根酶标记山羊抗兔IgG(北京中杉金桥生物技术有限公司)。
1.2 方法 1.2.1 DNA寡核苷酸、mTOR小干扰RNA (siRNA)的设计与合成DNA序列由计算机程序SEQUIN设计[7],DNA序列如下:mT-2A:5′-AGTACTTGTCAT-GTACCAGCTGCTGTTAGAGATTGAAGGACGGAATA-3′;mT-1A3:5′-TTCAATCTCTATCATTCCGTCCTTCAATC-TCTATCATTCCGTCCTTCAATCTCTATCATTCCGTCC-3′。在GenBank上检索到mTOR mRNA的序列,设计mTOR siRNA序列1:5′-AAGGCAGATTTGCCAACTATCTATAGT-3′,序列2:5′-GGATCCTAATACGACTCACTATAGGCA-3′,序列3:5′-CAGCAGCUGGUACAUGACAAGUACUUU-3′,该序列在5′端用Cy3红色荧光标记。各序列均由上海生物工程有限公司合成。
1.2.2 自组装携带mTOR小干扰RNA的核酸纳米材料(siRNA-NPs)将mTOR siRNA、mT-2A和mT-1A3的冻干干粉2 000 r/min 4℃离心5 min,分别加DEPC水稀释为0.2μg/μL,混匀;按mTOR siRNA、mT-2A和mT-1A3的摩尔比为3∶3∶1合成纳米材料。取mTOR siRNA溶液加入等体积的mT-2A溶液,放入90℃水浴中室温自然冷却至37℃,随后加入相应体积的mT-1A3溶液,充分混匀,37℃水浴30 min,室温下放置30 min,4℃放置20 min,得到携带mTOR siRNA的自组装核酸纳米材料。按上述步骤,不添加mTOR siRNA溶液则得到单纯的自组装纳米材料。
1.2.3 RPASMCs的培养RPASMCs从雄性SD大鼠肺动脉中分离得到,鉴定及培养的具体方法参照文献[8],将RPASMCs培养于含青霉素100 U/mL、链霉素100 U/mL、10%胎牛血清的高糖DMEM培养基中,置于条件为37℃、5%CO2的细胞培养箱中传代培养,选用第4~10代细胞用于实验。
1.2.4 实验分组本实验分4组:核酸纳米材料携带的mTOR siRNA组(siRNA-NPs组)、单纯纳米材料组(NPs组)、单独的siRNA组和空白对照组。
1.2.5 核酸纳米材料携带的mTOR siRNA转染RPASMCs转染前1 d将RPASMCs分别接种覆有盖玻片的24孔细胞培养板,每孔8×103个细胞。倒置显微镜下观察细胞生长情况,待培养板中细胞约60%~70%融合时开始转染。按照罗氏公司推荐的X-tremeGENE siRNA转染试剂操作说明制备转染混合液。以Opti-MEM稀释转染试剂及各实验组。siRNA-NPs组转染终浓度以siRNA计算为50 nmol/L,NPs组加入等量的单纯纳米载体,单独的siRNA组加入50 nmol/L的siRNA,空白对照组只加入等量培养液。置于37℃、5% CO2细胞培养箱中继续培养24 h。
1.2.6 激光共聚焦观察RPASMCs对核酸纳米材料携带的mTOR siRNACy3的摄取各实验组转染RPASMCs 24 h,用0.01 mol/L PBS洗涤细胞后,加入4%多聚甲醛500μL室温固定20 min,吸出固定液后用PBS洗涤3次,每次3 min,小心夹取出盖玻片,滴加DAPI 50μL染核,避光染色5 min,PBS洗涤5次,每次3 min,抗荧光淬灭封片剂封片,用激光共聚焦显微镜观察细胞摄取siRNACy3的情况。Image-Pro Plus 10.0软件对图像进行荧光半定量分析。
1.2.7 RT-PCR检测mTOR mRNA的表达采用TRNZOL提取细胞总RNA,使用核酸蛋白检测仪测定纯度并定量,光密度D(260)/D(280)比值均在1.9左右。依据RT-PCR试剂盒说明进行逆转录和扩增,引物由捷瑞生物工程有限公司合成。设计总反应体系为50μL,其中Premix Taq酶25μL,模板RNA 3μL,上下游引物各2μL,灭菌DEPC水18μL。mTOR上游引物: 5′-CGCAGGGAAGGTGATGAGGAAT-3′,下游引物: 5′-GCTAAGGAGCAGCCAGGGAGAT-3′,扩增产物片段长度为195 bp。β-actin上游引物: 5′-TCAGGTCATCACTATCGGCAAT-3′,下游引物: 5′-AAAGAAAGGGTGTCGCA-3′,扩增产物片段长度为432 bp。扩增条件为:94℃5 min预变性;94℃变性40 s,54℃退火30 s,72℃延伸45 s,35个循环;72℃后延伸10 min。1%琼脂糖凝胶电泳分离PCR产物,采用自动电泳凝胶成像分析仪进行图像扫描和分析。
1.2.8 Western blot检测p-mTOR、LC3B蛋白的表达取各实验组细胞,加细胞蛋白裂解液提取总蛋白,置于冰上裂解约20 min后,用细胞刮收集细胞于灭菌EP管中,4℃12 000 r/min离心10 min,取上清用核酸蛋白检测仪测蛋白浓度,调整蛋白浓度体积一致,加入5×Loadingbuffer,煮沸10 min变性。分离p-mTOR、LC3B蛋白分别采用8%、12%分离胶,5%浓缩胶进行SDS-PAGE凝胶电泳。p-mTOR转膜条件为300 mA湿转300 min,LC3B转膜条件为300 mA湿转60 min。转膜后将PVDF膜置于5%脱脂奶粉室温封闭2 h,然后置于5%脱脂奶粉稀释的p-mTOR及LC3B一抗(1∶500)中4℃孵育过夜,次日用TBST漂洗3次,每次10 min,放入5℅脱脂奶粉稀释的辣根过氧化物酶标记山羊抗兔IgG(1∶5 000)抗体中室温孵育1h,TBST漂洗5次,每次5 min,ECL化学发光法显色,以β-actin内参蛋白进行校正。用QuantiScan软件对条带进行光密度值分析,将目标条带与β-actin条带的光密度值之比作为其蛋白表达水平的参数。
1.2.9 激光共聚焦观察核酸纳米材料携带的mTOR siRNA对RPASMCs自噬的影响各实验组转染RPASMCs 24 h。按照Cyto-ID®Green自噬染色试剂盒操作说明制备染色混合培养液,转染结束前30 min,用PBS轻轻洗涤细胞后,加入Cyto-ID®Green自噬染色混合培养液,置于37℃、5%CO2细胞培养箱中避光孵育30 min。然后取出培养板,用PBS轻轻洗涤细胞1次,用4%多聚甲醛500μL室温固定20 min,吸出固定液后用PBS洗涤3次,每次3 min,小心夹取出盖玻片,滴加DAPI 50μL染核,避光染色5 min,PBS洗涤5次,每次3 min,抗荧光淬灭封片剂封片,用激光共聚焦显微镜观察细胞自噬的情况。Image-Pro Plus 10.0软件对图像进行荧光半定量分析。
1.2.10 透射电镜观察携带mTOR siRNA的核酸纳米材料处理RPASMCs后的细胞超微结构及自噬小体将各组细胞转染48 h后,终止培养,加入0.25%的胰蛋白酶消化细胞,离心,用PBS洗涤细胞2次,之后加入2.5%戊二醛固定,4℃过夜,送检。
1.2.11 MTT法测定RPASMCs的生长抑制率将RPASMCs以每孔1×103个细胞接种于96孔培养板中,终体积200μL,每组设5个复孔,置于孵箱(37℃、5%CO2)中培养24 h后进行细胞转染。各组转染48 h后每孔加入5 mg/mL的MTT溶液20μL,继续孵育4 h,然后仔细吸弃培养孔内上清液,每孔加入150μL DMSO,振荡溶解10 min,酶标仪490 nm波长测定各孔光密度[D(490)]值,以无细胞,但添加等量培养液并相同处理的空白对照孔调零。实验重复3次。细胞生长抑制率=[1-实验组D(490)值/空白对照组D(490)值]×100%。
1.2.12 3H-TdR掺入法检测RPASMCs的增殖将RPASMCs胰酶消化后用含10%FBS的DMEM培养基制备细胞悬液,以1×105个/孔的密度将细胞接种于48孔培养板中,置于孵箱(37℃、5%CO2)中培养,直到细胞长至80%的融合度时,换用1%FBS的DMEM培养基培养16 h后进行转染,各组转染48 h结束培养,在结束培养前8 h,每孔加入10μCi 3H-TdR,终止培养后,吸弃上层清液,用预冷的PBS洗涤2次,加入0.25%的胰蛋白酶消化细胞,收集细胞并采用液体闪烁计数器测定其脉冲数。实验重复3次。
1.3 统计学处理使用SPSS 17.0统计软件对数据进行分析,各实验至少重复3次,计量资料以x+s表示,多组间均数比较行单因素方差分析,两组均数间比较用配对t检验。
2 结果 2.1 mTORsiRNA对PASMCs靶蛋白mTOR mRNA的抑制情况结果显示序列3 siRNA处理组中mTOR mRNA表达显著低于NC siRNA组和空白对照组(P < 0.05),序列1 siRNA处理组和序列2 siRNA处理组与空白对照组和NC siRNA组比较mTOR mRNA表达有所下降,但差异无统计学意义。空白对照组和NC siRNA组mTOR mRNA的表达无统计学差异(图 1)。

|
| 1:空白对照组;2:NCsiRNA组;3:序列1转染组;4:序列2转染组;5:序列3转染组;a:P < 0.05,与空白对照组比较;b:P < 0.05,与单独NC siRNA组比较 图 1 RT-PCR检测各组RPASMCs靶蛋白mTOR mRNA的表达 |
2.2 PASMCs对siRNA-NPs-Cy3的摄取情况
图中细胞质中呈颗粒状均匀分布的红色荧光代表被PASMCs摄入胞内的siRNA-NPs-Cy3,在转染12 h后,siRNA-NPs组的红色荧光显著强于单独的siRNA组,而空白对照组、NPs组均未见红色荧光颗粒,提示siRNA-NPs组中Cy3红色荧光标记的mTOR siRNA被核酸纳米材料高效的转运到RPASMCs内(图 2A)。荧光密度半定量分析结果与激光共聚焦图一致(图 2B)。

|
| 1:空白对照组;2:NPs组;3:单独siRNA组;4:siRNA-NPs组A:各组细胞摄取mTOR siRNACy3的激光共聚焦图像;B:荧光密度半定量分析结果;a:P < 0.05,与空白对照组比较;b:P < 0.05,与单独siRNA组比较 图 2 激光共聚焦观察RPASMCs内siRNA-NPs的摄取情况 |
2.3 siRNA-NPs对RPASMCs的mTOR、p-mTOR、LC3B的表达影响
结果显示siRNA-NPs组中mTOR mRNA及p-mTOR蛋白的表达显著低于单独的siRNA组、NPs组和空白对照组(P < 0.05),空白对照组和NPs组的两者表达无统计学差异(图 3A、B)。与此同时,siRNA-NPs组中LC3BⅡ/Ⅰ蛋白的表达显著高于单独的siRNA组、NPs组和空白对照组(P < 0.05),空白对照组和NPs组LC3BⅡ/Ⅰ蛋白的表达无统计学差异(图 3C、D)。

|
| A:mTOR mRNA的RT-PCR检测结果;B:RT-PCR半定量分析结果;C: p-mTOR、LC3B蛋白Western blot检测结果; D:Western blot半定量分析结果; M:DNA标准(100~600 bp);1:空白对照组;2:NPs组;3:单独siRNA组;4:siRNA-NPs组;a:P < 0.05,与空白对照组比较;b:P < 0.05,与单独siRNA组比较 图 3 RT-PCR及Western blot检测各组RPASMCs的mTOR、p-mTOR、LC3B的表达 |
2.4 siRNA-NPs对RPASMCs自噬的影响
细胞质中呈颗粒状均匀分布的绿色荧光是标记自噬小体的蛋白,其荧光强弱代表了自噬水平的高低。siRNA-NPs组细胞质中可见大量标记自噬小体的绿色荧光,且荧光强度显著高于单独的siRNA组、空白对照组和NPs组(P < 0.05),此外空白对照组、NPs组可见低水平的绿色荧光,提示RPASMCs在正常生理条件下自噬水平较低,而核酸纳米材料携带的mTOR siRNA则明显诱导细胞自噬(图 4A)。荧光密度半定量分析结果与激光共聚焦图一致(图 4B)。
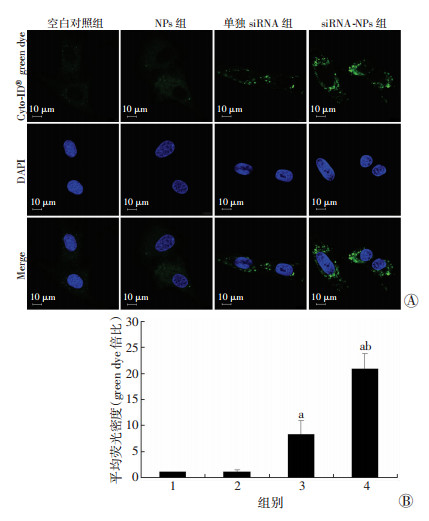
|
| 1:空白对照组;2:NPs组;3:单独siRNA组;4:siRNA-NPs组A:各组Cyto-ID® Green dye标记的细胞自噬的激光共聚焦图像;B:荧光密度半定量分析结果;a:P < 0.05,与空白对照组比较;b:P < 0.05,与单独siRNA组比较 图 4 激光共聚焦观察各组对RPASMCs自噬的影响 |
2.5 RPASMCs各组细胞超微结构及自噬小体的变化
电镜图显示,空白对照组的细胞质中仅见见少量双层膜环绕的空泡状结构,即典型的自噬体或自噬溶酶体结构, 而siRNA-NPs处理后RPASMCs中的自噬小体明显多于空白对照组(P < 0.05,图 5)。提示核酸纳米材料携带的mTOR siRNA能明显诱导细胞自噬小体形成(图 5)。
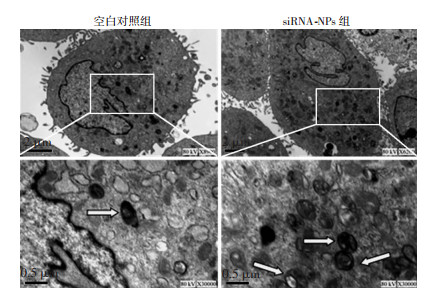
|
| 下排图为线框区局部放大观察,白色箭头标示典型的自噬小体结构 图 5 透射电镜观察mTOR siRNA对RPASMCs超微结构及自噬小体的影响 |
2.6 siRNA-NPs对RPASMCs的活性及增殖的影响
MTT结果显示空白对照组的生长抑制率为(1.10±0.85) %,NPs组抑制率为(2.50±1.90) %,单独siRNA组抑制率为(19.60±1.98) %,siRNA-NPs组抑制率为(50.90±1.67) %。siRNA-NPs组和单独siRNA组细胞生长抑制率显著高于其他各组(P < 0.01),siRNA-NPs组细胞生长抑制率又显著高于单独siRNA组(P < 0.01),NPs组和空白对照组细胞生长抑制率无统计学差异。同时,3H-TdR结果显示与空白对照组比较,siRNA-NPs组和单独的siRNA组的3H-TdR摄入量明显下降,分别降至80%、52%(P < 0.01),说明mTOR siRNA处理RPASMCs后明显抑制其增殖。且siRNA-NPs组摄入量又显著低于单独的siRNA组(P < 0.01),NPs组和空白对照组摄入量无统计学差异(图 6)。

|
| 1:空白对照组;2:NPs组;3:单独siRNA组;4:siRNA-NPs组;a: P < 0.01,与空白对照组比较;b: P < 0.01,与单独siRNA组比较 图 6 3H-TdR检测各组对RPASMCs生长抑制的情况 |
3 讨论
小干扰RNA可高效特异地抑制靶基因,实现靶基因的表达下调,在疾病的基因治疗中显示出巨大的应用前景[9]。其发挥作用的关键在于小干扰RNA本身的沉默效应以及能否高效转染细胞,但RNA分子对核酸酶高度不稳定,半衰期短;聚阴离子性质致其不易被摄取;同时其电荷密度导致其充分水化,不易与一些蛋白相互作用而被迅速清除,这些性质导致小干扰RNA稳定性差,不易被细胞摄取[10]。因此,我们需要一个稳定、高效的基因装载体系来解决这些问题。而随着纳米技术的发展,通过DNA编程自组装纳米结构作为运载体来实现基因的高效运输。DNA最大的优势在于相对于RNA更稳定,与其他的药物传递材料相比,核酸自组装纳米制剂一般具有以下优点[11-12]:生物相容性高;合成简单,操作性强;能够缓控释放;毒性低;易被标记等。
本研究运用一种新型的自组装核酸纳米材料携带mTOR小干扰RNA转染RPASMCs,显著下调mTOR mRNA及蛋白的表达,增强细胞自噬水平,进而抑制RPASMCs的增殖。表明自组装核酸纳米材料携带的mTOR小干扰RNA,两者形成稳定的运载体系,小干扰RNA在核酸纳米载体的保护下,不易聚集且不易被血浆中的各种酶降解;且核酸纳米结构分子量小,易被细胞摄入,能够高效的转染进入RPASMCs,并在其胞浆内稳定释放发挥生物学效应。相对于单独小干扰RNA,由核酸纳米载体运载的小干扰RNA能够更多地进入细胞内,有效的下调靶蛋白mTOR表达,诱导细胞自噬,引起自噬性细胞死亡,抑制RPASMCs的增殖。本实验证实了自噬调控药物作为治疗PAH的重要作用,并且提供了一个安全、高效、稳定的载药体系,为肺高压等心肺疾病的治疗提供实验基础。
哺乳动物雷帕霉素靶蛋mTOR信号通路是调节细胞自噬、增殖、凋亡的中心环节[13],研究发现在低氧肺动脉高压小鼠模型肺组织及低氧下人PASMCs中mTORC1较正常显著增高[14];mTORC2通过AMPK调控肺血管平滑肌细胞的增殖和存活,下调mTORC2能诱导平滑肌细胞凋亡,抑制其增殖[15]。说明mTOR治疗PAH的重要靶点,抑制其表达或活性,能明显抑制平滑肌细胞增殖,这些实验均证实我们结果的有效性和可靠性。
综上所述,本课题研究的核酸自组装纳米材料具有天然、非免疫原性、低毒等优越性,其携带的mTOR小干扰RNA能够被RPASMCs高效摄取,显著下调靶蛋白mTOR的表达,从而诱导RPASMCs的自噬,抑制细胞的增殖。这种新型材料结合靶蛋白mTOR小干扰RNA载药系统有望成为治疗肺动脉高压肺血管重构的新靶点。
| [1] | Huisman A M, Vreugdenhil S A, van-Paassen H C. Treatment of pulmonary arterial hypertension[J]. N Engl J Med,2005, 352 (3) : 308 –309. DOI:10.1056/NEJM200501203520322 |
| [2] | Ryan J J, Marsboom G, Archer S L. Rodent models of group 1 pulmonary hypertension[J]. Handb Exp Pharmacol,2013, 218 : 105 –149. DOI:10.1007/978-3-642-38664-0_5 |
| [3] | Baliga R S, MacAllister R J, Hobbs A J. New perspectives for the treatment of pulmonary hypertension[J]. Br J Pharmacol,2011, 163 (1) : 125 –140. DOI:10.1111/j.1476-5381.2010.01164.x |
| [4] | Mizushima N, Komatsu M. Autophagy: renovation of cells and tissues[J]. Cell,2011, 147 (4) : 728 –741. DOI:10.1016/j.cell.2011.10.026 |
| [5] | Yang Z, Klionsky D J. Mammalian autophagy: core molecular machinery and signaling regulation[J]. Curr Opin Cell Biol,2010, 22 (2) : 124 –131. DOI:10.1016/j.ceb.2009.11.014 |
| [6] | Jung C H, Ro S H, Cao J, et al. mTOR regulation of autophagy[J]. FEBS Lett,2010, 584 (7) : 1287 –1295. DOI:10.1016/j.febslet.2010.01.017 |
| [7] | Seeman N C, Mao C, Yan H. Guest editorial: nucleic acid nanotechnology[J]. Acc Chem Res,2014, 47 (6) : 1643 –1644. DOI:10.1021/ar500159g |
| [8] | Yin H, Li Q, Qian G, et al. Rab1 GTPase regulates phenotypic modulation of pulmonary artery smooth muscle cells by mediating the transport of angiotensin II type 1 receptor under hypoxia[J]. Int J Biochem Cell Biol,2011, 43 (3) : 401 –408. DOI:10.1016/j.biocel.2010.11.010 |
| [9] | Lares M R, Rossi J J, Ouellet D L. RNAi and small interfering RNAs in human disease therapeutic applications[J]. Trends Biotechnol,2010, 28 (11) : 570 –579. DOI:10.1016/j.tibtech.2010.07.009 |
| [10] | Leuschner F, Dutta P, Gorbatov R, et al. Therapeutic siRNA silencing in inflammatory monocytes in mice[J]. Nat Biotechnol,2011, 29 (11) : 1005 –1010. DOI:10.1038/nbt.1989 |
| [11] | Li J, Fan C, Pei H, et al. Smart drug delivery nanocarriers with self-assembled DNA nanostructures[J]. Adv Mater,2013, 25 (32) : 4386 –4396. DOI:10.1002/adma.201300875 |
| [12] | Chou L Y, Zagorovsky K, Chan W C. DNA assembly of nanoparticle superstructures for controlled biological delivery and elimination[J]. Nat Nanotechnol,2014, 9 (2) : 148 –155. DOI:10.1038/nnano.2013.309 |
| [13] | Guertin D A, Sabatini D M. Defining the role of mTOR in cancer[J]. Cancer Cell,2007, 12 (1) : 9 –22. DOI:10.1016/j.ccr.2007.05.008 |
| [14] | Wang W, Liu J, Ma A, et al. mTORC1 is involved in hypoxia-induced pulmonary hypertension through the activation of Notch3[J]. J Cell Physiol,2014, 229 (12) : 2117 –2125. DOI:10.1002/jcp.24670 |
| [15] | Goncharov D A, Kudryashova T V, Ziai H, et al. Mammalian target of rapamycin complex 2(mTORC2) coordinates pulmonary artery smooth muscle cell metabolism, proliferation, and survival in pulmonary arterial hypertension[J]. Circulation,2014, 129 (8) : 864 –874. DOI:10.1161/CIRCULATIONAHA.113.004581 |



