炎症性肠病(inflammatory bowel disease,IBD)是一种特殊的慢性肠道炎症性疾病,包括克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)。UC以局限于结肠黏膜及黏膜下层的炎症为特征,并伴随着肠道免疫失衡的一种自身免疫性疾病[1]。目前针对UC的治疗主要包含传统的水杨酸制剂及一部分新研发的生物制剂,但传统药物长期服用存在较多毒副作用,且患者依从性差,新研发的药物虽然效果较好毒副作用较小,但是针对我国大多数且需要长期服药的患者而言经济压力大,难以大范围推广。因此, 在我国传统中药成分中寻求经济实惠、效果好、毒副作用小的药物来治疗炎症性肠病具有非常重要的意义。姜黄素橙黄色结晶粉末,味稍苦,不溶于水,是从姜科、天南星科植物的根茎中提取,含姜黄3%~6%,是植物界中少有含二酮的色素,为二酮类化合物。姜黄素在治疗炎症性肠病的临床报道已确认其疗效[2],但具体机制尚不明确。有研究报道姜黄素可以通过抑制肠道上皮中STAT3信号通路改善小鼠炎症性肠病[3],通过调控结肠组织中P38MAPK表达缓解DSS诱导的小鼠溃疡性结肠炎[4],通过调节肠道微生物菌群缓解炎症反应[5],但目前关于姜黄素对肠道免疫的调节尚不清楚。
肠上皮间淋巴细胞(intestinal intraepithelial lymphocytes,IEL)位于肠上皮细胞基底层内。肠道的IEL主要分为两大亚群,一种为诱导型IEL或者称为a型黏膜T细胞,表达CD4+或CD8α+的TCRαβ;另一群为天然型IEL或称b型黏膜T细胞,主要为CD8αα+或CD8αα-的TCRγδ和TCRαβ,在维持肠道稳态中扮演着重要角色[6-7],比如可以直接对抗侵入肠道的病原菌、预防炎症性肠病的发生和维持肠道功能的完整[8]。本实验室前期的葡聚糖硫酸钠(dextran sulphate sodium,DSS)诱导的小鼠UC模型显示IEL亚群比例及活化的明显改变[9];在小鼠小肠急性缺血再灌注模型(ischemia reperfusion,IR)下,小肠IEL的亚群及功能发生了明显的变化[10];同样在肠道IR患者标本中也检测到肠道天然免疫处于一个过分激活的状态[11]。以上研究表明IEL细胞的功能和亚群比例失调与肠道炎症的严重程度具有明显的相关性。本实验通过DSS诱导小鼠结肠形成的UC模型,探讨姜黄素对小鼠UC模型中结肠IEL亚群的变化的影响,阐述其缓解UC的可能机制,以期为姜黄素在治疗炎症性肠病中的应用提供依据。
1 材料与方法 1.1 材料与试剂DSS购自美国Biosharp公司,姜黄素、台盼蓝购自Sigma公司(由二甲亚砜溶解),Percoll淋巴细胞分离液购自美国Santa Cruz公司,胎牛血清和1640培养基购自美国Gibco公司,邻联甲苯胺、乙二胺四乙酸(EDTA)和二硫苏糖醇(DTT)购自武汉博士德生物工程公司,IEL分离缓冲液(含有190 mg EDTA,80 mg DTT 1×PBS液),流式细胞染色缓冲液(含有1% 胎牛血清、0.1% 叠氮钠的1×PBS),流式抗体anti-mouse CD45-percp-cy5.5、anti-mouse CD8α-APC、anti-mouse CD8β-FITC、anti-mouse CD4-PE、anti-mouse TCRβ-APC、anti-mouse TCRγ/δ-FITC购自美国BD公司(由北京达科为生物公司代理),磁力加热搅拌器购自上海江心仪器有限公司。
1.2 实验动物模型构建及分组60只C57BL/6雄性小鼠,6~8周龄,体质量(23±2)g,由第三军医大学实验动物中心提供。按随机数字表法分为3组(n=20):正常组(按照动物房的环境正常 喂养)、DSS组(含有3% DSS的饮用水喂养7 d)和DSS+ 姜黄素组(喂养3% DSS 2 d后,3% DSS+80 mg/mL 姜黄素继续喂养5 d)。
1.3 方法 1.3.1 小鼠DAI评分及结肠组织标本采集每天观察及记录小鼠的体质量及大便情况,疾病活动程度指数(DAI)=(体质量减轻率分数+粪便性状分数+隐血程度分数)/3[12],见表 1。7 d后处死小鼠,取结肠组织进行HE染色,观察结肠损伤情况。
| 计分 | 体质量下降(%) | 粪便性状 | 便血情况 |
| 0 | 无 | 正常 | 阴性 |
| 1 | 1~5 | + | |
| 2 | 6~10 | 半稀便 | ++ |
| 3 | 11~15 | +++ | |
| 4 | >15 | 稀便 | ++++ |
| 正常大便:成形颗粒样便;半稀便:糊状或半成形不黏肛便;稀便:水样黏肛便 | |||
1.3.2 粪便隐血判断
向标本中先滴加邻联甲苯胺,后滴加2%过氧化氢,观察是否变为蓝色,如呈蓝色则该标本隐血阳性。
1.3.3 小鼠结肠组织的IEL细胞分离对各实验组小鼠采取1%的戊巴比妥钠麻醉后,采用颈椎脱臼术处死,取出各组小鼠结肠(每次5~6只小鼠结肠聚集分离IEL)放入盛满RPMI1640的培养皿中,然后纵行剖开结肠洗净肠腔的内容物洗涤重复3次直至清洁,用眼科剪将结肠剪碎至每小段0.5 cm长,将碎肠段放入事先预热的IEL分离缓冲液60 mL(含10%胎牛血清)的烧杯中,在37 ℃的环境中搅拌30 min,然后以带有尼龙毛的20 mL的注射器过滤掉结肠碎块,经过5 min 1 500 r/min离心,留沉淀加入40% Percoll 15 mL,2 200 r/min离心22 min,留沉淀加入20 mL RPMI1640培养基,1 500 r/min离心5 min洗涤各管,沉淀即为IEL细胞,通过台盼蓝染色观察,分离出的IEL存活率超过95%。
1.3.4 流式细胞术检测向分离出的IEL细胞沉淀中加入流式缓冲液,缓慢吹散细胞沉淀,然后取洁净的2.0 mL Ep管数只,加入吹散的细胞悬液,每管100 μL,编号向细胞悬液加入一定量的流式抗体吹散 混匀,避光置于20 ℃室温孵育30 min,然后 用流式细胞染色缓冲液洗涤每管3次,每次洗涤液量为300 μL,最后将洗净的细胞悬浮在300 μL的流式缓冲液中,待上机检测(CD45阳性为IEL设门检测各个细胞亚群),流式细胞仪由第三军医大学新桥医院中心实验室提供,型号为贝克曼MoFlo购自美国贝克曼公司。
1.4 统计学方法计量资料以x±s表示,采用SPSS 17.0统计软件,不同组别之间的比较采用单因素方差分析。检验水准α=0.05。
2 结果 2.1 小鼠DAI评分变化与正常组比较,DSS组前3 d情况平稳,体质量从第4~7天出现大幅度下降,活动量明显减少,出现稀便、血便等,DAI评分明显升高(P <0.01);DSS+姜黄素治疗组体质量也相对下降但其趋势较平缓,稀便、血便程度较DSS组明显偏轻且DAI评分明显低于DSS组(P <0.05,图 1)。
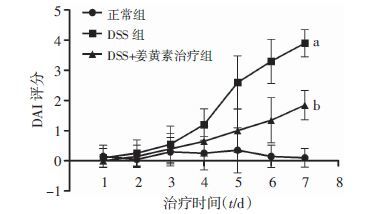
|
| a:P <0.01,与正常组比较;b:P <0.05,与DSS组比较 图 1 各组小鼠的DAI评分变化情况 |
2.2 小鼠结肠黏膜组织学病理改变
正常组小鼠结肠黏膜完整、轮廓清晰,且肠道上皮连续,肠上皮细胞和腺体排列规整,细胞下基质、血管正常;DSS组结肠黏膜完整性极差、断裂、裂解且分离、水肿明显,肠上皮空泡状的杯状细胞减少,黏膜下基层中出现大量的炎性细胞浸润;DSS+姜黄素治疗组结肠黏膜尚完整、无断离、裂解、脱离,黏膜下基质浸润的淋巴细胞较少(图 2)。
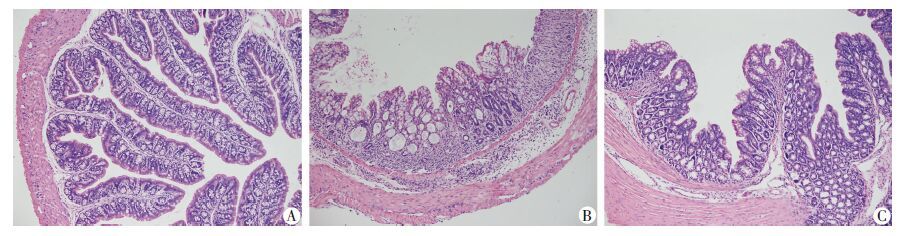
|
| A: 正常组; B:DSS组; C: DSS+姜黄素治疗组 图 2 各组小鼠结肠组织病理学改变 (HE ×200) |
2.3 小鼠结肠IEL亚群CD8αα和CD8αβ的变化
与正常组比较,DSS组CD8αα亚群明显降低(P <0.01),CD8αβ明显升高(P <0.01);DSS+姜黄素治疗组结肠的CD8αα亚群比例明显高于DSS组(P <0.01),CD8αβ的比例较DSS组明显降低(P <0.01,图 3、表 2)。
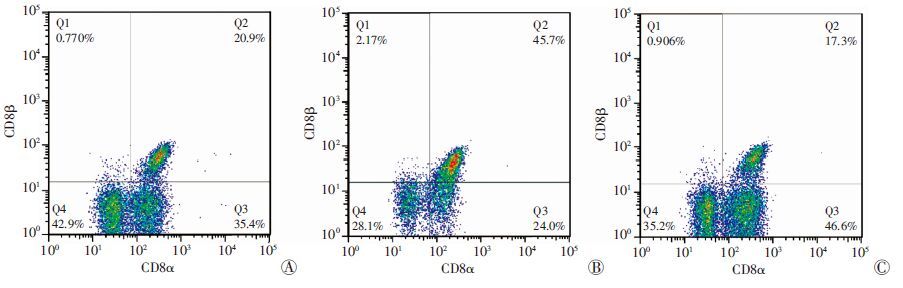
|
| A:正常组;B:DSS组;C:DSS+姜黄素治疗组 图 3 流式细胞术检测各组小鼠结肠IEL中CD8分型 |
| 组别 | CD8αα | CD8αβ | CD4 | TCRαβ | TCRγδ |
| 正常组 | 37.53±2.30 | 20.30±1.40 | 9.14±0.43 | 78.37±1.57 | 10.83±1.90 |
| DSS组 | 26.73±2.90a | 45.50±1.70b | 14.80±2.20a | 80.94±0.22 | 5.38±0.43b |
| DSS+姜黄素治疗组 | 43.47±2.70d | 17.67±3.36d | 10.56±0.86c | 74.24±2.10c | 13.73±0.50d |
| a:P <0.05,b:P <0.01,与正常组比较;c:P <0.05,d:P <0.01,与DSS组比较 | |||||
2.4 小鼠结肠IEL亚群CD4的改变
与正常组对比,DSS组CD4+ T细胞亚群比例明显升高(P <0.05);DSS+姜黄素治疗组的CD4+ T细胞亚群低于DSS组(P <0.05,图 4、表 2)。
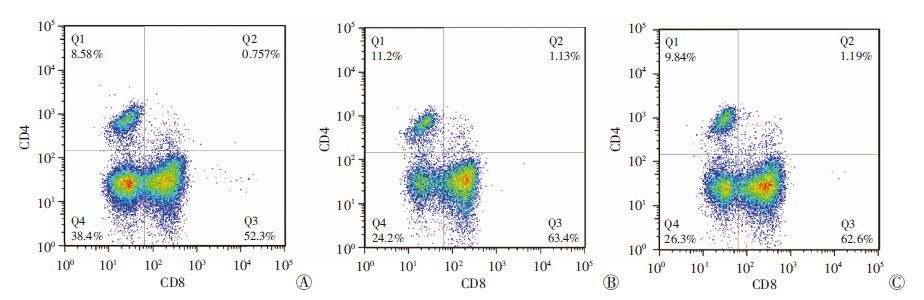
|
| A:正常组;B:DSS组;C:DSS+姜黄素治疗组 图 4 流式细胞术检测各组小鼠结肠IEL中CD4分型 |
2.5 TCRαβ和TCRγδ细胞亚群变化
与正常组比较,DSS组的TCRγδ亚群比例明显降低(P <0.01),而DSS+姜黄素治疗组显著高于DSS组(P <0.01);DSS组和正常组中TCRαβ亚群比例差 异无统计学意义(P>0.05),而DSS+姜黄素治疗组中TCRαβ亚群比例较DSS组低(P <0.05,图 5、表 2)。
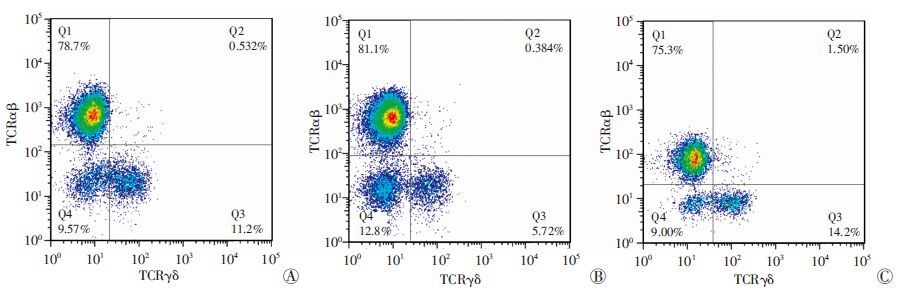
|
| A:正常组;B:DSS组;C:DSS+姜黄素治疗组 图 5 流式细胞术检测各组小鼠结肠IEL中TCRγδ分型 |
3 讨论
UC主要以腹泻、腹痛、血便伴里急后重为主要临床症状,病变部位主要为结、直肠的黏膜及黏膜下层,且病情迁延不愈。目前UC的明确病因尚未详细阐述,但是病理检测和实验模型证明免疫系统的异常表现是造成肠道炎症和组织损伤的重要因素[13]。当前针对UC治愈难度大,其病情漫长,有癌变倾向,被全世界公认为现代难治病之一。治疗UC的传统药物长期服用副作用较大,近年开发的生物制剂等价格昂贵,不利于广泛运用于临床,因此寻找不良反应小、经济实惠的药物意义重大。
结合IEL在肠道炎症中所扮演的重要角色和姜黄素能够缓解相关炎症,本实验通过构建小鼠DSS溃疡性结肠炎模型,深入研究了姜黄素对肠道IEL亚群的影响。本实验中DSS+姜黄素治疗组小鼠的结肠炎症从DAI评分、结肠外观、HE染色三方面观察均得到明显缓解。本实验发现姜黄素对DSS诱导的IEL变化有显著影响:姜黄素治疗组CD8αα和TCRγδ细胞亚群明显增高,CD8αβ、CD4和TCRαβ细胞亚群明显减少。CD8αβ为细胞毒性T细胞,其功能为促进炎症破坏。无论是DSS诱导的小鼠UC模型,还是小鼠小肠IR模型,CD8αβ都显著增加[9-10]。本实验发现姜黄素能够显著地降低该细胞亚群的比例。CD8αα在炎症中的作用已有报道,发现在脓毒血症的小鼠模型中通过注射外源性的谷氨酸处理后,该细胞分群比例增加,其可以通过产生IL-10促进肠上皮的修复[14]。CD4细胞亚群在大多数炎症相关模型中升高明显[15],大量研究报道其可以产生诸如TNF-α、IFN-γ等炎症介质加速炎症破坏[11]。有趣的是我们通过姜黄素处理,CD4细胞亚群降低,同时伴随肠道黏膜炎症损伤的改善。TCRγδ在正常小鼠结肠中占IEL的10%左右[16],TCRγδ不仅可以通过直接清除入侵肠屏障的病原体,还可以通过产生KGF直接参与肠上皮的更新[17]。在TCRγδ细胞敲除老鼠溃疡性结肠炎模型中表现为更严重的结肠破坏并且伴有更高的死亡率[18]。本研究发现姜黄素处理能够使TCRγδ维持在一个相对高的比例,使其发挥重要的保护功能。
本实验发现姜黄素对DSS诱导的小鼠UC有显著的改善作用,并结合肠道的细胞免疫发现了姜黄素对肠道IEL的亚群有着明显的调控作用。在DSS诱导的溃疡性结肠炎模型中姜黄素主要通过维持CD8αα细胞亚群和TCRγδ IEL亚群稳定进一步维持肠道黏膜屏障的完整。虽然此研究发现了姜黄素对IEL有调节作用但未涉及具体的信号通路研究,接下来我们将通过具体的分子信号来解释姜黄素的调控作用,为其临床应用奠定可靠的基础。
| [1] | Shih D Q, Targan S R. Immunopathogenesis of inflammatory bowel disease[J]. World J Gastroenterol,2008, 14 (3) : 390 –400. DOI:10.3748/wjg.14.390 |
| [2] | Lang A, Salomon N, Wu J C, et al. Curcumin in Combination With Mesalamine Induces Remission in Patients With Mild-to-Moderate Ulcerative Colitis in a Randomized Controlled Trial[J]. Clin Gastroenterol Hepatol,2015, 13 (8) : 1444 –1449. DOI:10.1016/j.cgh.2015.02.019 |
| [3] | Yang J Y, Zhong X, Yum H W, et al. Curcumin Inhibits STAT3 Signaling in the Colon of Dextran Sulfate Sodium-treated Mice[J]. J Cancer Prev,2013, 18 (2) : 186 –191. DOI:10.15430/JCP.2013.18.2.186 |
| [4] | 何双艳, 李珏宏, 李昌平, 等. 姜黄素对DSS诱导的溃疡性结肠炎小鼠p38MAPK表达的影响[J]. 实用医学杂志,2014, 30 (4) : 539 –541. DOI:10.3969/j.issn.1006-5725.2014.04.012 |
| [5] | McFadden R M, Larmonier C B, Shehab K W, et al. The Role of Curcumin in Modulating Colonic Microbiota During Colitis and Colon Cancer Prevention[J]. Inflamm Bowel Dis,2015, 21 (11) : 2483 –2494. DOI:10.1097/MIB.0000000000000522 |
| [6] | Qiu Y, Yang Y, Yang H. The unique surface molecules on intestinal intraepithelial lymphocytes: from tethering to recognizing[J]. Dig Dis Sci,2014, 59 (3) : 520 –529. DOI:10.1007/s10620-013-2933-1 |
| [7] | Cheroutre H, Lambolez F, Mucida D. The light and dark sides of intestinal intraepithelial lymphocytes[J]. Nat Rev Immunol,2011, 11 (7) : 445 –456. DOI:10.1038/nri3007 |
| [8] | Lord J D. Promises and paradoxes of regulatory T cells in inflammatory bowel disease[J]. World J Gastroenterol,2015, 21 (40) : 11236 –11245. DOI:10.3748/wjg.v21.i40.11236 |
| [9] | Ji T, Xu C, Sun L, et al. Aryl Hydrocarbon Receptor Activation Down-Regulates IL-7 and Reduces Inflammation in a Mouse Model of DSS-Induced Colitis[J]. Dig Dis Sci,2015, 60 (7) : 1958 –1966. DOI:10.1007/s10620-015-3632-x |
| [10] | Qiu Y, Yu M, Yang Y, et al. Disturbance of intraepithelial lymphocytes in a murine model of acute intestinal ischemia/reperfusion[J]. J Mol Histol,2014, 45 (2) : 217 –227. DOI:10.1007/s10735-013-9544-1 |
| [11] | Egan C E, Maurer K J, Cohen S B, et al. Synergy between intraepithelial lymphocytes and lamina propria T cells drives intestinal inflammation during infection[J]. Mucosal Immunol,2011, 4 (6) : 658 –670. DOI:10.1038/mi.2011.31 |
| [12] | Murthy S, Cooper H S, Yoshitake H, et al. Combination therapy of pentoxifylline and TNFalpha monoclonal antibody in dextran sulphate-induced mouse colitis[J]. Aliment Pharmacal Ther,1999, 13 (2) : 251 –260. DOI:10.1515/pjs-2015-0075 |
| [13] | Edelblum K L, Singh G, Odenwald M A, et al. γδ Intraepithelial lymphocyte migration limits transepithelial pathogen invasion and systemic disease in mice[J]. Gastroenterology,2015, 148 (7) : 1417 –1426. DOI:10.1053/j.gastro.2015.02.053 |
| [14] | Tung J N, Lee W Y, Pai M H, et al. Glutamine modulates CD8αα(+) TCRαβ(+) intestinal intraepithelial lymphocyte expression in mice with polymicrobial sepsis[J]. Nutrition,2013, 29 (6) : 911 –917. DOI:10.1016/j,nut.2013.01.001 |
| [15] | 乾灿, 王勇, 匡梅, 等. 羌活二黄汤对大鼠佐剂性关节炎的疗效及其机制[J]. 第三军医大学学报,2016, 38 (3) : 307 –313. DOI:10.16016/j.1000-5404.201509066 |
| [16] | Chodaczek G, Papanna V, Zal M A, et al. Body-barrier surveillance by epidermal γδ TCRs[J]. Nat Immunol,2012, 13 (3) : 272 –282. DOI:10.1038/ni.2240 |
| [17] | Cai Y J, Wang W S, Yang Y, et al. Up-regulation of intestinal epithelial cell derived IL-7 expression by keratinocyte growth factor through STAT1/IRF-1, IRF-2 pathway[J]. PLoS One,2013, 8 (3) : e58647 . DOI:10.1371/journal.pone.0058647 |
| [18] | Chen Y, Chou K, Fuchs E, et al. Protection of the intestinal mucosa by intraepithelial γδ T cells[J]. Proc Natl Acad Sci U S A,2002, 99 (22) : 14338 –14343. DOI:10.1073/pnas.212290499 |



