急性肾损伤(acute kidney injury,AKI)是临床上常见的危重症。重症AKI患者的死亡率高达40%~60%,有的甚至需要终身肾脏替代治疗,给社会和家庭带来沉重经济负担[1]。缺血再灌注是导致AKI的常见原因,发病机制目前尚不清楚。AKI的病理特征是肾小管上皮细胞的亚致死性和致死性损伤,包括肾小管上皮细胞的坏死、凋亡、焦亡等多种细胞损伤方式。肾小管上皮细胞线粒体功能障碍在肾小管上皮细胞损伤的发生机制中起有决定性的作用,但具体机制并不十分清楚。近年研究表明,线粒体动力相关蛋白1(dynamin-related protein1,Drpl)是调节线粒体分裂的关键蛋白[2],参与线粒体功能障碍的发生、发展。损伤的线粒体可以通过过度产生活性氧(reactive oxygen species,ROS)、Ca2+超载、ATP释放减少及线粒体内DNA(mtDNA)释放等多重机制触发炎症反应瀑布和细胞死亡程序,决定AKI病变的严重程度和预后[3]。本课题组前期研究发现,Nod样受体热蛋白结构域相关蛋白3(nucleotide binding oligomerization domain-like receptor family pyrin domain containing 3,Nlrp3)在急性肾衰发病中发挥重要作用,并在肾小管上皮细胞焦亡发生中扮演关键角色,但其上游调控通路和机制尚不清楚。本研究通过建立人肾小管上皮细胞HK-2的体外缺氧/复氧(hypoxia/reoxygenation,H/R)模型(模拟在体的缺血再灌注损伤),探讨Drp1-Nlrp3途径在缺氧/复氧所导致的肾小管上皮细胞焦亡中的可能机制,以期为阐明急性缺血性肾损伤的发生机制及其治疗提供新的思路。
1 材料与方法 1.1 主要试剂人肾小管上皮细胞HK-2购自中国典型培养物保藏中心,胎牛血清、DMEM/F12培养基、胰蛋白酶、Earle’s 平衡盐溶液购自美国Gibco公司,兔抗人Drp1多克隆抗体、山羊抗人Nlrp3多克隆抗体、兔抗人caspase-1多克隆抗体、小鼠抗人IL-1β单克隆抗体购自英国Abcam公司,辣根过氧化物酶羊抗兔、羊抗小鼠、驴抗羊IgG抗体购自碧云天生物技术公司,Mdivi-1购自美国MCE公司,DCFH-DA购自厦门生光生物科技有限公司。
1.2 细胞培养人肾小管上皮细胞系HK-2用含10%胎牛血清的DEME/F12培养基于37 ℃、5% CO2和95% O2的恒温培养箱培养。
1.3 实验分组和缺氧/复氧细胞模型的制备将对数生长期的HK-2细胞分成:①正常对照组:DMEM/F12培养基培养HK-2细胞。②缺氧/复氧 (H/R)组:将正常生长的HK-2细胞用PBS液漂洗3次,以无糖Earle’s平衡盐溶液,于1%O2+94%N2+5%CO2 的37 ℃缺氧箱中培养4 h,后将培养皿中的细胞用PBS液漂洗3次,再加入含10%胎牛血清的DEME/F12培养基,置于37 ℃、5%CO2和95%O2的恒温培养箱培养0、6、12、24 h。③缺氧/复氧+Mdivi-1(H/R+Mdivi-1)组:缺氧前1 h加入Drp1抑制剂Mdivi-1,用PBS液漂洗3次,以无糖Earle’s平衡盐溶液+Drp1抑制剂Mdivi-1,于1%O2+94%N2+5%CO2的37 ℃缺氧箱中培养4 h,后将培养皿中的细胞用PBS液漂 洗3次,再加入含10%胎牛血清的DEME/F12培养基+ Drp1抑制剂Mdivi-1,置于37 ℃、5%CO2和95%O2的恒温培养箱培养。④缺氧/复氧+Nlrp3 沉默腺病毒(H/R+siNlrp3)组:缺氧前48 h加入Nlrp3 沉默腺病毒,转染4 h,换DMEM/F12培养基维持培养,而后处理同H/R组。⑤H/R+空腺病毒(H/R+Scra)组:处理参照H/R+siNlrp3组。
1.4 细胞转染6孔板每孔含HK-2细胞105个,培养于10%胎牛血清的DEME/F12培养基中,在37 ℃、5%CO2和95%O2的恒温培养箱培养细胞达50% ~60%。分别用 8 μL 腺病毒空白载体或含siNlrp3腺病毒转染HK-2细胞继续培养4 h,弃上清,PBS漂洗3次,换含10%胎牛血清的DEME/F12培养基,置于37 ℃、5%CO2和95%O2的恒温培养箱培养48 h。
1.5 细胞焦亡的检测HK-2细胞按5×105/孔接种至24孔板。细胞用含5 μg/mL Hoechst 33342和10 μg/mL碘化丙啶(PI) 的PBS处理,流式细胞仪分析。利用生化分析仪检测各组细胞培养上清乳酸脱氢酶含量,反映细胞焦亡程度。
1.6 DCFH-DA检测细胞活性氧水平无血清的培养基,37 ℃避光培养30 min,弃上清,PBS液漂洗2 次,激光共聚焦显微镜下观察并照相(激发波长488 nm,发射波长525 nm)。
1.7 蛋白质免疫印迹分析收集细胞并提取蛋白,BCA法测蛋白浓度。将40 μg 总蛋白提取液与4×SDS缓冲液混匀,100 ℃热变性8 min,聚丙烯酰胺凝胶电泳分离,电转至PVDF膜;5%脱脂牛奶室温封闭2 h,分别加入兔抗人Drp1多克隆抗体(1 ∶1 000)、羊抗人Nlrp3多克隆抗体 (1 ∶1 000)、兔抗人caspase-1(1 ∶1 000)及小鼠抗人IL-1β 单克隆抗体(1 ∶1 000),4 ℃过夜;TBST缓冲液漂洗 8 min×3次;加入辣根过氧化物酶标记二抗(1 ∶1 000),37 ℃孵育2 h,TBST缓冲液清洗5 min×3次,避光加入ECL发光剂,X线常规显影、定影并进行灰度分析。
1.8 统计学分析计量资料用x±s表示,采用SPSS 13.0统计软件行单因素方差分析,检验水准α=0.05。
2 结果 2.1 缺氧/复氧时HK-2细胞发生焦亡正常对照组培养液上清乳酸脱氢酶LDH为(36.90±1.89)IU/L,H/R组LDH随着复氧时间增长而明显增加,复氧0 h时LDH(41.60±3.82)IU/L,6 h为(45.80±1.00)IU/L,12 h为LDH(50.20±3.29)IU/L,24 h达到(58.80±6.58)IU/L,为正常对照组的1.6倍(P <0.05)。流式细胞仪检测显示,与正常对照 组(0.115%)相比,H/R 24 h组细胞焦亡比例(5.27%) 明显升高,差异有统计学意义(P <0.05,图 1)。
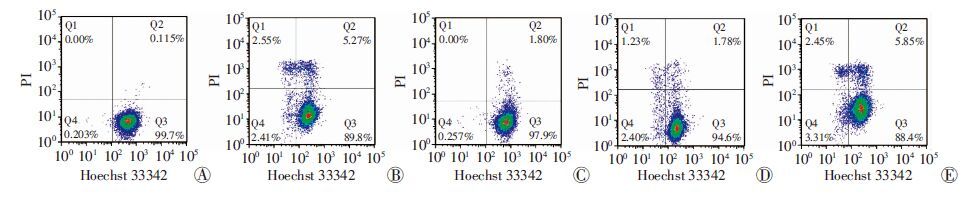
|
| A:正常对照组;B:H/R 24 h组;C:H/R 24 h+Mdivi-1组;D:H/R 24 h+siNlrp3组;E:H/R 24 h+Scra组;Scra为空腺病毒;siNlrp3为Nlrp3沉默腺病毒 图 1 流式细胞仪分析各组细胞焦亡情况 |
2.2 缺氧/复氧时HK-2细胞Drp1、Nlrp3、活性氧的表达
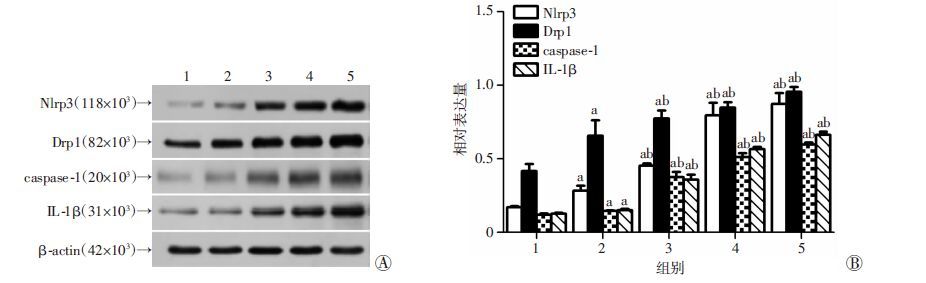
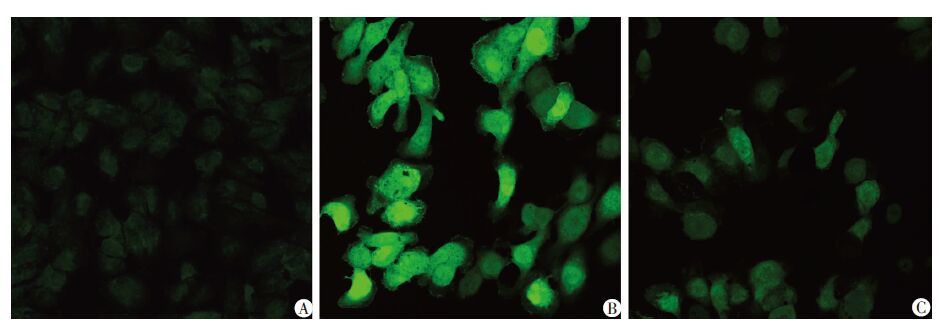
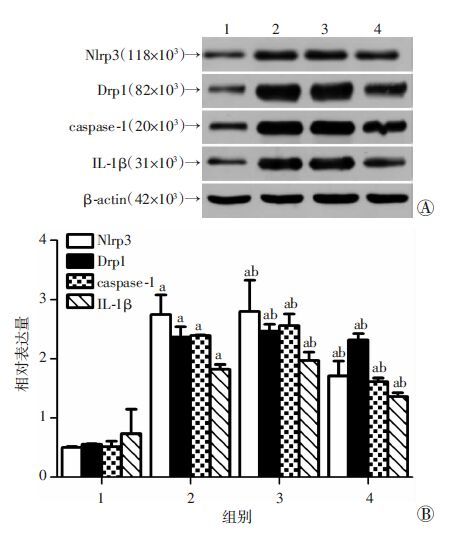
Western blot检测显示,与正常对照组相比,随着复氧时间(0、6、12、24 h)延长,Drp1和Nlrp3炎性体表达随之增加,caspase-1以及炎性因子IL-1β表达也逐渐升高(图 2)。DCFH-DA检测细胞活性氧发现HK-2细胞活性氧表达明显增强,差异有统计学意义(P <0.05,图 3)。
|
|
1:正常对照组;2:H/R 0 h组;3:H/R 6 h组;4:H/R 12 h组;5:H/R 24 h组 A:Western blot检测;B:半定量分析 a:P <0.05,与正常对照组比较;b:P <0.05,与前一组比较 图 2 Western blot检测不同复氧时间Nlrp3、Drp1、caspase-1、IL-1β的表达 |
|
| A:正常对照组;B:H/R 24 h组;C:C:H/R 24 h+Mdivi-1组 图 3 DCFH-DA法检测各组细胞活性氧水平 (激光共聚焦显微镜×400) |
2.3 Drp1抑制剂Mdivi-1减轻细胞活性氧、Nlrp3表达以及缺氧/复氧诱导的HK-2细胞焦亡
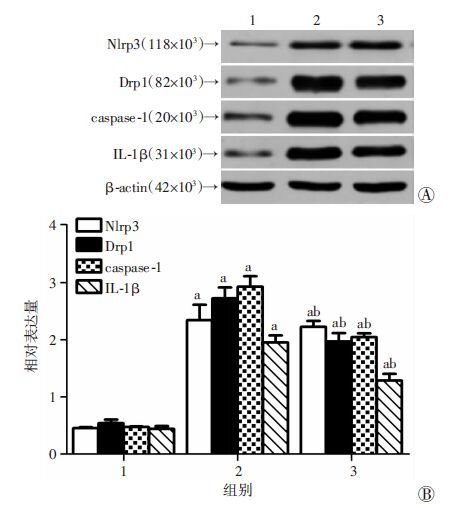
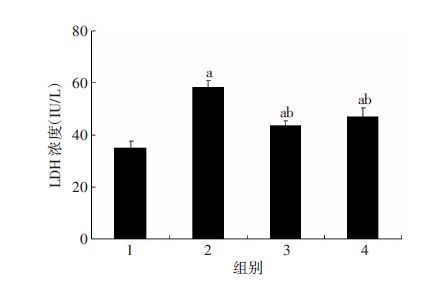
与H/R 24 h组相比,DCFH-DA活性氧染色结果显示H/R 24 h+Mdivi-1组活性氧明显降低(图 3)。加入Drp1抑制剂Mdivi-1后,Drp1的表达无明显变化,而Nlrp3炎性体、caspase-1及炎性因子IL-1β表达随之减少(图 4)。与H/R 24 h组(5.27%)相比,经Mdivi-1处理后,HK-2细胞在发生缺氧/复氧时焦亡(1.8%)降低(图 1),同时细胞上清液LDH释放量也减少,差异有统计学意义(P <0.05,图 5)。
|
| A:Western blot检测 1:正常对照组;2:H/R 24 h组;3:H/R 24 h+Mdivi-1组;B:半定量分析 a:P <0.05,与正常对照组比较;b:P <0.05,与H/R 24 h组比较 图 4 Western blot检测Drp1抑制剂对Nlrp3、Drp1、caspase-1、IL-1β表达的影响 |
|
|
1:正常对照组;2:H/R 24 h组;3:H/R 24 h+Mdivi-1组;4:H/R 24 h+siNlrp3组 a:P <0.05,与正常对照组比较;b:P <0.05,与H/R 24 h组比较 图 5 缺氧/复氧24 h时各组细胞培养液上清LDH释放量 |
2.4 siNlrp3能减少Nlrp3的表达和炎症反应以及HK-2细胞焦亡
与H/R组相比,经空腺病毒处理后,HK-2细胞在发生H/R时Nlrp3炎性体、caspase-1以及炎性因子IL-1β没有明显变化。而H/R 24 h+siNlrp3组Nlrp3炎性体、caspase-1以及炎性因子IL-1β表达减少,Drp1的表达无明显变化,焦亡降低(1.78%,图 1),同时细胞上清液LDH释放量也减少,差异具有统计学意义(P <0.05,图 6)。
|
|
1:正常对照组;2:H/R 24 h组;3:H/R 24 h+Scra组4:H/R 24 h+siNlrp3组;Scra为空腺病毒;siNlrp3为Nlrp3沉默腺病毒 A:Western blot检测;B:半定量分析 a:P <0.05,与正常对照组比较;b:P <0.05,与H/R 24 h组比较 图 6 Western blot检测siNlrp3对Nlrp3、Drp1、caspase-1、IL-1β表达的影响 |
3 讨论
急性肾衰肾小管上皮细胞死亡可有多种死亡途径。近年研究发现除坏死和凋亡这两种常见的细胞死亡方式外,其他程序性细胞死亡通路如自噬、焦亡在AKI发病中也发挥重要作用,这些通路与线粒体功能障碍密切相关。细胞焦亡是近年发现并证实的一种新的程序性细胞死亡方式,最早在弗氏志贺氏杆菌感染的巨噬细胞中发现。此种细胞死亡方式依赖于半胱天冬酶-1[4],但不伴随caspase-3(传统细胞凋亡通路)、caspase-6和caspase-7的激活,而由caspase-1介导[5]。caspase-1能诱导肾小管上皮细胞膜形成孔洞,导致大量炎症因子释放,因此肾小管上皮细胞焦亡时伴有大量促炎症因子(包括IL-1β、IL-18等)的释放,这是细胞焦亡区别于其他死亡方式的重要特征[6]。缺血再灌注损伤是临床AKI的常见病因,本实验采用体外培养肾小管上皮细胞的H/R模型,来模拟在体的缺血再灌注模型,观察肾小管上皮细胞的焦亡及其机制。本实验发现,与对照组相比,H/R组肾小管上皮细胞培养上清乳酸脱氢酶显著升高、流式细胞监测发现细胞焦亡显著增加,表明H/R确实诱导了肾小管上皮细胞焦亡。我们前期研究也证实在顺铂诱导的急性肾衰中,存在显著的肾小管上皮细胞焦亡[7]。这些均说明,肾小管上皮细胞焦亡参与了多种原因所导致的AKI的发生机制。Nlrp3/caspase-1轴是介导细胞焦亡发生的关键通路,活化的Nlrp3会发生结构上的重排,暴露出N端的热蛋白结构域 PYD,PYD 结合凋亡相关的斑点样蛋白ASC,ASC的另一端结合caspase-1,最终形成四聚体活化caspase-1,caspase-1将无活性IL-1β前体剪切为成熟IL-1β,启动焦亡及炎症反应。该炎症体通路不仅广泛存在于巨噬细胞、单核细胞等多种免疫细胞中,同时也存在于包括上皮细胞在内的部分非免疫细胞中[8]。本实验观察了人肾小管上皮细胞H/R损伤时Nlrp3、caspase-1、IL-1β表达变化,并构建siNlrp3腺病毒抑制Nlrp3的表达,观察H/R+siNlrp3组细胞焦亡情况。发现人肾小管上皮细胞H/R损伤中Nlrp3、caspase-1以及下游炎性因子IL-1β表达明显上调,细胞焦亡增加。siNlrp3能降低H/R时Nlrp3、caspase-1以及下游炎性因子表达,减少细胞焦亡,提示Nlrp3参与了缺血再灌注时人肾小管上皮细胞的焦亡,但何种途径激活Nlrp3炎性体参与肾脏缺血再灌注损伤仍需探讨。线粒体功能障碍是肾小球足细胞和肾小管上皮细胞损伤的早期事件,阻断线粒体ROS 可减轻细胞损伤,提示线粒体功能障碍在细胞损伤的始发阶段发挥重要作用[9]。研究表明ROS 可通过激活Nlrp3 炎性小体促进细胞的损伤,提示线粒体来源的ROS 可激活Nlrp3炎性小体。Drp1由日本筑波大学SHIN等于1997年首次报道[2]。近年来研究表明DRPl蛋白是调节线粒体分裂的关键蛋白,Drp1过表达能引起线粒体过度分裂而片段化,发生功能障碍,同时产生大量活性氧[10-11]。抑制线粒体分裂能增加线粒体内膜质子漏,质子漏增加能有效减少活性氧的产生[11-13]。本实验研究发现,相对于正常组,H/R损伤时Drp1表达上调,细胞活性氧显著增加。使用Drp1抑制剂Mdivi-1能有效减少H/R组活性氧的表达,并降低Nlrp3、caspase-1以及下游炎性因子表达,减少细胞焦亡,但Drp1抑制剂Mdivi-1未能降低Drp1的表达。其机制不明,但有文献报道可能是其只影响Drp1构象变化,未能阻止Drp1产生有关[14]。提示Drp1可能通过ROS激活Nlrp3炎性体,促进机体炎症反应并引发细胞焦亡。
综上所述,本研究提示缺氧/复氧导致线粒体功能障碍,可能通过上调Drp1,诱导Nlrp3炎性体表达,导致人肾小管上皮细胞发生炎症反应和焦亡,可能是急性缺血性肾损伤的重要机制。本研究缺少体内实验验证,下一步计划构建小鼠缺血再灌注模型,观察动物体内相关指标变化。
| [1] | Eachempati S R, Wang J C, Hydo L J, et al. Acute renal failure in critically ill surgical patients: persistent lethality despite new modes of renal replacement therapy[J]. J Trauma,2007, 63 (5) : 987 –993. DOI:10.1097/TA.0b013e3181574930 |
| [2] | Shin H W, Shinotsuka C, Torii S, et al. Identification and subcellular localization of a novel mammalian dynamin-related protein homologous to yeast Vps1p and Dnm1p[J]. J Biochem,1997, 122 (3) : 525 –530. DOI:10.1093/oxfordjournals.jbchem.a021784 |
| [3] | Funk J A, Schnellmann R G. Persistent disruption of mitochondrial homeostasis after acute kidney injury[J]. Am J Physiol Renal Physiol,2012, 302 (7) : F853 –F864. DOI:10.1152/ajprenal.00035.2011 |
| [4] | Miao E A, Rajan J V, Aderem A. Caspase-1-induced pyroptotic cell death[J]. Immunol Rev,2011, 243 (1) : 206 –214. DOI:10.1111/j.1600-065x.2011.01044.x |
| [5] | Fernandes-Alnemri T, Wu J, Yu J W, et al. The pyroptosome: a supramolecular assembly of ASC dimers mediating inflammatory cell death via caspase-1 activation[J]. Cell Death Differ,2007, 14 (9) : 1590 –1604. DOI:10.1038/sj.cdd.4402194 |
| [6] | Cerqueira D M, Pereira M S, Silva A L, et al. Caspase-1 but Not Caspase-11 Is Required for NLRC4-Mediated Pyroptosis and Restriction of Infection by Flagellated Legionella Species in Mouse Macrophages and In Vivo[J]. J Immunol,2015, 195 (5) : 2303 –2311. DOI:10.4049/jimmunol.1501223 |
| [7] | 曹雪娇, 侯卫平, 张媛媛, 等. P2X7/NALP3在急性肾小管坏死肾组织中的表达及意义[J]. 第三军医大学学报,2014, 36 (6) : 558 –563. DOI:10.16016/j.1000-5404.2014.06.022 |
| [8] | Strowig T, Henao-Mejia J, Elinav E, et al. Inflammasomes in health and disease[J]. Nature,2012, 481 (7381) : 278 –286. DOI:10.1038/nature10759 |
| [9] | Su M, Dhoopun A R, Yuan Y, et al. Mitochondrial dysfunction is an early event in aldosterone-induced podocyte injury[J]. Am J Physiol Renal Physiol,2013, 305 (4) : F520 –F531. DOI:10.1152/ajprenal.00570.2012 |
| [10] | Brooks C, Wei Q, Cho S G, et al. Regulation of mitochondrial dynamics in acute kidney injury in cell culture and rodent models[J]. J Clin Invest,2009, 119 (5) : 1275 –1285. DOI:10.1172/jci37829 |
| [11] | Carneiro L, Allard C, Guissard C, et al. Importance of mitochondrial dynamin-related protein 1 in hypothalamic glucose sensitivity in rats[J]. Antioxid Redox Signal,2012, 17 (3) : 433 –444. DOI:10.1089/ars.2011.4254 |
| [12] | Lee H, Yoon Y. Transient contraction of mitochondria induces depolarization through the inner membrane dynamin OPA1 protein[J]. J Biol Chem,2014, 289 (17) : 11862 –11872. DOI:10.1074/jbc.m113.533299 |
| [13] | Guo K, Lu J, Huang Y, et al. Protective role of PGC-1α in diabetic nephropathy is associated with the inhibition of ROS through mitochondrial dynamic remodeling[J]. PLoS One,2015, 10 (4) : e0125176 . DOI:10.1371/journal.pone.0125176 |
| [14] | Tanaka A, Youle R J. A chemical inhibitor of DRP1 uncouples mitochondrial fission and apoptosis[J]. Mol Cell,2008, 29 (4) : 409 –410. DOI:10.1016/j.molcel.2008.02.005 |



