宫腔粘连(intrauterine adhesions,IUA)是一种常见的妇科继发性疾病,多继发于人工流产及子宫内膜切除术后,与不当刮宫以及宫腔内出血、感染等有关,目前多以宫腔粘连分解术治疗,术后于宫腔内放置宫内节育器、球囊导尿管或宫腔形状气囊等支架,能部分阻隔宫腔创面预防再粘连,然而存在分离效果有限[1]、易引起逆行感染[2]等缺点,更重要的是,对于宫内膜基底层严重损伤的宫腔粘连,基底层干细胞的缺损导致内膜功能层修复障碍,常致粘连复发[3]。因此,研究更加安全、有效分隔宫腔创面,兼具诱导干细胞归巢修复内膜损伤的宫腔内缓释材料,是治疗重度IUA的当务之急。
温度敏感性水凝胶可对环境温度做出智能响应,发生溶胶相与凝胶相的可逆性转变,近年来已受到药物控制释放系统、组织工程应用等领域的广泛关注[4]。由四川大学生物治疗国家重点实验室研制的温度敏感性PLEL水凝胶具有灵敏的温度响应性及持续的蛋白缓释能力,可在体温下迅速由溶胶相转变为凝胶相,并持续释放负载的生物因子,是宫腔内缓释材料的良好选择。
SDF-1为低氧敏感性分子,当组织缺氧时其表达增高。它在骨髓中对骨髓间充质干细胞(bone marrow derived mesenchymal stem cells,BMSCs)的归巢和定植有重要作用[5],研究表明SDF-1通过其受体CXCR4发挥细胞募集作用,且该效应轴参与全身多系统的缺血缺氧性损伤的修复,如心肌梗死、胰腺损伤、缺血缺氧性脑病、肝脏损伤[6]等。子宫内膜组织低氧环境是月经前期的正常生理现象,局部低氧环境是内膜组织血管生成和组织重构的重要调节因素。人类子宫内膜中SDF-1功能的研究表明:SDF-1可能在内膜增殖、胚胎着床中发挥重要作用[7]。此外,组织工程领域相关研究表明,复合SDF-1的活性支架植入体内后,能诱导干细胞归巢并促进诸如神经组织、血管、肌腱组织、骨组织的再生,同时还能抑制炎症反应[8-10]。
因此,我们假设缓释rhSDF-1α的PLEL水凝胶在提供屏障作用的同时,能够动员间充质干细胞(mesenchymal stem cells,MSCs)等细胞归巢,促进受损子宫内膜再生修复,可能成为预防重度IUA的理想方案。本研究观察体外和体内rhSDF-1α对MSCs的趋化作用,并分组考察PLEL水凝胶及rhSDF-1α对新西兰白兔子宫内膜损伤再生修复的影响。
1 材料与方法 1.1 PLEL-rhSDF-1α复合水凝胶的准备和表征 1.1.1 PLEL-rhSDF-1α复合水凝胶PLEL由四川 大学生物治疗国家重点实验室研制提供,10 g PLEL固体(含4.5 g水)中加入17.5 g双蒸水配制成20%(质量分数)的水凝胶,200 μg/mL的rhSDF-1α( R&D Systems Inc.,美国)溶液10 μL与20% PLEL水凝胶300 μL混合,37 ℃孵育6 h后室温放置至均质溶液状。
1.1.2 蛋白缓释实验10 μL 25 mg/mL牛血清白蛋白(bovine serum albumin,BSA)(Sigma,美国)或PBS与20%PLEL水凝胶300 μL混合,37 ℃孵育6 h后室温放置至均质溶液状,抽吸至1 mL无针头注射器中,37 ℃孵育30 min充分凝胶化后注入含10 mL PBS的6 cm培养皿中,置于细胞培养箱中(37 ℃,5%CO2)模拟体内环境,分别于0、1、4、12、24、48、72 h各收集其中1 mL PBS,用微蛋白检测试剂盒(Thermo-Fisher Scientific Inc.,美国)检测收集的PBS中BSA浓度,重复3次。
1.2 体外rhSDF-1α对BMSCs的趋化性实验 1.2.1 细胞分离及培养取1 500~2 000 g新西兰白兔胫骨骨髓,种入6孔板中置于37 ℃、5%CO2孵箱内培养BMSCs原代细胞,3 d后以含10%胎牛血清(PAN-Biotech GnbH,德国)的α-MEM全量换液,以后每2.5天换液1次,细胞融合至80%时传代,传至第3代的细胞用于以后实验。
1.2.2 体外趋化性实验用Transwell系统(Corning Incorporated,美国)研究体外rhSDF-1α对BMSCs 趋化作用,上室加入100 μL含1×105/mL BMSCs的无血清 α-MEM(含0.5%BSA),下室加入600 μL 含 rhSDF-1α(120 ng/mL) 的无血清α-MEM作为处理组,为了进一步研究趋化作用,上室也加入rhSDF-1α作为对照组,此外,空白对照组上下室均不加因子rhSDF-1α,每组设3个培养孔。
在培养箱中孵育24 h后,棉签擦去小室上表面的细胞,已迁移到下表面的细胞DAPI染核,倒置荧光显微镜下随机选择5个高倍镜视野(200×)/孔计数。
1.3 凝胶支架植入子宫内膜损伤修复模型 1.3.1 动物模型及分组24只成年雌性新西兰白兔(48条子宫)分为4组,实验动物由第三军医大学实验动物中心提供,体质量3 000~3 500 g。手术前以30 mg/mL戊巴比妥钠按兔体质量1 mL/kg经耳缘静脉注射麻醉,观察呼吸频率降至15~20/min、角膜反射消失、肌张力下降为麻醉满意,取下腹部正中切口暴露子宫,沿子宫长轴剪开,用眼科剪剪去子宫内膜凸起部分,生理盐水纱布确切止血,将剪开的子宫切口对合整齐并以6-0尼龙线间断缝合。自然修复组(n=12):缝合子宫切口,关闭宫腔,逐层缝合腹壁,让受损的子宫内膜自然修复;PLEL治疗组(n=12):关闭子宫腔后,向腔内注射PLEL水凝胶至饱和,2 min后回抽水凝胶无法吸出,即其已凝胶化,随后逐层缝合腹壁;PLEL-rhSDF-1α治疗组(n=12):宫腔内注射的为PLEL-rhSDF-1α复合水凝胶;假手术组(n=12):仅进行下腹壁的切开及缝合,不处理子宫。在术后7 d和28 d各组分别取6条子宫标本进行组织学检测。
1.3.2 组织冰冻切片及免疫荧光染色子宫标本切分为上、中、下3段,液氮速冻,OCT包埋剂包埋,冰冻切片机-20 ℃连续切片(8 μm),室温晾干15 min,PBS浸泡10 min,山羊血清37 ℃封闭30 min,加anti-CD44小鼠单克隆抗体(1 ∶50稀释,Abcam,英国)或anti-CD90小鼠单克隆抗体(1 ∶500稀释,Abcam,英国)4 ℃孵育过夜,PBS洗涤后加FITC标记羊抗小鼠IgG(1 ∶200稀释,Abbkine,美国)或IFKine Red标记驴抗小鼠IgG (1 ∶200稀释,Abbkine,美国)37 ℃孵育30 min,PBS洗涤后封片,荧光显微镜观察CD44及CD90表达情况并拍照。
1.3.3 HE染色及免疫组织化学染色子宫标本切分为上、中、下3段,4%多聚甲醛固定标本,石蜡包埋,石蜡切片机连续切片(3 μm),用常规方法进行HE染色,免疫组织化学染色,切片用枸橼酸钠煮沸修复20 min,H2O2反应内源性过氧化氢酶,山羊血清37 ℃封闭30 min,加小鼠抗兔广谱角蛋白单克隆抗体(1 ∶50稀释,Abcam,英国)4 ℃孵育过夜,PBS洗涤后加生物素标记羊抗小鼠IgG (中杉金桥生物技术,中国)37 ℃孵育30 min,辣根过氧化物酶室温孵育15 min,DAB显色1 min ,封片后显微镜观察角蛋白阳性细胞的表达并拍照。
1.4 图像分析使用Image J进行体外趋化实验中BMSCs计数、免疫荧光染色MSCs 细胞密度计算,子宫内膜上皮层与基底层周长使用Photoshop处理并使用Image J计算 。
1.5 统计学分析采用SPSS 17.0统计软件录入数据并进行分析,结果以x±s表示,术后7 d,PLEL治疗组与PLEL-rhSDF-1α治疗组MSCs细胞密度均数比较用独立样本t检验分析,多个样本均数比较用单因素方差分析、组间两两比较采用LSD-t检验,检验水准α=0.05。
2 结果 2.1 PLEL水凝胶及体外蛋白缓释结果PLEL水凝胶在温度上升至32~35 ℃时由溶胶相转变为凝胶相(图 1A)。在体外模拟宫腔环境,将PLEL-BSA水凝胶凝胶化后置于37 ℃ PBS中可保持形态超过3 d,3 d后发生明显溶蚀,其蛋白累积释放曲线显示BSA缓释时间超过3 d(图 1B)。
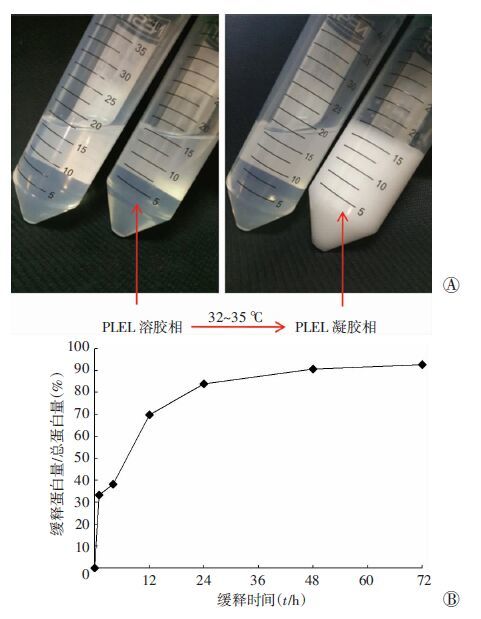
|
| A: PLEL水凝胶相转变 温度升至32~35 ℃由溶胶相转变为 凝胶相;B:负载BSA的PLEL凝胶体外缓释曲线 在37 ℃ PBS中缓慢释放BSA至3 d以上 图 1 PLEL水凝胶相转变及负载BSA的PLEL凝胶体外缓释曲线 |
2.2 rhSDF-1α对BMSCs的趋化作用
Transwell系统中上下室均未加rhSDF-1α时,BMSCs 的迁移数量为(26.070±7.285)(图 2A),下室加入rhSDF-1α后BMSCs迁移数量为(54.330±9.424) (图 2B),然而,在上室也加入相同浓度的rhSDF-1α时,BMSCs迁移数量为(27.730±6.649)(图 2C),可见,下室中rhSDF-1α的存在明显增加了BMSCs的迁移数量(P <0.05),而上下室存在相同浓度rhSDF-1α时BMSCs迁移数量又明显减少(P <0.05)。
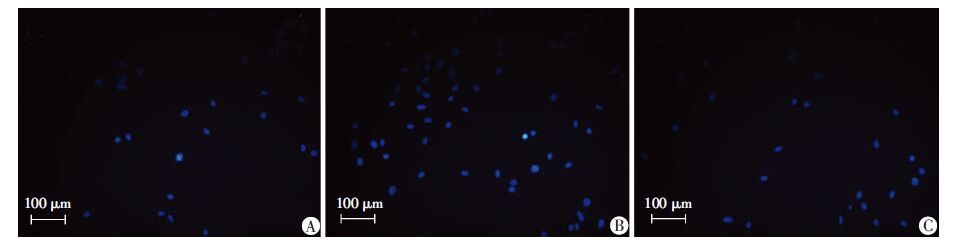
|
| A:上下室均不加rhSDF-1α;B:上室不加、下室加rhSDF-1α;C:上、下室均加rhSDF-1α 图 2 不同处理组Transwell小室下室表面BMSCs的DAPI染色比较细胞迁移数量 |
2.3 不同处理对术后子宫内膜再生修复影响
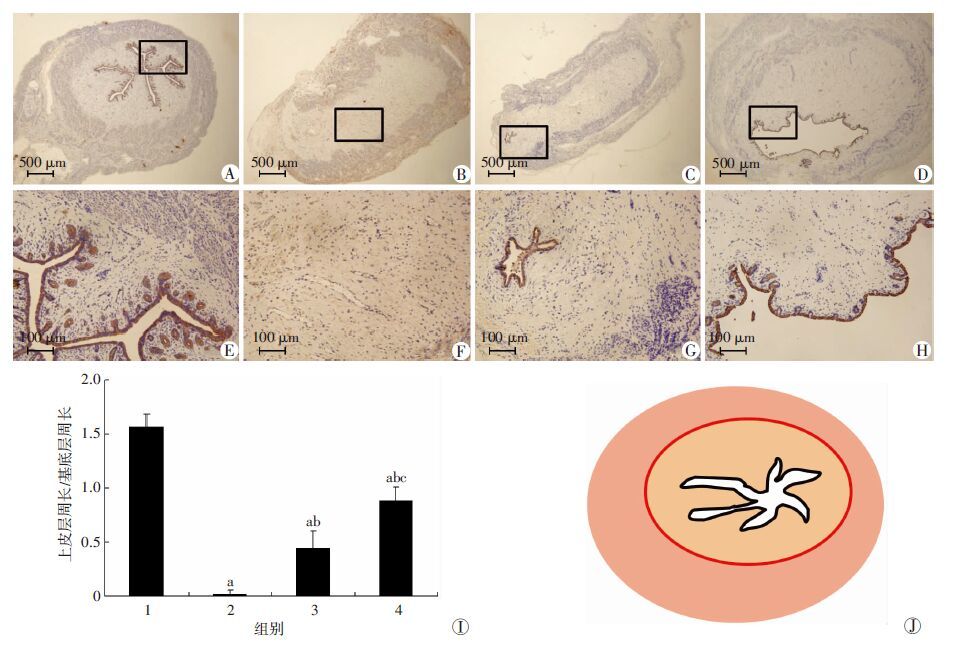
手术剪去大部分子宫内膜,术后内膜菲薄(图 3)。术后28 d,从子宫标本大体形态上看,自然修复组由于宫腔粘连闭塞,致子宫输卵管连结部位积水膨大,而PLEL治疗组及PLEL-rhSDF-1α治疗组未发生积水(图 4);组织切片HE染色显示自然修复组宫腔内无上皮样细胞出现,宫腔完全闭塞,内壁相互粘连,治疗组有连续的上皮样细胞覆盖宫腔,但PLEL-rhSDF-1α治疗组再生内膜层较PLEL治疗组更接近假手术组,上皮层褶皱更多,周长更长(图 5);覆盖宫腔的上皮样细胞角蛋白免疫组化染色均为阳性(图 6),以角蛋白染色结果统计各组内膜上皮层周长与基底层周长之比,如图 6I所示:假手术组大于其他各组(P <0.05),PLEL治疗组大于自然修复组(P <0.05),PLEL-rhSDF-1α 治疗组大于PLEL治疗组(P <0.05)。
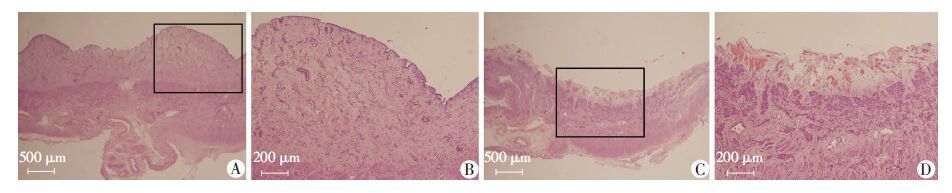
|
| A:手术前;C:手术后;B、D:分别为A、C图黑框内放大图像 图 3 HE染色对比手术前后子宫内膜厚度 |
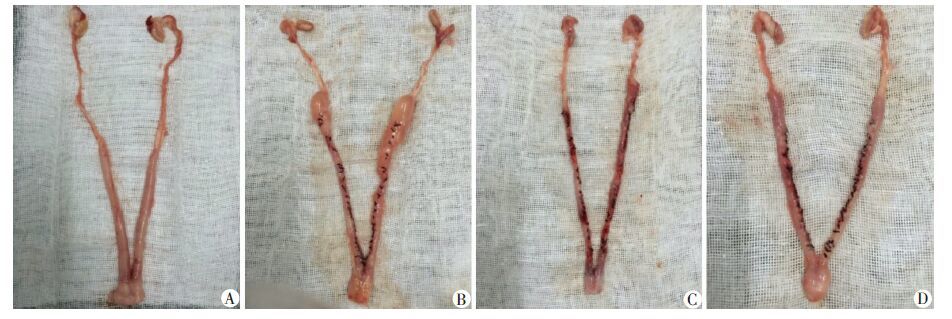
|
| A:假手术组;B:自然修复组;C:PLEL治疗组;D:PLEL-rhSDF-1α治疗组 图 4 术后28 d各处理组子宫标本大体形态观察 |

|
| A:假手术组;B:自然修复组;C:PLEL治疗组;D:PLEL- rhSDF-1α治疗组;E、F、G、H:分别为A、B、C、D黑框内放大图像 图 5 术后28 d各处理组子宫标本横截面HE染色观察 |
|
| A:假手术组;B:自然修复组;C:PLEL治疗组;D:PLEL-rhSDF-1α治疗组;E、F、G、H:分别为A、B、C、D黑框内放大图像;I:各组再生内膜上皮层周长与基底层周长比值 1:假手术组;2:自然修复组;3:PLEL治疗组;4:PLEL-rhSDF-1α治疗组;a:P <0.05,与假手术组比较;b:P <0.05,与自然修复组比较;c:P <0.05,与PLEL治疗组比较;J:兔子宫横截面示意图 黑色线条:内膜上皮层周长;红色线条:内膜基底层周长 图 6 术后28 d各处理组子宫内膜上皮组织角蛋白免疫组化染色观察 |
2.4 治疗组MSCs归巢情况
术后7 d,治疗组子宫标本CD44及CD90免疫荧光染色显示有MSCs归巢至再生内膜组织(图 7),PLEL-rhSDF-1α治疗组归巢MSCs细胞密度为(5 357.7± 1 355.5)/mm2较PLEL治疗组(1 496.5±650.9)/mm2 约为3.6倍,差异有统计学意义(P <0.05)。

|
| A~D:CD44;E~H:CD90;A、E:PLEL治疗组;B、F:分别为A、E白框内放大图像;C、G:PLEL-rhSDF-1α治疗组;D、H:分别为C、G白框内放大图像;绿色荧光标记CD44;红色荧光标记CD90 图 7 术后 7 d再生内膜层CD44及CD90免疫荧光染色比较归巢MSCs细胞密度 |
3 讨论
本研究结果证明:温度敏感性PLEL水凝胶复合rhSDF-1α具有预防子宫宫腔粘连、促进子宫内膜再生修复的作用。PLEL水凝胶在宫腔内转变为凝胶相,在受损的子宫内膜间起到了物理阻隔作用,载入的外源性rhSDF-1α在宫腔内缓慢释放,吸引MSCs定植于受损子宫内膜层,减轻内膜组织纤维化,促进再生修复。
温度敏感性PLEL水凝胶具有生物可降解、无细胞毒性、维持生物因子活性等特点[11],并可通过宫颈口以无创注射方式填充于子宫腔内,具有良好的临床应用前景,相较于目前临床用于宫腔粘连分粘术后预防再粘连的宫内节育器、球囊导尿管和宫腔形状气囊支架等,具有对宫腔形状的适应性强,可自然降解,感染风险低等优点。本研究体内实验中,PLEL水凝胶能有效地填充新西兰白兔子宫宫腔,迅速发生相转变,形成有效的物理阻隔,有明显预防宫腔粘连的效果。
文献[12-13]报道,rhSDF-1α复合材料可促进肌腱、软骨等组织再生修复,但目前尚未发现其对子宫内膜修复效果的相关报道。本研究体内实验中,与PLEL治疗组相比,PLEL-rhSDF-1α治疗组在术后28 d的组织学表现上有更好的结果,提示rhSDF-1α也可促进子宫内膜再生修复。SDF-1α可促进血管生成[8],还能促进如MSCs等CXCR-4阳性细胞归巢至受损部位,与本研究体内实验中术后7 d再生内膜层的MSCs定植情 况一致。MSCs可以通过分泌广谱的生长因子、趋化因子、细胞因子等来促进血管生成[14]和新生血管化[15-16],也可能产生外泌体来维护组织微环境的动态平衡[17],同时通过多种途径起到免疫调节作用[18]。这些作用均有利于受损组织再生修复。当然,这需要rhSDF-1α在宫腔内保持较高浓度,而我们在体外PLEL水凝胶的BSA缓释实验中观察到PLEL负载的BSA可缓慢释放达3 d以上,证明了其维持所载蛋白在局部持续保持较高浓度的能力。
本研究体外趋化性实验中,加入外源性rhSDF-1α促进了BMSCs的迁移,提示了在PLEL-rhSDF-1α治疗组中,出现的大量MSCs可能为循环血液中的BMSCs。文献[19-20]报道,向三氯乙酸化学损伤后的子宫内膜注射BMSCs治疗,可减轻内膜纤维化、促进血管形成及内膜再生;用种植BMSCs的胶原膜修补大鼠缺损 子宫壁可促进其再生甚至恢复妊娠功能。然而在临床应用中存在BMSCs的分离、提纯困难等问题,本研究利用rhSDF-1α趋化自身BMSCs巧妙地避免了这些问题。
综上所述,PLEL-rhSDF-1α复合凝胶能通过PLEL水凝胶的物理阻隔作用以及缓释rhSDF-1α诱导 MSCs归巢促进子宫内膜修复,达到预防宫腔粘连的目的。当然,本研究也存在一些不足:目前尚无公认的宫腔粘连模型构建方法,而在我们前期构建动物模型的尝试中,采用剪去内膜凸起的方法可使术后宫腔粘连率达90%以上,有较好的稳定性,但此法不能精确地控制残余内膜的厚度;此外,本研究尚未对PLEL水凝胶及rhSDF-1α的具体作用机制进行深入揭示,参与促进内膜再生修复的细胞及生化成分也并不十分清楚,然而,治疗组最终的组织学修复表现较自然修复组有明显提高,预示温度敏感性PLEL水凝胶复合rhSDF-1α在防治重度IUA等疾病中可能有良好的应用前景。
| [1] | Tonguc E A, Var T, Yilmaz N, et al. Intrauterine device or estrogen treatment after hysteroscopic uterine septum resection[J]. Int J Gynaecol Obstet,2010, 109 (3) : 226 –229. DOI:10.1016/j.ijgo.2009.12.015 |
| [2] | Myers E M, Hurst B S. Comprehensive management of severe Asherman syndrome and amenorrhea[J]. Fertil Steril,2012, 97 (1) : 16 –164. DOI:10.1016/j.fertnstert.2011.10.036 |
| [3] | Gargett C E, Ye L. Endometrial reconstruction from stem cells[J]. Fertil Steril,2012, 98 (1) : 11 –20. DOI:10.1016/j.fertnstert.2012.05.004 |
| [4] | Jeong B, Kim S W, Bae Y H. Thermosensitive sol-gel reversible hydrogels[J]. Adv Drug Deliv Rev,2002, 54 (1) : 37 –51. |
| [5] | Honczarenko M, Le Y, Swierkowski M, et al. Human bone marrow stromal cells express a distinct set of biologically functional chemokine receptors[J]. Stem Cells,2006, 24 (4) : 1030 –1041. DOI:10.1634/stemcells.2005-0319 |
| [6] | Vagima Y, Lapid K, Kollet O, et al. Pathways implicated in stem cell migration: the SDF-1/CXCR4 axis[J]. Methods Mol Biol,2011, 750 : 277 –289. DOI:10.1007/978-1-61779-145-1_19 |
| [7] | Tsuzuki T, Okada H, Cho H, et al. Hypoxic stress simultaneously stimulates vascular endothelial growth factor via hypoxia-inducible factor-1α and inhibits stromal cell-derived factor-1 in human endometrial stromal cells[J]. Hum Reprod,2012, 27 (2) : 523 –530. DOI:10.1093/humrep/der405 |
| [8] | Thevenot P T, Nair A M, Shen J, et al. The effect of incorporation of SDF-1alpha into PLGA scaffolds on stem cell recruitment and the inflammatory response[J]. Biomaterials,2010, 31 (14) : 3997 –4008. DOI:10.1016/j.biomaterials.2010.01.144 |
| [9] | Lau T T, Wang D A. Stromal cell-derived factor-1 (SDF-1): homing factor for engineered regenerative medicine[J]. Expert Opin Biol Ther,2011, 11 (2) : 189 –197. DOI:10.1517/14712598.2011.546338 |
| [10] | Ji W, Yang F, Ma J, et al. Incorporation of stromal cell-derived factor-1α in PCL/gelatin electrospun membranes for guided bone regeneration[J]. Biomaterials,2013, 34 (3) : 735 –745. DOI:10.1016/j.biomaterials.2012.10.016 |
| [11] | Gong C Y, Dong P W, Shi S, et al. Thermosensitive PEG-PCL-PEG hydrogel controlled drug delivery system: sol-gel-sol transition and in vitro drug release study[J]. J Pharm Sci,2009, 98 (10) : 3707 –3717. DOI:10.1002/jps.21694 |
| [12] | Shen W, Chen X, Chen J, et al. The effect of incorporation of exogenous stromal cell-derived factor-1 alpha within a knitted silk-collagen sponge scaffold on tendon regeneration[J]. Biomaterials,2010, 31 (28) : 7239 –7249. DOI:10.1016/j.biomaterials.2010.05.040 |
| [13] | Zhang W, Chen J, Tao J, et al. The use of type 1 collagen scaffold containing stromal cell-derived factor-1 to create a matrix environment conducive to partial-thickness cartilage defects repair[J]. Biomaterials,2013, 34 (3) : 713 –723. DOI:10.1016/j.biomaterials.2012.10.027 |
| [14] | Miyahara Y, Nagaya N, Kataoka M, et al. Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction[J]. Nat Med,2006, 12 (4) : 459 –465. DOI:10.1038/nm1391 |
| [15] | Min J Y, Sullivan M F, Yang Y, et al. Significant improvement of heart function by cotransplantation of human mesenchymal stem cells and fetal cardiomyocytes in postinfarcted pigs[J]. Ann Thorac Surg,2002, 74 (5) : 1568 –1575. |
| [16] | Kinnaird T, Stabile E, Burnett M S, et al. Marrow-derived stromal cells express genes encoding a broad spectrum of arteriogenic cytokines and promote in vitro and in vivo arteriogenesis through paracrine mechanisms[J]. Circ Res,2004, 94 (5) : 678 –685. DOI:10.1161/01.RES.0000118601.37875.AC |
| [17] | Lai R C, Yeo R W, Lim S K. Mesenchymal stem cell exosomes[J]. Semin Cell Dev Biol,2015, 40 : 82 –88. DOI:10.1016/j.semcdb.2015.03.001 |
| [18] | Glenn J D, Whartenby K A. Mesenchymal stem cells: Emerging mechanisms of immunomodulation and therapy[J]. World J Stem Cells,2014, 6 (5) : 526 –539. DOI:10.4252/wjsc.v6.i5.526 |
| [19] | Kilic S, Yuksel B, Pinarli F, et al. Effect of stem cell application on Asherman syndrome, an experimental rat model[J]. J Assist Reprod Genet,2014, 31 (8) : 975 –982. DOI:10.1007/s10815-014-0268-2 |
| [20] | Ding L, Li X, Sun H, et al. Transplantation of bone marrow mesenchymal stem cells on collagen scaffolds for the functional regeneration of injured rat uterus[J]. Biomaterials,2014, 35 (18) : 4888 –4900. DOI:10.1016/j.biomaterials.2014.02.046 |



