2. 450002 郑州,河南省中医院:护理部
2. Department of Nursing, Henan Provincial Hospital of Traditional Chinese Medicine, Zhengzhou, Henan Province, 450002, China
椎间盘退变疾病与椎间盘结构崩塌和功能失调有关。近年研究报道全球有超过6亿人患有椎间盘退变疾病, 严重影响患者的工作和生活[1],但其发病机制尚不完全明确。一般认为椎间盘退变疾病起自椎间盘内层髓核中的细胞外基质(extracellular matrix, ECM)的合成与降解失衡,主要表现为ECM含量降低、活细胞减少和促炎因子分泌增多[2-3]。目前,活性物质注射、基因治疗和细胞移植是椎间盘退变疾病治疗最有前景的三个领域[4-5]。研究报道骨髓间充质干细胞(bone mesenchymal stem, BMSCs)能被诱导向中胚层细胞分化,发挥抗凋亡和抗炎的作用[6],添加外源性细胞因子或基因能诱导其分化为类髓核细胞(nucleus pulposus cells, NPCs),并发挥髓核细胞的生物功能[7]。人血管内皮素生长因子(humanvascular endothelial growth factor,hVEGF)和转化生长因子(transforming growth factor-β1, TGF-β1)具有协同作用,可增加退行性椎间盘中纤维环细胞Ⅰ型胶原的表达。在模拟微重力环境下,TGF-β1能提高BMSCs合成蛋白聚糖和Ⅱ型胶原的能力,诱导BMSCs向NPCs分化[8]。细胞内的血管内皮生长因子(vascular endothelial growth factor,VEGF)能通过转录因子的调节控制BMSCs的分化[9]。但目前关于VEGF和TGF-β1的协同作用对BMSCs分化的影响尚少见报道。本研究以兔BMSCs为细胞载体,转染腺相关病毒(adeno-associated virus,AAV)-VEGF和AAV-TGF-β1腺病毒载体,探讨VEGF和TGF-β1的协同作用对BMSCs增殖、分化的影响及其可能的机制,以期为椎间盘退变性疾病的细胞移植治疗提供理论基础。
1 材料与方法 1.1 实验动物及材料3周龄健康清洁级新西兰大白兔,雄性,体质量1.2~1.8 kg,购于浙江大学医学实验动物中心。胎牛血清购于杭州四季青公司,DMEM/F12培养基购于HyClone公司,腺病毒载体AAV-pSNAV购自上海生工公司,pcDNA3(+)-VEGF和pcDNA3(+)-TGF-β1原核表达质粒由本实验室保存,CCK8试剂盒购于Sigma公司,鼠抗人VEGF、TGF-β1、SOX-9、CollagenⅡ、Aggrecan、P38、MAPKAPK2、HSP27和β-actin一抗及HRP标记的羊抗鼠二抗购于北京博奥生物技术有限公司,SB203580购于广州威佳科技有限公司,荧光倒置显微镜购于英国Andor公司,CO2培养箱购于美国Thermo公司,凝胶成像仪购于美国Bio-rad公司。
1.2 BMSCs的分离培养大白兔麻醉后于双侧股骨转子部位脱毛,16号骨髓穿刺针在股骨转子处抽取5 mL左右的骨髓液,1 000 r/min离心5 min后收集沉淀,PBS溶液清洗2次,用含10%胎牛血清的DMEM/F12培养基稀释细胞至1×106/mL,并立即接入细胞培养瓶,于37℃,5% CO2饱和湿度的条件下培养。48 h后半量换液,待细胞长至90%左右按1∶3的比例传代,以后每3天进行1次全量换液,倒置显微镜观察各组细胞形态,第3代细胞用于对照和转染实验。
1.3 AAV-VEGF和AAV-TGF-β1腺病毒载体的构建和转染及分组处理AAV-VEGF腺病毒载体的构建:以包含VEGF全序列的pcDNA3(+)-VEGF质粒为模板扩增,上游引物:5′-ATCGGAATTCATGAACTTTCGCTG-3′,下游引物:5′-ATCTGTCGACTCACCGCCTCGGCTT-3′,PCR扩增得到带有EcoRⅠ和SalⅠ酶切位点的DNA片段,用EcoRⅠ和SalⅠ同步双酶切PCR产物和腺病毒载体AAV-pSNAV,连T载转化感受态细胞DH5α,单克隆测序得到的含VEGF基因的腺病毒表达载体AAV-VEGF。AAV-TGF-β1腺病毒载体的构建按照与AAV-VEGF相同的方法进行。取第3代生长良好的BMSCs,5×104/孔铺96孔板,镜检细胞铺满70%左右时,将细胞分为4组:对照组:单独转染腺病毒空载体;AAV-VEGF组:单独转染AAV-VEGF腺病毒表达载体;AAV-TGF-β1组:单独转染AAV-TGF-β1腺病毒表达载体;VEGF+TGF-β1组:同时转染AAV-VEGF和AAV-TGF-β1腺病毒表达载体。转染腺病毒载体后的各组细胞,培养72 h后,倒置显微镜观察细胞形态。
1.4 Western blot检测蛋白表达收集各组BMSCs,加入0.25%胰蛋白酶消化后,用PBS缓冲液清洗细胞3次。加入65μL RIPA细胞蛋白裂解液,SDS-PAGE电泳分离蛋白。电泳结束后转膜,再用5%脱脂奶粉室温封闭1 h,加入稀释1 000倍的鼠抗人VEGF、TGF-β1、SOX-9、CollagenⅡ、Aggrecan、SOX-9、CollagenⅡ、Aggrecan、P38、MAPKAPK2、HSP27和β-actin一抗,4℃轻摇过夜,加入稀释5 000倍的HRP标记的羊抗鼠二抗,室温孵育1 h。X线片曝光分析,结果用Image-Pro Plus处理,以目的蛋白与内参β-actin的灰度值比值表示蛋白的相对表达量。
1.5 流式细胞术检测细胞凋亡取培养48 h后的各组BMSCs,用4℃预冷的PBS洗涤2次,加入0.25%胰酶消化,收集后迅速加入0.5 mL 1×Annexin V结合缓冲液,低速离心后弃上清,另加结合缓冲液10μL和PI 5μL并混匀,于37℃避光孵育30 min。在流式细胞仪上设置激发波长488 nm和发射波长530 nm,检测细胞凋亡率。
1.6 CCK8检测细胞增殖转染腺病毒48 h后,收集细胞,1×104/孔铺96孔板,置于细胞培养箱培养0、24、48、72、96、120 h后,分别加入10μL CCK8试剂,37℃继续孵育2 h,用酶标仪检测450 nm处光密度值[D(450)],每组设3个复孔,重复3次测量,计算细胞增殖倍数,做增殖曲线。
1.7 SB203580处理BMSCs用P38MAPK的特异阻滞剂SB203580处理第3代生长良好的BMSCs细胞,分为4组:对照组:单独转染腺病毒空载体;VEGF+TGF-β1组:同时转染AAV-VEGF和AAV-TGF-β1质粒;SB203580组:抑制剂SB203580用DMSO溶解后,加入培养基稀释至10μmol/L预干预细胞1 h后,在DMEM/F12培养基中培养;VEGF+TGF-β1+SB组:用10μmol/LSB203580干预细胞1 h后,转染AAV-VEGF和AAV-TGF-β1腺病毒载体到抑制剂干预后的细胞中。每组设置3个复孔,每3天换1次液,收集各组细胞按照前面的方法研究各组细胞的增殖,凋亡及蛋白表达情况。
1.8 统计学分析采用SPSS13.0统计软件,计量资料用x±s表示,行单因素方差分析,P < 0.05表示差异有统计学意义。
2 结果 2.1 腺病毒载体AAV-VEGF和AAV-TGF-β1的转染情况第3代BMSCs细胞被腺病毒载体AAV-VEGF和AAV-TGF-β1分别单独转染和共转染后,继续培养48 h,分别提取总蛋白。Western blot分析显示,与对照组相比,VEGF在AAV-VEGF组和VEGF+TGF-β1组的表达显著升高(P < 0.05),在AAV-TGF-β1组中无显著变化,TGF-β1的表达在AAV-TGF-β1组和VEGF+TGF-β1组中显著升高(P < 0.05),在AAV-VEGF组中无明显变化(图 1)。

|
| 1:对照组;2:AAV-VEGF组;3:AAV-TGF-β1组;4:VEGF+TGF-β1组 图 1 Western blot检测BMSCs中VEGF和TGF-β1的蛋白表达水平比较 |
2.2 AAV-VEGF和AAV-TGF-β1诱导分化后对BMSCs细胞形态的影响
在倒置显微镜下观察各组细胞形态,未转染腺病毒表达载体的兔骨髓间充质干细胞多为长梭形,少数为多角形。单独转染AAV-VEGF和AAV-TGF-β1的BMSCs细胞密度增加,且少部分细胞由长梭形回缩成类圆形、圆形及不规则形态,在细胞内的中央位置可观察到清晰的细胞核。这种现象在AAV-VEGF和AAV-TGF-β1共转染的BMSCs细胞中更加明显,细胞密集生长并能观察到大量的圆形或类圆形细胞聚集。从对照组到单独转染、共转染VEGF+TGF-β1组,细胞质颜色逐渐加深,分化细胞显著增加(图 2)。
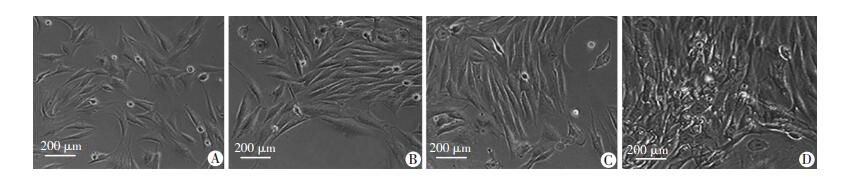
|
| A:对照组;B:AAV-VEGF组;C:AAV-TGF-β1组;D:VEGF+TGF-β1组 图 2 倒置显微镜观察各组BMSCs细胞形态 |
2.3 AAV-VEGF和AAV-TGF-β1对BMSCs细胞凋亡的影响
流式细胞术检测BMSCs细胞凋亡情况,与对照组比较,单独转染AAV-VEGF和AAV-TGF-β1的BMSCs细胞凋亡减少(P < 0.05),VEGF+TGF-β1组的BMSCs细胞凋亡较单独转染组显著降低(P < 0.01, 图 3)。
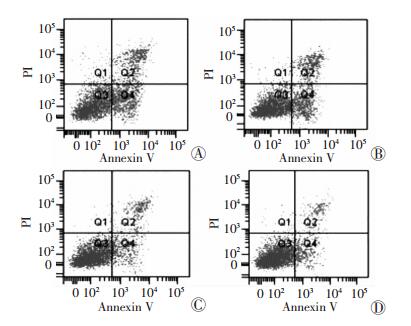
|
| A:对照组;B:AAV-VEGF组;C:AAV-TGF-β1组;4:VEGF+TGF-β1组 图 3 流式细胞术检测AAV-VEGF和AAV-TGF-β1对BMSCs细胞凋亡的影响 |
2.4 AAV-VEGF和AAV-TGF-β1对BMSCs细胞增殖的影响
CCK8检测细胞增殖情况显示,与对照组相比,AAV-VEGF组、AAV-TGF-β1组和VEGF+TGF-β1组细胞增殖能力均显著升高(P < 0.05);共转染AAV-VEGF和AAV-TGF-β1质粒的细胞比单独转染AAV-VEGF和AAV-TGF-β1的细胞增殖能力明显提高(P < 0.05,图 4)。
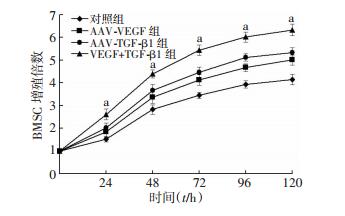
|
| a: P < 0.05,与其余3组比较 图 4 AAV-VEGF和AAV-TGF-β1对BMSCs细胞增殖的影响 |
2.5 AAV-VEGF和AAV-TGF-β1对BMSCs细胞成骨分化的影响
Western blot结果表明,与对照组相比,SOX-9、Ⅱ型胶原和蛋白聚糖的表达在AAV-VEGF组和AAV-TGF-β1组有所增加,VEGF+TGF-β1组表达显著升高(P < 0.01),VEGF+TGF-β1组表达明显高于AAV-VEGF组和AAV-TGF-β1组(P < 0.05,图 5)。

|
| 1:对照组;2:AAV-VEGF组;3:AAV-TGF-β1组;4:VEGF+TGF-β1组 图 5 Western blot检测AAV-VEGF和AAV-TGF-β1对BMSCs细胞成骨分化的影响 |
2.6 AAV-VEGF和AAV-TGF-β1对BMSCs细胞P38 MAPK信号通路的调节
Western blot检测结果表明,与对照组相比,P38、MAPKAPK2和HSP27蛋白在AAV-VEGF组和AAV-TGF-β1组表达有所增加,VEGF+TGF-β1组表达明显提高(P < 0.01),且明显高于AAV-VEGF组和AAV-TGF-β1组(P < 0.05,图 6)。

|
| 1:对照组;2:AAV-VEGF组;3:AAV-TGF-β1组;4:VEGF+TGF-β1组 图 6 Western blot检测AAV-VEGF和AAV-TGF-β1对BMSCs细胞P38 MAPK信号通路的调节 |
2.7 SB203580干扰AAV-VEGF和AAV-TGF-β1对BMSCs细胞凋亡的影响
流式细胞术检测显示,与VEGF+TGF-β1+SB组相比,VEGF+TGF-β1组细胞凋亡明显降低(P < 0.05),而SB203580组细胞凋亡显著增加(P < 0.05)(图 7)。
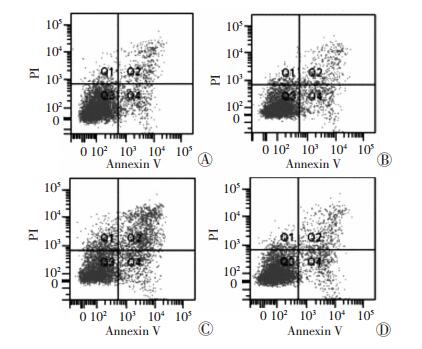
|
| A:对照组;B:VEGF+TGF-β1组;C:SB203580组;D:VEGF+ TGF-β1+SB组 图 7 流式细胞术检测SB203580干扰AAV-VEGF和AAV-TGF-β1转染对BMSCs细胞的影响 |
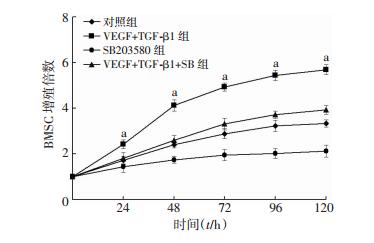
2.8 SB203580干扰AAV-VEGF和AAV-TGF-β1对BMSCs细胞增殖的影响
CCK8检测BMSCs细胞的增殖情况发现,与VEGF+TGF-β1+SB组相比,VEGF+TGF-β1组细胞增殖增加(P < 0.05),而SB203580组细胞增殖降低(P < 0.05)(图 8)。
|
| a: P < 0.05,与VEGF+ TGF-β1+SB组比较 图 8 SB203580干扰AAV-VEGF和AAV-TGF-β1转染对BMSCs细胞增殖的影响 |
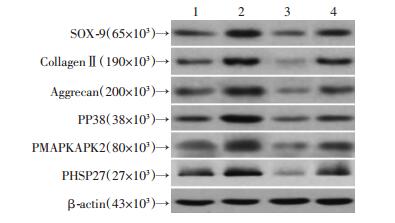
2.9 SB203580干扰AAV-VEGF和AAV-TGF-β1对软骨形成标志物及通路蛋白表达的影响
Western blot检测软骨形成标志物SOX-9、Ⅱ型胶原和蛋白聚糖的表达,以及PP38、PMAPKAPK2和PHSP27的表达显示,与VEGF+TGF-β1+SB组相比,VEGF+TGF-β1组蛋白表达明显提高(P < 0.05),而SB203580组蛋白表达显著降低(P < 0.05, 图 9)。
|
| 1:对照组;2:VEGF+ TGF-β1组;3:SB203580组;4:VEGF+ TGF-β1+SB组 图 9 Western blot检测SB203580干扰AAV-VEGF和AAV-TGF-β1对软骨形成标志物及通路蛋白表达的影响 |
3 讨论
椎间盘退变是一种伴随着下腰痛的慢性且复杂的病理过程[4]。据报道,椎间盘退变从髓核开始并以髓核细胞减少为典型特征[10],因此恢复椎间盘细胞的数量和功能成为治疗椎间盘退变疾病的关键[11]。BMSCs具有多向分化的潜能,能增殖分化为类髓核细胞,并具有合成ECM的功能,可促进椎间盘的修复和再生[12],因此促进BMSCs向髓核细胞分化已成为治疗脊柱退变疾病的研究热点。
TGF-β1是椎间盘维持和退化过程中的关键因子,该蛋白由一系列多肽组成,被认为是与胶原代谢关系最密切的蛋白之一[13]。TGF-β1不仅调节胶原蛋白和蛋白聚糖的合成,也影响椎间盘细胞的新陈代谢[14]。VEGF被报道能引起椎间盘组织中新血管的生成,在椎间盘突出的重吸收中发挥作用[15]。本实验结果表明,AAV-VEGF和AAV-TGF-β1能促进BMSCs增殖且促进其分化为类髓核细胞,并且,在AAV-VEGF和AAV-TGF-β1的共转染组中效果更显著,说明VEGF与TGF-β1可能参与椎间盘退变的修复和再生。
Ⅱ型胶原和蛋白聚糖是ECM的主要组成部分,也是椎间盘退变的典型标志物[16]。Ⅱ型胶原主要位于纤维环和髓核细胞内层,维持含水量和承受压力[17]。蛋白聚糖能保持椎间盘的渗透性、高度和抗压缩能力[18]。研究表明,SOX-9在椎间盘再生中起着关键作用。在软骨形成中,SOX-9是Ⅱ型胶原的增强子。腺病毒介导的SOX-9转染椎间盘细胞后,细胞增殖增加,Ⅱ型胶原和蛋白聚糖的合成也随之上调[19]。且添加生长因子,如LMP1 [20]、IGF-1[21]、GDF-5 [22]等能刺激SOX-9、Ⅱ型胶原和蛋白聚糖的过表达从而修复椎间盘。本研究中,转染腺病毒包装的VEGF和TGF-β1能上调SOX-9、Ⅱ型胶原和蛋白聚糖的表达,与前述研究结果相同,且VEGF和TGF-β1的协同作用能显著提高3种标志蛋白的表达,提示该协同作用可能在退变的椎间盘修复和再生中发挥重要作用。
据报道,P38MAPK信号通路通过改变椎间盘中合成代谢基因和抗分解代谢基因的表达,影响蛋白多糖的降解,在调节椎间盘中基质的合成与降解起着关键作用[23-24]。P38MAPK信号通路的激活依赖于TGF-β诱导的蛋白聚糖的表达[25]。本实验发现VEGF和TGF-β1的协同作用能显著上调P38MAPK信号通路中P38、MAPKAPK2和HSP27的表达,提示VEGF和TGF-β1的协同作用可能通过调节P38MAPK信号通路从而对退变的椎间盘进行修复和再生。进一步用P38MAPK的特异阻滞剂SB203580处理BMSCs,能反转VEGF和TGF-β1的协同作用对BMSCs增殖、分化及相关蛋白表达的调节,反向证实了VEGF和TGF-β1是通过增加P38MAPK通路蛋白的表达影响BMSCs的增殖和分化。
综上所述,本研究证实VEGF和TGF-β1可通过调节P38MAPK信号通路诱导BMSCs的增殖并向髓核细胞分化,且VEGF和TGF-β1的协同作用可以更显著增强BMSCs增殖和分化的能力,促进胶原蛋白和蛋白聚糖等ECM的表达,从而促进退行性脊柱的修复和再生。本研究仅在细胞水平探讨了VEGF和TGF-β1的协同作用促进BMSCs向髓核细胞分化的作用,仍需在体内试验中进一步验证VEGF和TGF-β1的协同效果。下一步研究计划建立椎间盘退变的动物模型,先预实验探索最适的包装载体和转染方法,以减少对动物的毒性伤害和副作用,再检测各项指标,分析共转染VEGF和TGF-β1对椎间盘退变动物模型的修复效果。
| [1] | Sakai D, Grad S. Advancing the cellular and molecular therapy for intervertebral disc disease[J]. Adv Drug Deliv Rev,2015, 84 : 159 –171. DOI:10.1016/j.addr.2014.06.009 |
| [2] | Smith L J, Nerurkar N L, Choi K S, et al. Degeneration and regeneration of the intervertebral disc: lessons from development[J]. Dis Model Mech,2011, 4 (1) : 31 –41. DOI:10.1016/dmm.006403 |
| [3] | Seki S, Tsumaki N, Motomura H, et al. Cartilage intermediate layer protein promotes lumbar disc degeneration[J]. Biochem Biophys Res Commun,2014, 446 (4) : 876 –881. DOI:10.1242/j.bbrc.2014.03.025 |
| [4] | Wang S Z, Rui Y F, Lu J, et al. Cell and molecular biology of intervertebral disc degeneration: current understanding and implications for potential therapeutic strategies[J]. Cell Prolif,2014, 47 (5) : 381 –390. DOI:10.1111/cpr.12121 |
| [5] | 周栩, 权正学, 罗小辑, 等. Id1基因在BMP-2维持椎间盘细胞软骨特性中的作用[J]. 第三军医大学学报,2015, 37 (20) : 2011 –2016. DOI:10.16016/j.1000-5404.201502101 |
| [6] | Dasari V R, Veeravalli K K, Dinh D H. Mesenchymal stem cells in the treatment of spinal cord injuries: A review[J]. World J Stem Cells,2014, 6 (2) : 120 –133. DOI:10.4252/wjsc.v6.i2.120 |
| [7] | Cao C, Zou J, Liu X, et al. Bone marrow mesenchymal stem cells slow intervertebral disc degeneration through the NF-κB pathway[J]. Spine J,2015, 15 (3) : 530 –538. DOI:10.1016/j.spinee.2014.11.021 |
| [8] | Yang H, Cao C, Wu C, et al. TGF-βl Suppresses Inflammation in Cell Therapy for Intervertebral Disc Degeneration[J]. Sci Rep,2015, 5 : 13254 . DOI:10.1038/srep13254 |
| [9] | Liu Y, Berendsen A D, Jia S, et al. Intracellular VEGF regulates the balance between osteoblast and adipocyte differentiation[J]. J Clin Invest,2012, 122 (9) : 3101 –3113. DOI:10.1172/JCI61209 |
| [10] | Smith L J, Gorth D J, Showalter B L, et al. In vitro characterization of a stem-cell-seeded triple-interpenetrating-network hydrogel for functional regeneration of the nucleus pulposus[J]. Tissue Eng Part A,2014, 20 (13/14) : 1841 –1849. DOI:10.1089/ten.TEA.2013.0516 |
| [11] | Freemont A, Watkins A, Le-Maitre C, et al. Current understanding of cellular and molecular events in intervertebral disc degeneration: implications for therapy[J]. J Pathol,2002, 196 (4) : 374 –379. DOI:10.1002/path.1050 |
| [12] | Skovrlj B, Qureshi S, Singh K. Mesenchymal stem cells for intervertebral disc repair and regeneration[J]. Seminars in Spine Surgery,2015, 27 (2) : 76 –81. DOI:10.1053/j.semss.2015.03.002 |
| [13] | 李锐冬, 邓忠良, 张亚梅, 等. 不同剂量TGF-β1在BMP9诱导间充质干细胞成骨分化中的作用[J]. 第三军医大学学报,2014, 36 (2) : 98 –104. DOI:10.16016/j.1000-5404.2014.02.002 |
| [14] | Setton L A, Chen J. Mechanobiology of the intervertebral disc and relevance to disc degeneration[J]. J Bone Joint Surg Am,2006, 88 (Suppl 2) : 52 –57. DOI:10.2106/JBJS.F.00001 |
| [15] | Haro H, Kato T, Komori H, et al. Vascular endothelial growth factor (VEGF)-induced angiogenesis in herniated disc resorption[J]. J Orthop Res,2002, 20 (3) : 409 –415. DOI:10.1016/S0736-0266(01)00150-4 |
| [16] | Qing C, Wei-ding C, Wei-min F. Co-culture of chondrocytes and bone marrow mesenchymal stem cells in vitro enhances the expression of cartilaginous extracellular matrix components[J]. Braz J Med Biol Res,2011, 44 (4) : 303 –310. DOI:10.1590/S0100-879X2011007500026 |
| [17] | Ahsan R, Tajima N, Chosa E, et al. Biochemical and morphological changes in herniated human intervertebral disc[J]. J Orthop Sci,2001, 6 (6) : 510 –518. DOI:10.1007/s007760100006 |
| [18] | Sivan S S, Wachtel E, Roughley P. Structure, function, aging and turnover of aggrecan in the intervertebral disc[J]. Biochim Biophys Acta,2014, 1840 (10) : 3181 –3189. DOI:10.1016/j.bbagen.2014.07.013 |
| [19] | Ciapetti G, Granchi D, Devescovi V, et al. Ex vivo observation of human intervertebral disc tissue and cells isolated from degenerated intervertebral discs[J]. Eur Spine J,2012, 21 (Suppl 1) : S10 –S19. DOI:10.1007/s00586-012-2234-y |
| [20] | Liu H, Pan H, Yang H, et al. LIM mineralization protein-1 suppresses TNF-αinduced intervertebral disc degeneration by maintaining nucleus pulposus extracellular matrix production and inhibiting matrix metalloproteinases expression[J]. J Orthop Res,2015, 33 (3) : 294 –303. DOI:10.1002/jor.22732 |
| [21] | Tao Y, Zhou X, Liang C, et al. TGF-β3 and IGF-1 synergy ameliorates nucleus pulposus mesenchymal stem cell differentiation towards the nucleus pulposus cell type through MAPK/ERK signaling[J]. Growth Factors,2015, 33 (5/6) : 326 –336. DOI:10.3109/08977194.2015.1088532 |
| [22] | Gruber H E, Hoelscher G L, Ingram J A, et al. Growth and differentiation factor-5 (GDF-5) in the human intervertebral annulus cells and its modulation by IL-1βand TNF-αin vitro[J]. Exp Mol Pathol,2014, 96 (2) : 225 –229. DOI:10.1016/j.yexmp.2014.02.005 |
| [23] | Wuertz K, Vo N, Kletsas D, et al. Inflammatory and catabolic signalling in intervertebral discs: the roles of NF-kappaB and MAP kinases[J]. Eur Cell Mater,2012, 23 : 103 –119. DOI:10.5167/uzh-61998 |
| [24] | Cheng X, Ni B, Zhang Z, et al. Polyol pathway mediates enhanced degradation of extracellular matrix via p38 MAPK activation in intervertebral disc of diabetic rats[J]. Connect Tissue Res,2013, 54 (2) : 118 –122. DOI:10.3109/03008207.2012.754886 |
| [25] | Li J, Zhao Z, Liu J, et al. MEK/ERK and p38 MAPK regulate chondrogenesis of rat bone marrow mesenchymal stem cells through delicate interaction with TGF-β1/Smads pathway[J]. Cell Prolif,2010, 43 (4) : 333 –343. DOI:10.1111/j.1365-2184.2010.00682.x |



