2. 400039 重庆,重庆市畜牧科学研究院
2. Chongqing Academy of Animal Sciences, Chongqing, 402460, China
体外细胞培养特别是规模化无血清培养技术的发展使细胞治疗的广泛应用成为可能。利用合适的生物支架复合细胞体外构建组织工程器官是未来的发展趋势。本研究以具有良好生物相容性且富含生长因子的SIS为原材料[1, 2, 3, 4, 5, 6],通过制备SIS粉末,利用自制混匀装置将1-乙基-3-(3-二甲氨丙基)碳二亚胺盐酸盐[1-Ethyl-3-(3-dimethyllaminopropyldvb)carbodiimide hydro-chloride,EDC]与SIS溶液共混后冷冻交联,成功制备了具有弹性形变能力和形态记忆功能的冷冻凝胶[7, 8, 9, 10, 11, 12]。具有水凝胶所不具备的抗压、耐钳夹、多孔结构且孔隙相通等优点。可通过挤压变形后回弹主动吸附细胞。测定其吸水率、体外降解、机械性能、微观结构及生物相容性等特征,评估其作为细胞移植载体的应用价值。
1 材料与方法 1.1 实验动物及试剂新鲜猪小肠由重庆市畜牧工程研究院饲养场提供;新生绿色荧光转基因C57/BL小鼠由第三军医大学大坪医院野战外科研究所实验动物中心购买。试剂:甲醇、三氯甲烷从科龙化工试剂公司购买(中国成都); EDC、N-羟基琥珀酰亚胺[(N-Hydroxysuccinimide,NHS)、2-(N-吗啉基)乙磺酸(2-(N-Morpholino)ethanesulfonic acid,MES)]、Ⅰ型胶原酶、中性蛋白酶从sigma公司购买(美国);cell counting kit-8(CCK-8)试剂盒从同仁化工购买(日本)。
1.2 SIS 冷冻凝胶支架的制备 1.2.1 SIS粉末的制备将新鲜猪小肠,按照文献[1]报道,首先通过机械方法去除浆膜层和肌层。甲醇和氯仿(1:1,体积比)浸泡脱脂12 h,去离子水漂洗3次。0.05%胰酶/ 0.05%EDTA室温下消化12 h,水洗3次。含0.5%SDS的生理盐水振荡4 h后,生理盐水冲洗3次。0.5%醋酸浸泡过夜,打浆机(AUX HX-PB1018,中国广东)粉碎,室温下胃蛋白酶酶解2d后过滤。滤液经两次盐析离心后取沉淀。将沉淀溶于0.1%醋酸中,8KD透析袋透析24 h,冷冻干燥机(CoolsafeTM 55&110-4L/55-9L,丹麦)冻干。最后,将冻干的SIS海绵研磨(IKA A11 basic,德国)成粉末。置入50 mL离心管中,4 ℃保存(图 1)。
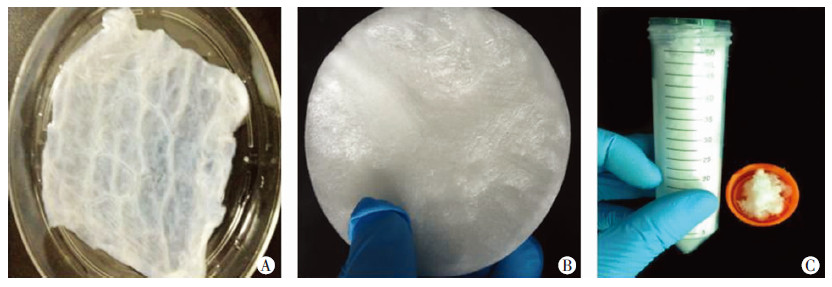 |
| A:白色半透明薄膜状SIS;B:SIS海绵;C:絮状SIS粉末 图 1 SIS粉末制备不同阶段样品大体观 |
将SIS粉末以10 mg/mL的终浓度溶于MES(0.1 mol/L,pH 5.5)缓冲液中,4 ℃ 下搅拌至完全溶解。将溶液转移至20 mL注射器,取适量不同浓度EDC/NHS交联液(EDC最终浓度梯度分别为:50、30、20、10、5 mmol/L)至另一注射器中,通过三通管相连(图 2B)。往复推注混匀。溶液体 积比:SIS:EDC:NHS=8:1:1。EDC/NHS摩尔比为 2:1。最后,将混匀的SIS溶液注入模具中(图 2C),-80 ℃ 冷冻交联24 h。室温下溶解,Na2HPO4(0.1 mmol/L) 溶液、蒸馏水各漂洗2 h。低温冷冻干燥机冻干,4 ℃保存备用。
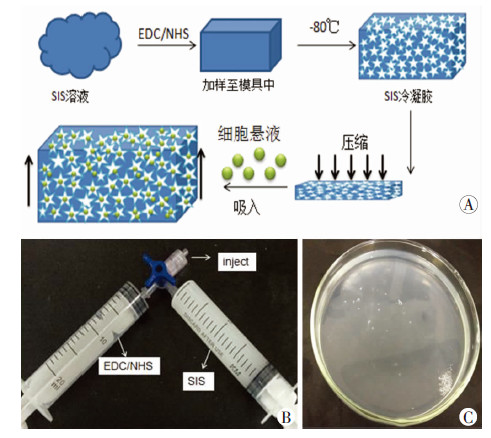 |
| A: SIS冷冻凝胶制备及细胞接种示意图;B: SIS溶液与EDC/NHS交联剂混匀装置;C: 含交联剂的SIS溶液 图 2 SIS冷冻凝胶制备过程 |
将冻干SIS 冷冻凝胶样品液氮骤冷后折断,喷金处理,15 kV加速电压下扫描电镜观察表面及横断面结构。随机选取4个视野,Image J软件分析处理孔径大小。
1.4 不同EDC浓度交联制备的SIS 冷冻凝胶物理性能检测 1.4.1 SIS 冷冻凝胶吸水率测定将冻干样品剪切成1 cm×1 cm大小。称质量(n=6)记M1,置于12孔板中,PBS浸泡过夜。用镊子小心夹起冷冻凝胶的一角,滤纸吸除表面多余水分,再次称重,记M2。按以下公式计算冷冻凝胶吸水率。冷冻凝胶吸水率=(M2-M1)/M1×100%
1.4.2 SIS 冷冻凝胶体外降解实验将1 cm× 1 cm 大小样品称质量(n=3),记M0。放入装有15 mL 降解液的离心管中,降解液[13]为:含12.5 U/mLⅠ型胶原酶的Tris-HCl(50 mmol/L,pH 7.4,含10 mmol/L氯化钙)溶液。37 ℃水浴100 r/min振荡7 d,每天取样,蒸馏水漂洗3次后冻干称质量,记Mn。按以下公式计算冷冻凝胶剩余质量百分比:剩余质量百分比=Mn/M0×100%。
1.4.3 SIS 冷冻凝胶机械性能检测将PBS水合后的冷冻凝胶剪切成直径1.5 cm高1 cm圆柱状,置于动态力学试验机(TMA 800,美国)上,以20%/min速率压缩,记录其应力及应变[14]。
1.5 SIS 冷冻凝胶体外细胞培养及黏附增殖 1.5.1 GFP转基因小鼠成纤维细胞分离培养按照文献[15]报道方法将新生GFP小鼠皮肤组织用PBS洗涤后,剪成约0.5 cm2大小。4 ℃下中性蛋白酶浸泡过夜。分离真皮组织,剪碎后用2.5 mg/mL胰蛋白酶在37 ℃下消化15 min。终止消化后离心重悬,后接种于培养瓶中。5% CO2、37 ℃恒温孵箱孵育。
1.5.2 体外细胞复合培养将不同EDC浓度交联的冷冻凝胶用75%乙醇浸泡2 h,无菌PBS漂洗。打孔器制备成直径6 mm大小,DMEM浸泡,37 ℃恒温孵箱中预培养24 h。无菌纱布挤压吸除水分后置入96孔板中。取第3代GFP成纤维细胞,调整至1×105个/mL,100 μL/孔接种在材料上。以相同处理的胶原海绵(北京益而康生物工程开发中心)为对照孔,仅含培养基的孔为空白孔。5% CO2、37 ℃恒温孵箱孵育3 d。CCK-8试剂盒检测细胞毒性:将样品转移至新的96孔板中,以排除未黏附在支架上的细胞影响,每孔加入100 μL DMEM培养基和10 μL CCK-8溶液。在37 ℃下孵育4 h后,吸取100 μL上清,用酶标仪测定在450 nm处光密度;倒置荧光显微镜观察支架上的成纤维细胞形态;4%多聚甲醛中固定24 h。乙醇逐级脱水,自然晾干后喷金,扫描电镜观察材料表面细胞情况。
1.6 统计学分析采用SPSS 13.0统计分析软件,计量资料以x±s表示,数据间比较采用单因素方差分析。
2 结果 2.1 SIS冷冻凝胶大体观察及形态记忆功能测定以3.5 cm直径培养皿为模具,3 mL/皿制备的SIS冷冻凝胶呈白色半透明状,厚0.2 cm。可被夹持提取而不破碎。冻干后体积略变小,吸水后恢复原有形态(图 3A、B、C)。以1.5 mL EP管为模具制备的直径0.6 cm、高1 cm圆柱状SIS冷冻凝胶压缩变形达85%以上仍未破碎,移除外力后立即恢复原有高度(图 3D、E、F)。而长4 mm厚2 mm大小正方形冷冻凝胶在通过注射器针头(直径1.2 mm)注射前后形态和大小均未发生改变(图 3G、H、I)。
 |
| A:直径3.5 cm,厚0.2 cm大小冷冻凝胶;B:冻干后;C:复水后;D:直径6 mm,高1 cm大小冷冻凝胶压缩前;E:压缩中;F:压缩后即刻;G:长4 mm,厚2 mm大小正方形冷冻凝胶注射前;H:12号针头;I:注射后 图 3 冷冻凝胶大体及弹性形变和形态记忆功能观察 |
SIS 冷冻凝胶表面及断层扫描提示:冷冻凝胶具 有多孔特性,且相互贯通,有利于细胞的爬行迁移及营 养物质的交换(图 4)。冷冻凝胶孔径大小在50~200 μm 之间呈正态分布,孔径大小为(106.63±28.90) μm。
 |
| A:表面; B:断面 图 4 扫描电镜观察冷冻凝胶变化 |
不同浓度EDC交联的冷冻凝胶吸水率差异无统计学意义(P>0.05),吸水率为 (6150.42±573.70)%(图 5A)。随着EDC浓度升高,降解速率逐渐减缓,第7天时EDC浓度为5、10、20、30、50 mmol/L 的各组材料剩余质量百分比分别为16.64%、33.29%、56.57%、 71.67%、74.71%,差异有统计学意义(P < 0.01)。30 mmol/L和50 mmol/L组降解速率差异无统计学意义(P>0.05,图 5B)。
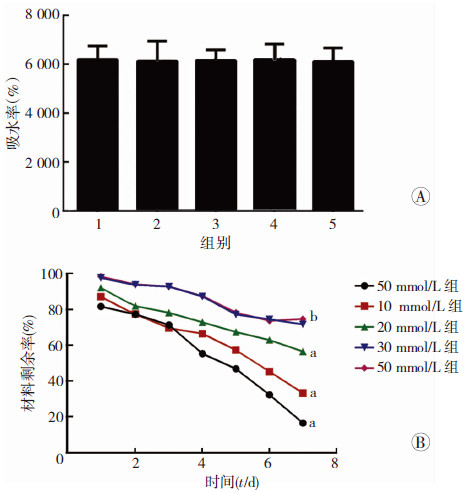 |
| 2:5 mmol/L组;2: 10 mmol/L组;3: 20 mmol/L组;4: 30 mmol/L组;5: 50 mmol/L组 A: 不同浓度组吸水率比较;B:不同时间材料剩余率比较 a: P < 0.01,与50 mmol/L组比较 图 5 不同浓度组EDC对冷冻凝胶吸水率及体外降解速率的影响 |
SIS 冷冻凝胶机械性能随着EDC浓度升高逐渐增强,表现为弹性模量的提升,压缩达80%时压缩模量分别为(1.304±0.029)、(1.556±0.042)、(1.978±0.170)、(2.103±0.043)、(2.868±0.113) kPa(P < 0.01,图 6A)。应力-应变曲线进一步证实冷冻凝胶具有回弹复原能力(图 6B)。
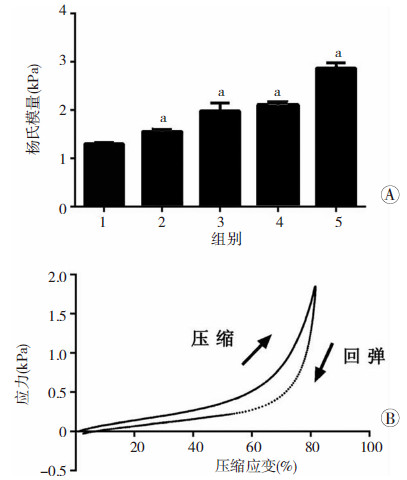 |
| A:不同浓度EDC弹性模量比较 1:5 mmol/L组;2: 10 mmol/L组;3: 20 mmol/L组;4: 30 mmol/L组;5: 50 mmol/L组;a: P < 0.01,与5 mmol/L组比较;B: 30 mmol/L组应力-应变曲线分析 图 6 冷冻凝胶机械性能检测结果 |
CCK-8检测光密度值提示:不同浓度EDC交联SIS 冷冻凝胶光密度值差异无统计学意义(P>0.05,图 7)。
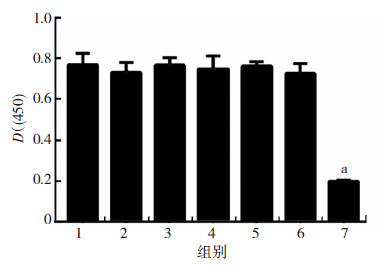 |
| 1:对照组;2:5 mmol/L组;3: 10 mmol/L组;4: 20 mmol/L组; 5: 30 mmol/L组;6: 50 mmol/L组;7: 空白对照组 a:P < 0.05,与对照组比较 图 7 CCK-8检测不同浓度组EDC交联SIS冷冻凝胶胞生长变化 |
小鼠原代GFP成纤维细胞体外复合培养3 d后荧光显微镜下可见SIS冷冻凝胶呈网状,细胞均匀分散在材料内部,且位于不同层次,导致部分细胞轮廓清晰,部分模糊。扫描电镜观察可见未接种细胞的冷冻凝胶呈多孔状,表面光洁。接种细胞材料表面可见细胞黏附在材料表面及孔壁上,呈线形、纺锤形扁平结构,并生长出大量伪足,表面凹凸不平(图 8)。
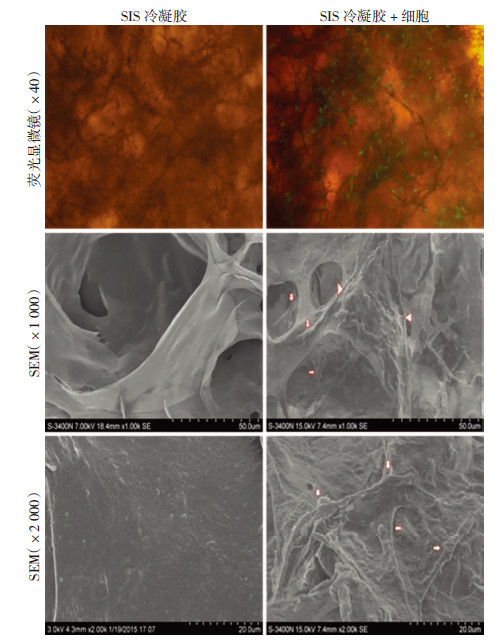 |
 :单个成纤维细胞; △:融合成片的成纤维细胞
图 8 SIS冷冻凝胶与GFP小鼠成纤维细胞体外复合培养3 d荧光显微镜及扫描电镜观察
:单个成纤维细胞; △:融合成片的成纤维细胞
图 8 SIS冷冻凝胶与GFP小鼠成纤维细胞体外复合培养3 d荧光显微镜及扫描电镜观察 |
采用冷冻交联方法制备的SIS冷冻凝胶具有弹性形变能力和形态记忆功能。与水凝胶相比,具有耐压、抗钳夹、不易碎裂等优点,与海绵相比,具有可注射特性[7, 8, 9, 11, 12],能主动回弹吸附细胞(图 2A)。目前的冷冻凝胶多以藻酸盐、明胶为原材料,通过预先接枝甲基丙烯酰胺或己二酸二酰肼,再加入引发剂快速搅拌混匀,冷冻交联而成。制备过程较复杂,需要引入额外的化学基团。由于溶液较为黏稠,搅拌时间过长易导致交联定形,时间过短则混匀不充分。且无法避免气泡产生。
本研究制备的新型冷冻凝胶以SIS为原料,以EDC为冷冻交联剂。作为一种天然的细胞外基质材料,SIS具有较好的组织相容性及较低的免疫原性,且富含生长因子,如VEGF、bFGF、TGF-β、TNF-α等,被广泛应用于膀胱、肌腱、骨膜、皮肤和腹膜缺损的修复[4]。而EDC作为一种水溶性零长交联剂,能够使胶原的氨基和羧基相连形成酰胺键,本身不残留在胶原分子中,可通过水洗去除。与文献[7, 8, 9, 10, 11, 12]报道制备的冷冻凝胶相比,无需接枝化学基团,避免了化工试剂的潜在生物毒性。我们采用自制的注射器混匀装置(图 1B),利用溶液高速通过注射器针头产生的剪切力快速混匀,并保持溶液的流动性。混匀高效充分,转移加样方便,同时避免了气泡的产生,制备更为简便。
为了进一步了解冷冻交联原理及改进交联方案,我们对不同浓度EDC制备的冷冻凝胶生物、物理性能进行了检测。结果表明不同制备参数的SIS冷冻凝胶吸水率、细胞毒性相同,降解速率和机械强度不同。EDC在冷冻状态下同SIS从水溶液中析出,而水分子则形成冰晶致孔。在半溶解状态下发生交联反应,使溶液固化定形。室温下冰晶溶解后形成孔隙相通的多孔结构[10](图 1A)。而EDC并不接枝到材料中,且可通过漂洗去除。因而对冷冻凝胶的吸水率和生物相容性无影响。而随着EDC浓度的升高,材料交联度相应提高,从而使冷冻凝胶机械强度提高,降解速度减缓。细胞与支架体外共培养荧光显微镜及扫描电镜提示细胞能够在支架上黏附生长。
综上所述,我们研发的SIS 冷冻凝胶,具有弹性形变能力和形态记忆功能,生物相容性良好。耐压、抗钳夹,不易碎裂,便于移植。制备简易,易于生产。在皮肤修复及注射填充方面有很好的应用前景。
| [1] | Luo J C, Chen W, Chen X H, et al. A multi-step method for preparation of porcine small intestinal submucosa (SIS)[J]. Biomaterials, 2011, 32(3): 706-713. DOI:10.1016/ j.biomaterials. 2010.09.017 |
| [2] | Wu S, Liu Y, Bharadwaj S, et al. Human urine-derived stem cells seeded in a modified 3D porous small intestinal submucosa scaffold for urethral tissue engineering[J]. Biomaterials, 2011, 32(5): 1317-1326. DOI:10.1016/ j.biomaterials. 2010.10.006 |
| [3] | Choi J W, Park J K, Chang J W, et al. Small intestine submucosa and mesenchymal stem cells composite gel for scarless vocal fold regeneration[J]. Biomaterials, 2014, 35(18): 4911-4918. DOI:10.1016/j.biomaterials.2014.03.008 |
| [4] | Kim K S, Lee J Y, Kang Y M, et al. Small intestine submucosa sponge for in vivo support of tissue-engineered bone formation in the presence of rat bone marrow stem cells[J]. Biomaterials, 2010, 31(6): 1104-1113. DOI:10.1016/ j.biomaterials. 2009.10.020 |
| [5] | Zhang J, Wang G Y, Xiao Y P, et al. The biomechanical behavior and host response to porcine-derived small intestine submucosa, pericardium and dermal matrix acellular grafts in a rat abdominal defect model[J]. Biomaterials, 2011, 32(29): 7086-7095. DOI:10.1016/j.biomaterials.2011.06.016 |
| [6] | Lin H K, Godiwalla S Y, Palmer B, et al. Understanding roles of porcine small intestinal submucosa in urinary bladder regeneration: identification of variable regenerative characteristics of small intestinal submucosa[J]. Tissue Eng Part B Rev, 2014, 20(1): 73-83. DOI: 10.1089/ten.TEB.2013. 0126 |
| [7] | Bidarra S J, Barrias C C, Granja P L. Injectable alginate hydrogels for cell delivery in tissue engineering[J]. Acta Biomater, 2014, 10(4): 1646-1662. DOI:10.1016/j.actbio. 2013.12.006 |
| [8] | Bencherif S A, Sands R W, Bhatta D, et al. Injectable preformed scaffolds with shape-memory properties[J]. Proc Natl Acad Sci USA, 2012, 109(48): 19590-19595. DOI:10.1073/pnas.1211516109 |
| [9] | Koshy S T, Ferrante T C, Lewin S A, et al. Injectable, porous, and cell-responsive gelatin cryogels[J]. Biomaterials, 2014, 35(8): 2477-2487. DOI:10.1016/j.biomaterials.2013.11.044 |
| [10] | Kirsebom H, Rata G, Topgaard D, et al. Mechanism of Cryopolymerization: Diffusion-Controlled Polymerization in a Nonfrozen Microphase. An NMR Study[J]. Macromolecules, 2009, 42(14): 5208-5214. DOI:10.1021/ ma900566d |
| [11] | Chang K H, Liao H T, Chen J P. Preparation and characterization of gelatin/hyaluronic acid cryogels for adipose tissue engineering: in vitro and in vivo studies[J]. Acta Biomater, 2013, 9(11): 9012-9026. DOI:10.1016/ j.actbio. 2013.06.046 |
| [12] | Thornton A J, Alsberg E, Albertelli M, et al. Shape-defining scaffolds for minimally invasive tissue engineering[J]. Transplantation, 2004, 77(12): 1798-1803. |
| [13] | Li J, Ren N, Qiu J, et al. Carbodiimide crosslinked collagen from porcine dermal matrix for high-strength tissue engineering scaffold[J]. Int J Biol Macromol, 2013, 61: 69-74. DOI:10.1016/j.ijbiomac.2013.06.038 |
| [14] | Zhao X, Kim J, Cezar C A, et al. Active scaffolds for on-demand drug and cell delivery[J]. Proc Natl Acad Sci USA, 2011, 108(1): 67-72. DOI:10.1073/pnas.1007862108 |
| [15] | Xu R, Luo G, Xia H, et al. Novel bilayer wound dressing composed of silicone rubber with particular micropores enhanced wound re-epithelialization and contraction[J]. Biomaterials, 2015, 40: 1-11. DOI:10.1016/j.biomaterials. 2014.10.077 |



