骨形态发生蛋白(bone morphogenetic proteins, BMPs)由Urist[1]发现并命名,被认为是在肌肉等软组织中诱导异位骨化的因子。随后BMPs被证实也参与机体的多种器官组织的发育和形成,在机体中的多种细胞中发挥广泛的生物作用[2]。近年BMPs的成骨功能被广泛研究,证实其在骨骼肌肉系统许多部位的稳定发育中起着关键作用。人类由于ACVR1基因变异导致骨形态发生蛋白1型受体(BMPR1/alk2)持续激活,可引起进行性骨化性纤维发育不良(fibro-dysplasia ossificansprogressiva, FOP)表现为进展性、广泛的出生后软组织的骨化,目前尚无有效的治疗手段[3]。动物实验中,成骨细胞与软骨细胞是骨骼肌肉系统中最重要的组成部分,参与并调控骨的生成和功能。BMPs对骨形成、骨吸收、骨量、骨质量等的影响主要通过这两种细胞来实现。骨发生蛋白1A型受体BMPR1A(也叫做Alk-3、Brk-1)与BMPs和BMPRⅡ(骨形态发生蛋白Ⅱ型受体,同属于转化生长因子-β(TGF-β)家族,含有保守丝氨酸/苏氨酸激酶结构域[4],是骨形态发生蛋白2、4(BMP2、BMP4)的强有力的受体,直接影响BMP2、BMP4在通路中的作用。不管在成骨细胞中以何种方式干预BMP信号通路,均可或多或少达到增加骨量的效果。但是,在骨量增加的同时,小鼠的骨质量也需要探讨,理所当然地认为骨量增加的同时骨质量也同样增加是不可行的,且骨质量是维持骨组织功能的最根本的指标,骨质量稳定才能完成骨组织的职能。分化成熟的成骨细胞合成并分泌胞外基质蛋白,包括各种胶原和非胶原蛋白,形成类骨质,启动骨的形成。成年机体的骨形成,受到严格的调控以维持骨的稳态。成骨细胞数量和功能的异常,都会破坏骨稳态[5-6]。本实验以骨形态发生蛋白1A型受体基因位点(BMPR1AFX+/+)小鼠为观察对象,以3.2 kb collagen1-Cre为启动子,得到在成骨细胞中特异性敲除BMPR1A的小鼠模型,以发育早期(1个月)为观察时相点,分析BMPR1A介导的通路对成骨细胞终末分化的影响,以期为临床应用BMP通路对骨质疏松等疾病进行干预和治疗提供一定的理论研究基础。
1 材料与方法 1.1 主要材料实验动物为BMPR1AFX+/+基因型小鼠与3.2 kb-CreERTM小鼠,Masson三色染色试剂盒(上海榕柏生物技术有限公司),茜素红、硝酸银(上海生工公司),天狼星红、地塞米松、抗坏血酸(美国Sigma公司)、a-MEM培养基、胎牛血清(美国Gibco公司),OPN单克隆抗体、FGF23多克隆抗体(美国Santa Cruz公司),即用型SABC免疫组化染色试剂盒(武汉博士德生物工程有限公司)。
1.2 方法 1.2.1 目的小鼠获得BMPR1AFX+/+基因型小鼠与3.2kb-CreERTM小鼠(种鼠,动物批准号:0579-0036)均由美国德克萨斯州卫生科学中心Baylor医学院Jerry Feng教授惠赠。种鼠交配后,获得基因型为3.2kb-CreERTM。BMPR1AFX+/+为目的小鼠,记为cKO小鼠;另取同窝出生未含Cre的BMPR1AFX+/+或BMPR1AFX+/-基因型小鼠作为对照组,记为对照小鼠。本实验过程中共选取生长发育良好的cKO小鼠、对照组小鼠各10只,其中雌、雄各5只。以上小鼠均于第三军医大学大坪医院野战外科研究所实验动物中心饲养,饲养条件为SPF级,实验动物操作严格按照第三军医大学实验动物管理委员会许可[执行标准SYXK(军2002032)]进行。
1.2.2 小鼠胫骨半脱钙组织切片钙化结节染色(Von Kossa染色)Von Kossa矿化结节染色[7]主要用于观察切片组织矿化情况。切片常规处理至水化后,每张切片滴加2%的硝酸银溶液100μL,日光下20~30 min至矿化骨组织颜色变黑;小心吸出硝酸银溶液并按危险品处理,蒸馏水漂洗切片2 min×3次,5%硫代硫酸钠中浸泡10 s,蒸馏水漂洗1 min×3次。Van Gieson工作液浸泡5 min,并小心处理溶液。梯度酒精脱水,二甲苯透明,最后中性树胶封片。镜下观察矿化骨呈黑色,而非矿化骨呈粉红色。Van Gieson工作液:1%酸性品红(Acid Fuchsin)2.5 mL,苦味酸(溶液Picric Acid)47.5 mL。
1.2.3 小鼠胫骨标本Masson染色使用Masson三色法染色试剂盒,按说明书步骤进行操作[8]。
1.2.4 小鼠胫骨标本天狼星红染色切片常规脱蜡水化后,浸入天狼星红饱和苦味酸液30 min,无水乙醇分化与脱水,二甲苯透明、中性树脂封片。Ⅰ型胶原纤维:红色或黄色,排列紧密,具强双折光性。Ⅱ型胶原纤维:多种色彩,疏松网状、弱双折光性。Ⅲ型胶原纤维:绿色、细纤维、弱双折光性。天狼星红-饱和苦味酸液:0.5%天狼星红10 mL,苦味酸饱和水溶液90 mL。
1.2.5 细胞周期检测将培养的成骨细胞选出生长状态良好的一批[8],约80%细胞汇合程度时,使用胰酶将贴壁细胞消化,离心,PBS洗涤2次后,70%酒精-20℃固定过夜。隔日,取出固定好的细胞,PBS离心洗涤3次,加入PI染色液,室温染色30 min,置入流式细胞仪,检测细胞周期。
1.2.6 骨组织扫描电镜检测将常规固定好的小鼠胫骨用砂纸打磨光滑,随后用金刚石悬浮液振荡抛光,置于真空管中过夜,次日于骨组织表面上覆盖碳酸盐复合物,于电子显微镜下观察。
1.3 统计学分析组织切片的各种染色完成后,于Olympus BX51倒置显微镜下观察,利用其内置的彩色数码相机采集相关图像。采用SPSS 13.0统计软件,计量资料以x+s表示,组间差异比较采用独立样本t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 BMPR1A敲除小鼠骨矿化能力减弱小鼠胫骨半脱钙组织切片的钙化结节染色(Von Kossa染色)可见,无论在松质骨还是皮质骨,cKO小鼠的矿化程度都明显降低(图 1)。扫描电镜观察显示,cKO小鼠的骨细胞之间失去了正常细胞间的连接突触,无细胞与细胞间的紧密联系,骨皮质变薄且孔隙增多,失去了相互之间致密的连接(图 2)。
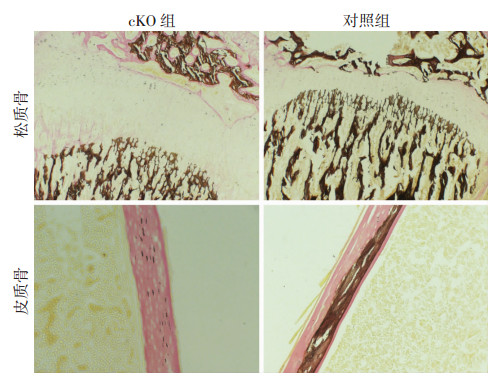
|
| 图 1 4周龄2组小鼠胫骨半脱钙组织切片钙化结节染色观察(Von Kossa染色×100) |
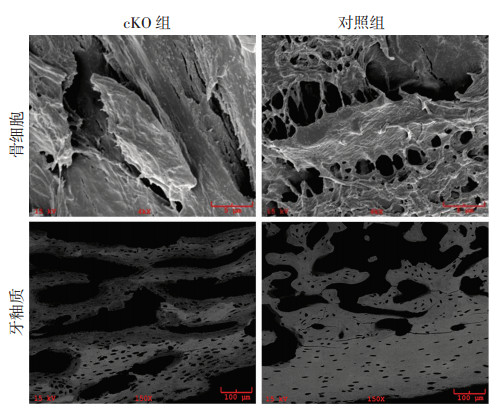
|
| 图 2 扫描电镜观察2组小鼠骨细胞及牙釉质成骨细胞形态与骨量 |
2.2 BMPR1A敲除小鼠骨胶原合成能力减弱
Masson染色发现,cKO小鼠长骨的胶原成分含量与对照组小鼠相比减弱明显(图 3)。进一步通过天狼星红染色-偏振光显微镜观察到,cKO小鼠的胶原含量与对照组相比存在差异:cKO小鼠长骨中所含胶原大多为Ⅰ型胶原,Ⅲ型胶原含量很少,而对照组小鼠则是Ⅰ型与Ⅲ型胶原混合构成,Ⅲ型胶原酶含量更多;而且cKO小鼠的胶原排列与对照组相比显得杂乱无章,失去了正常的纵向规律的排列(图 4)。
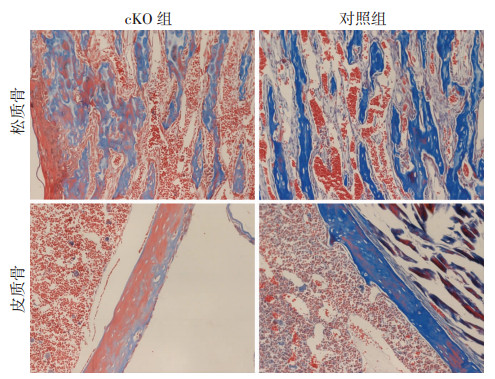
|
| 图 3 4周龄2组小鼠胫骨Masson胶原染色观察(×200) |
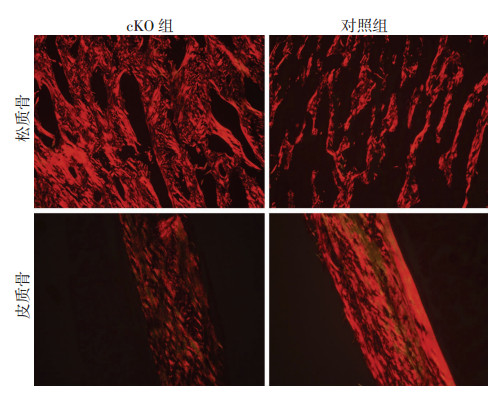
|
| 图 4 4周龄2组小鼠胫骨天狼星红-偏振光染色观察(×400) |
2.3 BMPR1A敲除小鼠骨质量下降可能原因
免疫组织化学染色观察显示,cKO小鼠骨组织中OPN(16±3)和FGF23(8±2)的表达较对照组小鼠(6±1、3±1)均明显增强(P < 0.01,图 5)。对cKO小鼠成骨细胞的细胞周期检测发现,与对照组相比,cKO小鼠成骨细胞在细胞周期中,有更多的细胞停留在了G期,cKO组为(20±3)%、对照组为(6±1)%(图 6),这可能说明在cKO小鼠成骨细胞中,有更多的细胞无法脱离G期来完成细胞增殖进而成熟分化执行骨形成的任务,而是停留在细胞周期中,继续进行增殖,导致小鼠成骨细胞数量明显增加,而执行骨形成的分化成熟的细胞减少,影响了成骨细胞的终末分化。

|
| 图 5 4周龄2组小鼠骨桥蛋白和成纤维生长因子23免疫组化染色观察(×200) |
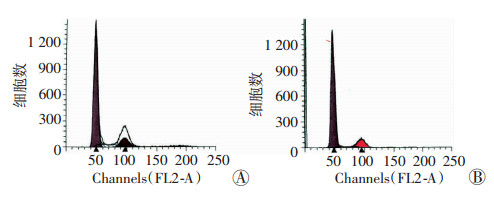
|
| A:cKO组;B:对照组 图 6 周龄小鼠分离培养成骨细胞细胞周期检测 |
3 讨论
骨质量一个综合性的指标, 不能单方面取决于骨量的多少,还与骨骼内部的成分属性及结构属性密切相关。骨的矿化程度、结晶程度及胶原特性等很大程度上决定了骨质量的强弱。成骨细胞是骨形成功能的主要执行者,研究成骨细胞的功能调控对于深入认识骨重建基本过程及骨代谢疾病的防治具有重要价值[9]。本研究发现,BMPR1A介导的BMP对于维持成骨细胞功能的完整性具有重要作用。BMPR1A基因在成骨细胞敲除后,会导致成骨细胞矿化减少、胶原合成能力减弱、骨质量下降。
OPN是成骨细胞分化成熟的重要调节因子,FGF23则是机体调节磷代谢的重要蛋白,这两种因子对骨矿化都有明显的抑制作用[10], 在BMPR1A基因敲除的成骨细胞中表达显著升高。成骨细胞矿化能力的缺陷及骨基质成分的表达减少可能造成了小鼠骨质量下降和骨机械性能的破坏。本研究对骨细胞的扫描电镜检测也证实BMPR1A敲除小鼠的骨细胞突触减少,与周围骨细胞的连接减弱,同时骨组织显得脆弱多孔,有着明显的骨机械性能的缺失。本研究还发现BMPR1A基因敲除小鼠骨胶原合成能力减弱:胶原含量方面,敲除鼠的胶原含量减少,且较多的是Ⅰ型胶原,而对照组小鼠的胶原不仅有Ⅰ型胶原,还有较多的Ⅲ型胶原成分;胶原排列方面,偏振光显微镜观测到BMPR1A敲除小鼠的胶原排列是紊乱的,没有纵向或一致性的排列,而对照组排列整齐,可以提供良好的支撑和稳定的结构。胶原组织在骨矿化的过程中起着十分重要的作用,其可以诱导许多无机物质的簇集,同时为无机晶体的聚合创造了足够的空间[9],胶原含量的减少、成分的变化、排列的紊乱,都会导致骨矿化能力的降低,对骨的质量,骨的机械性能产生负面的影响。
BMPR1A敲除小鼠的成骨细胞周期检测结果发现,敲除鼠的成骨细胞G2期明显增多,可能提示更多成骨细胞阻滞在细胞的增殖期,无法脱出细胞周期进行终末分化,进而影响了矿化和胶原合成功能,成骨细胞规律性凋亡是骨形成与骨重塑中成骨细胞终末分化的重要途径,敲除鼠的凋亡减弱,这也提示BMPR1A影响了成骨细胞终末分化的机制和功能,细胞无法进行正常的骨形成的途径,对小鼠骨质量的稳定维持和骨机械性能的维持起着负性的作用。
目前国际上关于BMP通路对骨质量的研究较少,现有研究结果[11-13]并未达成统一的说法。Kamiya等[13-14]报道在胚胎期(E18.5)成骨细胞中敲除其BMP受体BMPR1A后,E18.5小鼠颅骨矿化面积增加,颅骨厚度增加,骨质变松结构不连续。这些结果显示在长骨和扁骨中,cKO导致骨量增加,骨矿化增加。矿化面积增加,单位体积内的矿物质含量骨密度在松质骨中增加,而在皮质骨中下降。Okamoto等[15]研究发现使用2.3 kb ColI为启动子,激活BMP通路抑制剂Noggin后,Von Kossa染色显示骨化中心矿化减少,X线片提示Noggin转基因小鼠皮质骨和松质骨厚度增加,偏振光检测显示Noggin转基因小鼠的皮质骨主要是由不成熟的骨构成,其胶原纤维方向凌乱,而野生型小鼠骨质成熟,胶原纤维方向排列整齐。而本研究发现BMPR1A敲除的小鼠成骨细胞矿化减少、胶原合成能力减弱、骨质量下降。这些研究结果意味着更多的、进一步的关于BMPR1A在成骨细胞终末分化中的作用及机制的探索是很有必要的,与此同时,BMPR1A对成骨细胞终末分化的负向调控作用在临床应用BMP通路进行干预和治疗时,需要加以考虑。
| [1] | Urist M R. Bone: formation by autoinduction[J]. Science,1965, 150 (3698) : 893 –899. DOI:10.1126/science.150.3698.893 |
| [2] | Chen D, Zhao M, Mundy G R. Bone morphogenetic proteins[J]. Growth Factors,2004, 22 (4) : 233 –241. DOI:10.1016/j.abb.2014.07.011 |
| [3] | Shore E M, Xu M, Feldman G J, et al. A recurrent mutation in the BMP type I receptor ACVR1 causes inherited and sporadic fibrodysplasia ossificans progressiva[J]. Nat Genet,2006, 38 (5) : 5250 –5257. DOI:10.1038/ng1783 |
| [4] | Wagner D O, Sieber C, Bhushan R, et al. BMPs: from bone to body morphogenetic proteins[J]. Sci Signal,2010, 3 (107) : mr1 . DOI:10.1126/scisignal.3107mr1 |
| [5] | Horowitz M C, Lorenzo J A. The origins of osteoclasts[J]. Curr Opin Rheumatol,2004, 16 (4) : 464 –468. |
| [6] | 宗兆文, 陈思旭, 贾敏, 等. Osterix在调控脊柱发育中的作用[J]. 第三军医大学学报,2013, 35 (3) : 220 –222. DOI:10.16016/j.1000-5404.2013.03.008 |
| [7] | 陈思旭, 宗兆文, 贾敏, 等. Osterix基因敲除及过表达对小鼠脊椎骨量的影响[J]. 第三军医大学学报,2013, 35 (21) : 2306 –2309. DOI:10.16016/j.1000-5404.2013.21.030 |
| [8] | Chen S, Feng J, Bao Q, et al. Adverse Effects of Osteocytic Constitutive Activation of-Catenin on Bone Strength and Bone Growth[J]. J Bone Miner Res,2015, 30 (7) : 1184 –1194. DOI:10.1002/jbmr.2453 |
| [9] | Yoon B S, Ovchinnikov D A, Yoshii I, et al. Bmpr1a and Bmpr1b have overlapping functions and are essential for chondrogenesis in vivo[J]. Proc Natl Acad Sci USA,2005, 102 (14) : 5062 –5067. DOI:10.1073/pnas.0500031102 |
| [10] | Jing J, Hinton R J, Feng J Q. Bmpr1a Signaling in Cartilage Development and Endochondral Bone Formation[J]. Vitam Horm,2015, 99 : 273 –291. DOI:10.1016/bs.vh.2015.06.001 |
| [11] | Olivares-Navarrete R, Hyzy S L, Pan Q, et al. Osteoblast maturation on microtextured titanium involves paracrine regulation of bone morphogenetic protein signaling[J]. J Biomed Mater Res A,2015, 103 (5) : 1721 –1731. DOI:10.1002/jbm.a.35308 |
| [12] | Takano M, Otsuka F, Matsumoto Y, et al. Peroxisome proliferator-activated receptor activity is involved in the osteoblastic differentiation regulated by bone morphogenetic proteins and tumor necrosis factor-α[J]. Mol Cell Endocrinol,2012, 348 (1) : 224 –232. DOI:10.1016/j.mce.2011.08.027 |
| [13] | Kamiya N, Ye L, Kobayashi T, et al. Disruption of BMP signaling in osteoblasts through type IA receptor (BMPRIA) increases bone mass[J]. J Bone Miner Res,2008, 23 (12) : 2007 –2017. DOI:10.1359/jbmr.080809 |
| [14] | Rigueur D, Brugger S, Anbarchian T, et al. The type I BMP receptor ACVR1/ALK2 is required for chondrogenesis during development[J]. J Bone Miner Res,2015, 30 (4) : 733 –741. DOI:10.1002/jbmr.2385 |
| [15] | Okamoto M, Murai J, Yoshikawa H, et al. Bone morphogenetic proteins in bone stimulate osteoclasts and osteoblasts during bone development[J]. J Bone Miner Res,2006, 21 (7) : 1022 –1033. |



