我国成年人糖尿病患病率高达11.6%[1]。血管病变是糖尿病最常见的并发症之一,同时也是糖尿病致残和致死的主要原因。高糖诱导血管内皮细胞损伤是糖尿病血管并发症发生的起始环节[2]。磷酸腺苷活化蛋白激酶(AMP-activated protein kinase,AMPK)是防治糖脂代谢紊乱相关疾病的重要靶点,近年研究发现AMPK信号通路与血管内皮细胞功能调节也有密切关系[3]。已有研究发现高糖对心肌细胞、内皮祖细胞的损伤作用与其抑制上述细胞的AMPK活性密切有关[4, 5],但AMPK活性变化在高糖诱导血管内皮细胞损伤中的作用目前尚不清楚。
藤茶(Ampelopsis grossedentata)是葡萄科蛇葡萄属中的一种野生藤本植物。我国西南地区少数民族历来就有饮用藤茶的习惯,并作为传统用药治疗感冒发热、咽喉肿痛、黄疸型肝炎等病症[6]。二氢杨梅素是藤茶中含量极为丰富(25%左右)的一种黄酮类化合物[7],现已证实二氢杨梅素具有清除氧自由基、抑菌、降血脂、抗肿瘤等多种功效[8, 9, 10],并被认为是藤茶发挥保健作用的主要活性成分。我们前期研究发现杨梅素对高糖诱导的血管内皮细胞氧化应激损伤具有保护作用[11]。基于二氢杨梅素与杨梅素在分子结构上的高度相似性,推测二氢杨梅素对高糖诱导血管内皮细胞损伤可能也具有保护效应。此外,我们研究还发现二氢杨梅素可通过激活AMPK信号通路改善骨骼肌胰岛素抵抗[12]。本研究通过高糖处理原代人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)建立高糖诱导血管内皮细胞损伤体外模型,探讨二氢杨梅素对高糖诱导血管内皮细胞凋亡的影响及其与AMPK活性变化的关系。
1 材料与方法 1.1 材料新生儿脐带由第三军医大学西南医院妇产科提供,低温保存,3 h内使用。HUVECs培养基M199、胎牛血清和胰酶(HyClone公司,美国),Ⅰ型胶原酶、内皮细胞生长因子(endothelial cell growth supplement,ECGS)、肝素钠、L-谷氨酰胺、5-氨基咪唑-4-甲酰胺-1-β-D-呋喃核糖苷(5-Aminoimidazole-4-carboxamide-1-β-D-ribofuranoside,AICAR)以及compound C(Sigma公司,美国)。分析纯葡萄糖和甘露醇(国药集团化学试剂有限公司,中国),二氢杨梅素(成都曼斯特生物科技有限公司,中国)。CCK-8试剂盒(同仁化学研究所,日本),Annexin V-FITC凋亡检测试剂盒(上海贝博生物科技有限公司,中国)。PVDF膜(Merck Millipore公司,美国),AMPK抗体、p-AMPK抗体、ACC抗体以及p-ACC抗体(SANTA公司,美国),β-actin抗体、抗小鼠IgG(H+L)以及抗兔IgG(H+L)(北京中杉金桥生物技术有限公司,中国)。
1.2 方法 1.2.1 人脐带静脉内皮细胞分离与培养 人脐静脉内皮细胞的分离与培养参照文献[11]方法进行。 1.2.2 CCK-8法检测细胞活力取5代以内的人脐静脉内皮细胞100 μL悬液接种于96孔板中,含细胞1×105/孔,培养12 h至细胞融合生长至80%后,更换培养基并加入处理因素,实验分为:正常对照组(5.56 mmol/L葡萄糖)、高糖处理组(33.36 mmol/L葡萄糖)、甘露醇高渗对照组(5.56 mmol/L葡萄糖+27.8 mmol/L甘露醇)、AMPK激动剂AICAR(10 nmol/L)+高糖处理组、二氢杨梅素(1 μmol/L)+高糖处理组、AMPK抑制剂compound C(5 mmol/L)+AICAR(10 nmol/L)+高糖处理组和AMPK抑制剂compound C(5 mmol/L)+二氢杨梅素(1 μmol/L)+高糖处理组,每组设10个复孔。处理36 h后,快速加入CCK-8试剂,37 ℃孵育显色,1 h后450 nm处测定光密度值D(450)。设正常对照组细胞的增殖活力为1,其他各组细胞的增殖活力=处理组D(450)值/正常对照组D(450)值×100%。
1.2.3 流式细胞仪测定细胞凋亡细胞培养及分组同1.2.2。处理结束后收集各组细胞,1 000 r/min低温离心10 min,吸弃上清后加入结合液重悬细胞,而后分别加入Annexin V-FITC和PI进行双染,低温避光孵育,流式细胞仪检测,Flowjo软件分析。纵轴右侧Annexin V-FITC染色阳性统计为凋亡细胞。
1.2.4 Western blot检测蛋白表达细胞培养同1.2.2,实验分组:正常对照组、高糖处理组、甘露醇高渗对照组、AICAR+高糖处理组、二氢杨梅素+高糖处理组。干预结束后,提取总蛋白并用Bradford法测定各组蛋白浓度。变性后的蛋白依次进行电泳,转膜,封闭,并用适当浓度的一抗及二抗进行孵育,最后采用VILBER LOURMAT FUSION FX5成像系统曝光。
1.3 统计学分析采用SPSS 18.0统计软件,计量资料以x±s表示,多组间比较用单因素方差分析。
2 结果 2.1 AICAR和二氢杨梅素抑制高糖诱导的HUVECs活力下降正常对照组HUVECs细胞贴壁牢固,呈梭形或多角形,鱼贯状镶嵌排列,边界清楚,折光性强,增殖状态良好。高糖处理组细胞稀疏,形态皱缩呈不规则状,散在排列,折光性减弱,伴有死亡细胞及碎片成分。甘露醇高渗对照组的细胞形态与正常对照组相似,表明高糖对HUVECs的影响并非由于高糖导致渗透压增加而引起。AICAR预处理组和二氢杨梅素预处理组HUVECs细胞形态较高糖处理组有明显改善(图 1)。
 |
| A:正常对照组;B:甘露醇高渗对照组;C:高糖处理组;D:AICAR+高糖处理组;E:二氢杨梅素+高糖处理组;F:compound C+AICAR+高糖处理组;G:compound C+二氢杨梅素+高糖处理组图 1 倒置显微镜下观察各组HUVECs细胞形态的变化(×100) |
与正常对照组比较,高糖处理组HUVECs活力显著下降(P<0.05),而甘露醇高渗对照组HUVECs活力无明显变化。与高糖处理组比较,AICAR预处理组和二氢杨梅素预处理组HUVECs细胞活力显著上升(P<0.05,图 2)。结果表明:高糖可导致HUVECs细胞活力显著下降,且这一抑制作用与高糖导致渗透压增加无关,而AMPK激动剂AICAR预处理和二氢杨梅素预处理可明显抑制高糖诱导的HUVECs活力降低。
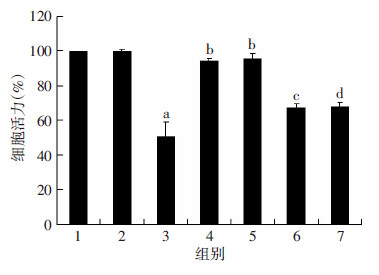 |
| 1:正常对照组;2:甘露醇高渗对照组;3:高糖处理组;4:AICAR+高糖处理组;5:二氢杨梅素+高糖处理组;6:compound C +AICAR+高糖处理组;7:compound C +二氢杨梅素+高糖处理组;a:P<0.05,与正常对照组比较; b:P<0.05,与高糖处理组比较;c:P<0.05,与AICAR+高糖处理组比较;d:P<0.05,与二氢杨梅素+高糖处理组比较图 2 CCK-8检测实验各组HUVECs细胞活力 |
与正常对照组比较,高糖处理组HUVECs细胞凋亡率明显增加(P<0.05),而甘露醇高渗对照组HUVECs细胞凋亡无明显变化。与高糖处理组比较,AICAR预处理组和二氢杨梅素预处理组HUVECs细胞凋亡率明显下降(P<0.05,图 3、4)。结果表明:高糖可导致HUVECs细胞凋亡显著增加,且这一诱导细胞凋亡作用与高糖导致渗透压增加无关,而AMPK激动剂AICAR预处理和二氢杨梅素预处理均可明显抑制高糖诱导HUVECs细胞凋亡的作用。
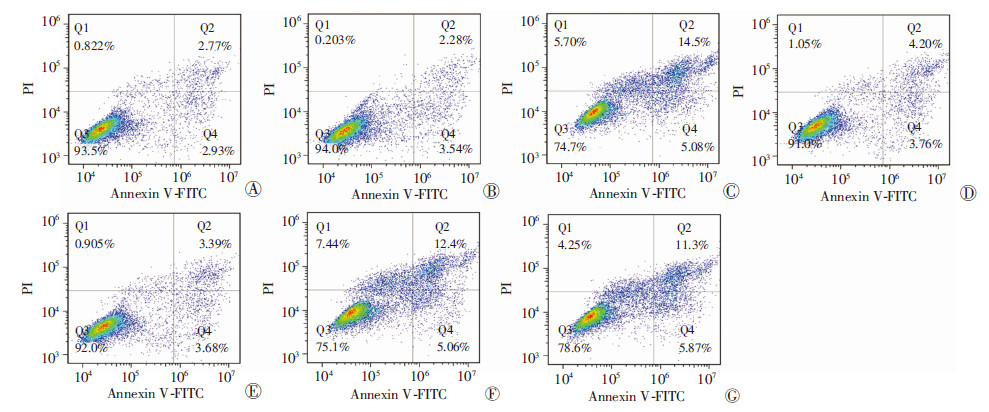 |
| A:正常对照组;B:甘露醇高渗对照组;C:高糖处理组;D:AICAR+高糖处理组;E:二氢杨梅素+高糖处理组;F:compound C +AICAR+高糖处理组;G:compound C+二氢杨梅素+高糖处理组图 3 流式细胞仪检测各组HUVECs细胞凋亡 |
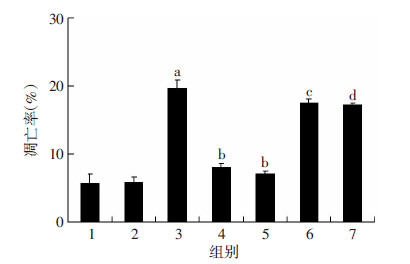 |
| 1:正常对照组;2:甘露醇高渗对照组;3:高糖处理组;4:AICAR+高糖处理组;5:二氢杨梅素+高糖处理组;6:compound C+AICAR+高糖处理组;7:compound C+二氢杨梅素+高糖处理组;a:P<0.05,与正常对照组比较; b:P<0.05,与高糖处理组比较;c:P<0.05,与AICAR+高糖处理组比较;d:P<0.05,与二氢杨梅素+高糖处理组比较图 4 各组HUVECs细胞凋亡的变化 |
与正常对照组比较,高糖处理组HUVECs细胞内的活性形式AMPK即Thr172残基磷酸化的AMPK(p-AMPK)蛋白水平显著降低(P<0.05),同时AMPK下游的直接靶蛋白乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)的磷酸化水平(p-ACC)也明显降低(P<0.05,图 5),而甘露醇高渗对照组HUVECs细胞内的p-AMPK、p-ACC蛋白水平均无明显变化。与高糖处理组比较,AICAR预处理组和二氢杨梅素预处理组HUVECs细胞p-AMPK和p-ACC蛋白水平明显增加(P<0.05)。结果表明:高糖可抑制HUVECs细胞的AMPK活性,而AMPK激动剂AICAR预处理和二氢杨梅素预处理可明显抑制高糖诱导的HUVECs细胞AMPK活性下降,提示AICAR和二氢杨梅素可能通过拮抗高糖诱导的AMPK活性下降进而抑制高糖诱导HUVECs细胞凋亡。
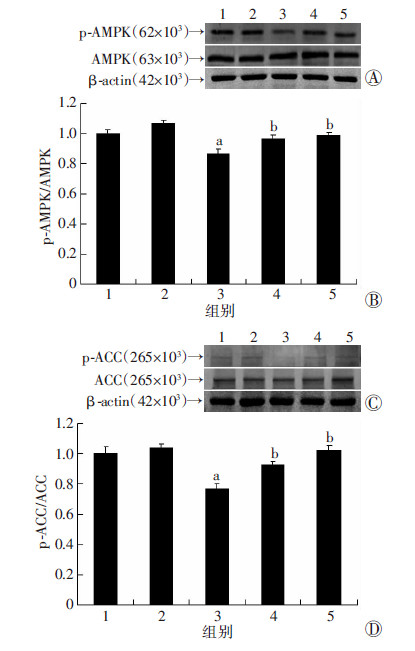 |
| 1:正常对照组;2:甘露醇高渗对照组;3:高糖处理组;4:AICAR+高糖处理组;5:二氢杨梅素+高糖处理组;a:P<0.05,与正常对照组比较;b:P<0.05,与高糖处理组比较 A:Western blot检测AMPK磷酸化水平;B:半定量分析AMPK磷酸化水平;C:Western blot检测ACC磷酸化水平;D:半定量分析ACC磷酸化水平图 5 AICAR和二氢杨梅素拮抗高糖对HUVECs细胞AMPK活性的抑制作用 |
与AICAR干预组和二氢杨梅素干预组比较,AMPK选择性抑制剂compound C预处理可明显削弱AICAR或二氢杨梅素对高糖诱导的HUVECs细胞活力下降、细胞凋亡增加的抑制作用(P<0.05)。结果表明:AICAR和二氢杨梅素对高糖诱导HUVECs细胞损伤的保护作用确实与其拮抗高糖诱导的HUVECs细胞AMPK活性下降密切有关(图 1~4)。
3 讨论糖尿病最严重的健康危害来源于微血管和大血管病变,累及主动脉、冠状动脉等大中动脉,不仅增加了心脑血管及外周血管疾病的发病风险,而且较非糖尿病患者更加严重、进展更快、预后更差。有研究表明糖尿病比非糖尿病患者罹患心脑血管疾病的几率增加2~4倍,80%~85%的糖尿病患者死于心脑血管并发症[13]。高血糖诱导血管内皮细胞损伤是糖尿病血管并发症发生的启动因子[14],保护血管内皮细胞成为了防治糖尿病血管并发症的重要策略。
AMPK是细胞的能量感受器,对细胞代谢、生长等生理功能具有重要调控作用。有研究证实高糖体外诱导H9c2心肌细胞或原代新生大鼠心肌细胞损伤,以及糖尿病小鼠心肌损伤均伴有AMPK活性的明显抑制,应用二甲双胍或白藜芦醇干预可通过激活AMPK信号通路保护高糖诱导的心肌细胞损伤[4, 15, 16]。Li等[5]研究发现:高糖诱导内皮祖细胞功能障碍伴有AMPK活性下降,肝X受体(liver X receptor,LXR)激动剂TO901317可通过激活AMPK减轻高糖诱导的内皮祖细胞功能障碍。本实验研究结果显示:高糖处理HUVECs细胞可导致其细胞活力下降、细胞凋亡增加,同时伴有AMPK及其下游直接靶蛋白ACC的磷酸化水平降低,表明高糖可抑制HUVECs细胞的AMPK活性,而AMPK激动剂AICAR预处理能显著抑制高糖诱导的HUVECs细胞活力下降及细胞凋亡增加,同时AMPK选择性抑制剂compound C预处理明显削弱AICAR对高糖诱导的HUVECs细胞活力下降及细胞凋亡增加的抑制效应,提示AMPK活性下降在高糖诱导HUVECs细胞损伤中起着重要作用,因此AMPK激动剂在糖尿病血管并发症防治当中具有潜在应用价值。
天然多酚类化合物对心血管疾病、糖尿病、肥胖等慢性病的防治作用日趋受到重视,越来越多的实验证据表明AMPK是多酚类化合物防治慢性病的重要靶点[17]。目前已发现的多酚类AMPK激活剂包括白藜芦醇、槲皮素、EGCG、姜黄素等[18]。二氢杨梅素作为藤茶中含量极高的一种黄酮类化合物(多酚类化合物中最常见的类型),我们前期研究发现二氢杨梅素可通过激活骨骼肌细胞AMPK信号通路改善骨骼肌胰岛素抵抗,以及维持骨骼肌线粒体生物合成继而改善低氧条件下的体能下降[12, 19],表明二氢杨梅素也是天然的AMPK激活剂。此外,我们前期在人群试验研究中发现,健康成年人摄入二氢杨梅素(600 mg/d)2周后,其血清中的二氢杨梅素浓度可达到2 μmol/L以上[20]。本实验研究结果显示:与AICAR相似,1 μmol/L的二氢杨梅素干预处理亦可明显抑制高糖诱导的HUVECs细胞AMPK活性降低、细胞活力下降及凋亡增加,而AMPK选择性抑制剂compound C预处理明显削弱二氢杨梅素对高糖诱导的HUVECs细胞活力下降及细胞凋亡增加的抑制效应,提示生理浓度的二氢杨梅素可通过激活AMPK对高糖诱导的血管内皮细胞凋亡产生保护作用。因此,糖尿病患者饮用藤茶可能对降低血管并发症发生风险具有一定的作用。
综上所述,AMPK活性抑制与高糖诱导血管内皮细胞活力下降、细胞凋亡增加等损伤效应密切有关,生理浓度的二氢杨梅素干预可通过激活AMPK明显抑制高糖诱导的血管内皮细胞损伤,表明饮用藤茶对降低糖尿病血管并发症发生风险具有潜在的实际应用价值,但二氢杨梅素激活AMPK保护高糖诱导血管内皮细胞损伤的确切分子机制尚需深入研究。此外,二氢杨梅素对糖尿病血管并发症的防治作用仍需动物实验和临床试验予以进一步确认。
| [1] | Xu Y, Wang L, He J, et al. Prevalence and control of diabetes in Chinese adults[J]. JAMA, 2013, 310(9): 948-959. DOI: 10.1001/jama.2013.168118 |
| [2] | Yamagishi S, Imaizumi T. Diabetic vascular complications: pathophysiology, biochemical basis and potential therapeutic strategy[J]. Curr Pharm Des, 2005, 11(18): 2279-2299. |
| [3] | Garcia-Prieto C F, Gil-Ortega M, Aranguez I, et al. Vascular AMPK as an attractive target in the treatment of vascular complications of obesity[J]. Vascul Pharmacol, 2015, 67-69: 10-20. DOI: 10.1016/j.vph.2015.02.017 |
| [4] | He C, Zhu H, Li H, et al. Dissociation of Bcl-2-Beclin1 complex by activated AMPK enhances cardiac autophagy and protects against cardiomyocyte apoptosis in diabetes[J] Diabetes, 2013, 62(4): 1270-1281. DOI: 10.2337/db12-0533 |
| [5] | Li X, Song Y, Han Y, et al. Liver X receptor agonist alleviated high glucose-induced endothelial progenitor cell dysfunction via inhibition of reactive oxygen species and activation of AMP-activated protein kinase[J]. Microcirculation, 2012, 19(6): 547-553. DOI: 10.1111/j.1549-8719.2012.00186.x |
| [6] | 陈晓明, 倪峰.藤茶药理作用研究进展[J]. 海峡药学, 2010, 22(1): 16-17. DOI: 10.3969/j.issn.1006-3765.2010.01.006 |
| [7] | 何桂霞, 裴刚, 杜方麓, 等. 藤茶化学成分的研究[J]. 中国现代中药, 2007, 9(12): 11-13. DOI: 10.3969/j.issn.1673-4890.2007.12.004 |
| [8] | 陈玉琼, 倪德江, 程倩, 等. 藤茶总黄酮及二氢杨梅素降血脂作用研究[J]. 茶叶科学, 2007, 27(3): 221-225, 242. DOI: 10.3969/j.issn.1000-369X.2007.03.007 |
| [9] | 徐静娟, 姚茂君, 许钢. 二氢杨梅素抗氧化功能的研究[J]. 食品科学, 2007, 28(9): 43-45. |
| [10] | Chang H, Peng X, Bai Q, et al. Ampelopsin suppresses breast carcinogenesis by inhibiting the mTOR signalling pathway[J]. Carcinogenesis, 2014, 35(8): 1847-1854.DOI: 10.1093/carcin/bgu118 |
| [11] | 梁馨予, 张婷, 周永, 等. 杨梅素减轻高糖诱导的血管内皮细胞氧化应激损伤[J]. 第三军医大学学报, 2013, 35(21): 2301-2305. |
| [12] | Shi L, Zhang T, Liang X, et al. Dihydromyricetin improves skeletal muscle insulin resistance by inducing autophagy via the AMPK signaling pathway[J]. Mol Cell Endocrinol, 2015, 409: 92-102. DOI: 10.1016/j.mce.2015.03.009 |
| [13] | Farbstein D, Levy A P. The genetics of vascular complications in diabetes mellitus[J]. Cardiol Clin, 2010, 28(3): 477-496. DOI: 10.1016/j.ccl.2010.04.005 |
| [14] | Brownlee M. The pathobiology of diabetic complications: a unifying mechanism[J].Diabetes, 2005, 54(6): 1615-1625. |
| [15] | Xie Z, Lau K, Eby B, et al. Improvement of cardiac functions by chronic metformin treatment is associated with enhanced cardiac autophagy in diabetic OVE26 mice[J]. Diabetes, 2011, 60(6): 1770-1778. DOI: 10.2337/db10-0351 |
| [16] | Guo S, Yao Q, Ke Z, et al. Resveratrol attenuates high glucose-induced oxidative stress and cardiomyocyte apoptosis through AMPK[J]. Mol Cell Endocrinol, 2015, 412: 85-94. DOI: 10.1016/j.mce.2015.05.034 |
| [17] | Hwang J T, Kwon D Y, Yoon S H. AMP-activated protein kinase: a potential target for the diseases prevention by natural occurring polyphenols[J]. N Biotechnol, 2009, 26(1/2): 17-22. DOI: 10.1016/j.nbt.2009.03.005 |
| [18] | Hardie D G, Ross F A, Hawley S A. AMPK: a nutrient and energy sensor thatmaintains energy homeostasis[J]. Nat Rev Mol Cell Biol, 2012, 13(4): 251-262.DOI: 10.1038/nrm3311 |
| [19] | Zou D, Chen K, Liu P, et al. Dihydromyricetin improves physical performance under simulated high altitude[J]. Med Sci Sports Exerc, 2014, 46(11): 2077-2084. DOI: 10.1249/MSS.0000000000000336 |
| [20] | Zhou Q, Chen K, Liu P, et al. Dihydromyricetin stimulates irisin secretion partially via the PGC-1α pathway[J]. Mol Cell Endocrinol, 2015, 412: 349-357. DOI: 10.1016/j.mce.2015.05.036 |



