癫痫(epilepsy,Ep)是中枢神经系统第二大疾病,以脑部神经元异常放电导致的发作性、反复性脑功能紊乱为主要表现,患者常有自发性发作的倾向[1]。全球约有5 000万患者受其困扰[2]。尽管目前有多种治疗方法,仍有约五分之一的患者不能缓解发作并最终发展为难治性癫痫。难治性癫痫治疗效果欠佳的原因是人类对其发病的分子机制研究尚未取得突破性进展,无法根据发病的中心环节寻找新的治疗方式。但不论什么机制,最终都通过神经元高度同步异常放电导致癫痫的发作,如果可以中断神经元的异常放电,则癫痫发作可以被抑制[3]。神经元的突触重塑被认为是癫痫异常放电的重要机制,而突触囊泡的异常释放可以导致异常突触重塑[4-7]。经典的抗癫痫药物左乙拉西坦,就是通过与SV2蛋白相结合,调节突触囊泡释放,从而发挥抗癫痫的作用[8-9]。
突触囊泡的释放与多种突触前膜蛋白的调控相关。Yao等[10]发现,FBXL20 (F-box and leucine-rich repeat protein 20)作为一种在中枢神经系统中广泛表达的E3泛素连接酶,通过调节突触膜胞外分泌调节蛋白1(regulating synaptic membrane exocytosis 1,RIM1)的代谢来调节突触囊泡的释放。而RIM1作为囊泡释放过程中最重要的调节因子之一,有研究提示其参与了癫痫形成[11-12]。
FBXL20的表达水平是否在癫痫患者中发生改变,其改变是否也参与到癫痫的发生、发展中,目前尚不清楚。因颞叶癫痫(temporal lobe epilepsy)多为药 物难治性癫痫,且多采用手术治疗,故本实验将在手术切除的颞叶癫痫患者及相对正常皮质中,检测FBXL20与RIM1 的表达情况;由于伦理学的限制,无法获得正常的人脑海马组织,颞叶癫痫患者海马切除由于手术量极少也难以获得,锂-匹鲁卡品大鼠模型出现自发性发作后可以很好地反映颞叶癫痫的病理特点,被广泛用 于难治性癫痫的研究。本研究观察锂-匹鲁卡品大鼠模型大脑皮层和海马组织中及癫痫患者皮质中FBXL20 的表达,探讨FBXL20在癫痫形成中的作用。
1 材料与方法 1.1 患者临床特征癫痫组:从建立的170例癫痫脑组织库中随机选取25例颞叶癫痫病灶组织标本进行研究。这些病灶组织都是癫痫患者经外科手术切除,而且患者都有临床症状和特征性脑电图改变。其中女性12例,男性13例,年龄(23.04±10.05)岁,患病年限为(12.90±7.27)年。所有癫痫灶在取材前均经术中电生理检测并定位,遵从相关标准实验方案进行[13]。研究标本从以下医院神经外科获取:重庆医科大学附属第一医院,首都医科大学天坛医院、宣武医院,第三军医大学新桥医院、大坪医院。癫痫患者的诊断和发作类型依据2001年国际抗癫痫联盟的癫痫分类,具体纳入标准为:患者对至少3种抗癫痫药物耐药,包括苯妥英钠、 卡马西平、丙戊酸钠、拉莫三嗪、托吡酯和苯巴比妥;24 h 动态脑电图、视频脑电图及术中电生理检查等确定患者脑组织有固定的异常放电部位;磁共振检查提示这些患者颅内都没占位性病变及渐进性损伤;没有癫痫以外的其他神经系统疾病。
对照组:收集重庆医科大学附属第一医院神经外科2013-2015年外科手术切除的标本。纳入标准为:既往无中枢神经系统疾病史,未使用过抗癫痫药物,经常规病理检查为相对正常的皮质。10例经减压手术后获得的正常皮质,均为脑外伤患者且无癫痫病史。其中女性4例,男性6例,年龄(29.4±11.26)岁。
两组年龄和性别差异无统计学意义(P>0.05)。所有人体标本的使用征得了患者的知情同意,所有实验动物的处理方式征得了重庆医科大学伦理委员会的批准。
1.2 癫痫动物模型的制备用锂-匹鲁卡品大鼠模型来模拟临床颞叶癫痫的发作[14-15]。在实验中,40只雄性、健康的Sprague-Dawley大鼠(体质量160~250 g)均先腹腔注射氯化锂(127 mg/kg,Sigma,USA),20 h后腹腔注射匹鲁卡品(50 mg/kg,Sigma,USA),每30分钟重复给予1次匹鲁卡品(10 mg/kg,腹腔注射),直到大鼠癫痫发作。1 h后用安定(10 mg/kg,腹腔注射,Sigma)终止发作,运用Racine评分来检测发作级别,评分达到4~5级被认为点燃成功。观察癫痫发作行为学,动物模型首次点燃后,将进入一段长约2周的潜伏期,潜伏期过后观察到自发性发作的动物被认为造模成功[15-16],选入癫痫组;2个月后仍未出现自发性发作的选入对照组。所有动物在2个月后断头取脑。
1.3 标本的准备所有取材的新鲜组织标本立即处理。用于Western blot检测的组织每例用冻存管单独包装后,立即放入液氮罐中储存;用于免疫组化及免疫荧光的组织置于4%多聚甲醛室温下固定24 h。用于免疫组化检测的组织经石蜡包埋,完成后切为连续冠状切片,厚度5 μm;用于免疫荧光检测的组织进行冰冻切片,切片厚度为10 μm。盖玻片包被多聚赖氨酸后盖于切片上,分别储存于室温及-20 ℃冰箱中。
1.4 免疫荧光双标对FBXL20定位将-20 ℃保存的冰冻组织切片取出,放入丙酮浸泡30 min,PBS冲洗5 min×3次,随后滴加0.4% Triton,放入37 ℃水浴箱中30 min,PBS冲洗5 min×3次;将切片放入修复盒中,加入枸橼酸缓冲液,放入微波炉中高火3 min,再低火15 min,完成后PBS冲洗5 min×3次,加山羊血清在37 ℃封闭3 h,弃掉血清,加入兔抗FBXL20多克隆抗体(1 ∶50)与小鼠抗MAP2(1 ∶50),或者兔抗FBXL20与山羊抗鼠GFAP抗体(1 ∶50)混合液,放入湿盒并4 ℃过夜;次日,弃掉表面液体后PBS冲洗5 min×3次,避光条件下加入TRITC标记的山羊抗小鼠抗体及FITC标记的山羊抗兔抗体(1 ∶200),37 ℃孵育2 h,PBS冲洗5 min×3次,滴加DAPI抗核抗体常温孵育10 min,PBS冲洗后配制甘油封片,运用激光共聚焦显微采集荧光图像。
1.5 免疫组织化学检测FBXL20的表达石蜡切片进行脱蜡和入水,完成后进行抗原修复:组织切片浸于二甲苯中20 min,随后依次在梯度酒精中浸泡5 min,置于3%H2O2室温孵育10 min,放入微波炉进行抗原修复。取出切片冷却,于室温下滴加山羊血清封闭液,30 min后弃掉封闭液,加入兔抗FBXL20一抗(北京博奥森公司,1 ∶50),4 ℃环境过夜,弃掉一抗后滴加山羊抗兔二抗,37 ℃环境孵育1 h,随后滴加SABC复合物(北京中杉公司)显色。运用Olympus PM20全自动显微镜(日本Olympus)在200倍及400倍视野下观察,阳性标准为细胞膜或细胞质染成棕色或黄色。采用Image Pro Plus软件计算切片平均光密度值。
1.6 Western blot检测FBXL20、RIM1蛋白表达变化对每例组织标本逐一进行检测。每例组织加入蛋白提取液(碧云天公司)后匀浆,提取总蛋白后检测浓度并配平。蛋白样品上样于聚丙烯酰胺凝胶系统电泳,完成后电转3 h至PVDF膜。将膜置于5%脱脂牛奶中封闭1 h,结束后滴加兔抗FBXL20一抗(1 ∶450,北京博奥森公司),兔抗RIM1一抗(1 ∶900,Proteintech公司),兔抗GAPDH抗体(1 ∶2 000,Proteintech公司),4 ℃过夜。随后TBST洗膜20 min,在膜上孵育HRP标记羊抗兔二抗(1 ∶3 500,Proteintech公司),2 h后运用ECL显色。运用Quantity One软件用来检测条带光密度值,分析每组FBXL20、RIM1与GAPDH的平均光密度值(FBXL20/GAPDH、RIM1/GAPDH)。
1.7 统计学方法计量资料以x±s表示,采用SPSS 19.0统计软件进行单因素方差分析。
2 结果 2.1 动物模型的行为学表现大鼠首次注射匹鲁卡品约14 d后出现自发性发作,自发性发作标准为无明显诱因动物出现湿狗样抖动、前肢抖动伴强烈阵挛、四肢搔抓样动作,强烈体颤伴跌倒等。造模后有23只达到4/5级发作,有5只达到3/4级发作,作为癫痫组;有9只大鼠未出现自发性发作,作为对照组,死亡3只。对照组与癫痫组消除了因暴露因素所造成的差异,更能模拟颞叶癫痫的病理变化。
2.2 癫痫患者和动物模型脑组织中的免疫双标荧光结果通过免疫荧光双标检测颞叶癫痫患者大脑皮层中 FBXL20的表达部位。结果显示FBXL20(绿色)与MAP2(红色)重合,说明其在神经元中表达;不与GFAP(红色)重合,显示不在星形胶质细胞中表达(图 1)。通过免疫荧光双标检测癫痫动物模型海马及大脑皮层中FBXL20的表达部位。MAP2为神经元特异性标记物,而GFAP为星形胶质细胞特异性标记物。结果显示在海马与皮层中,FBXL20(绿色)与MAP2(红色)重合,不与GFAP(蓝色)重合(图 1)。这说明FBXL20主要表达在神经元胞质中,不在星形胶质细胞中表达。
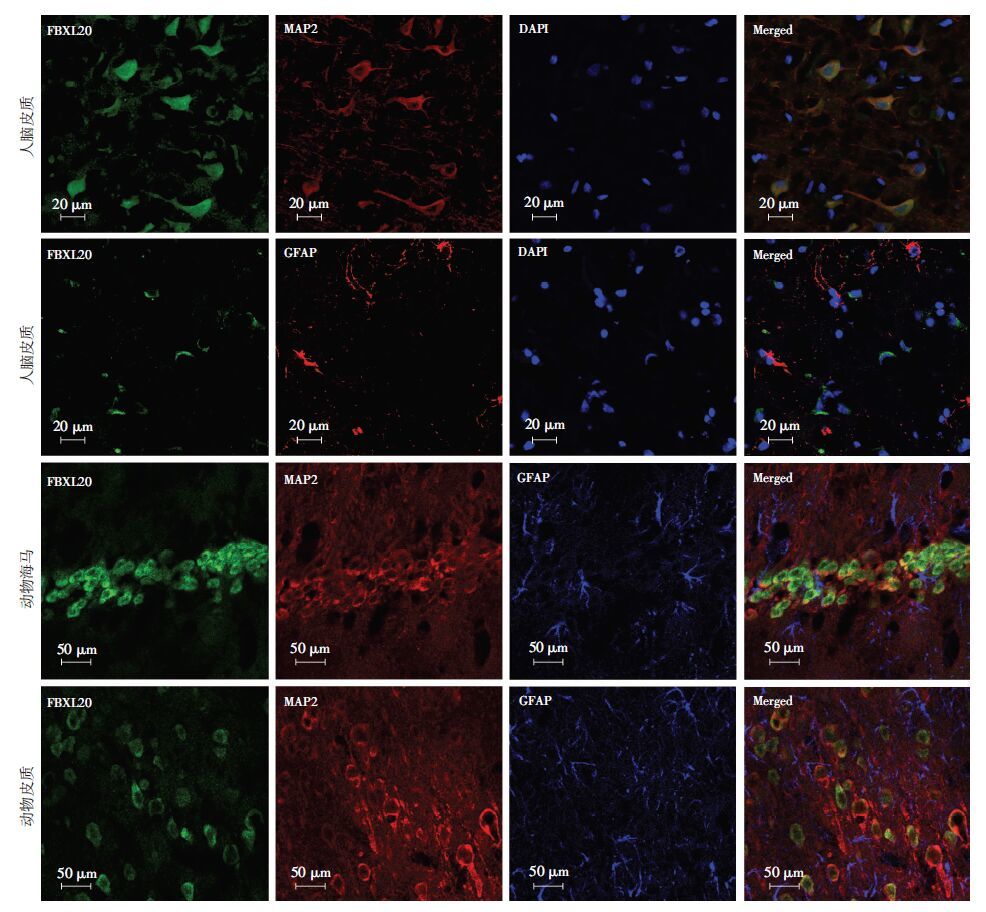
|
| 图 1 免疫荧光双标检测癫痫患者和动物模型大脑皮层中FBXL20的表达定位 (激光共聚焦显微镜) |
2.3 FBXL20在癫痫患者和动物模型中的免疫组化结果
在人脑对照组中,检测到FBXL20在神经元细胞膜和细胞质呈较强阳性表达(图 2A),而癫痫组中阳性表达较弱(图 2D)。癫痫组中FBXL20的平均光密度值明显低于对照组(P <0.05),即癫痫患者大脑皮质中FBXL20表达水平较正常人显著降低。通过免疫组化检测FBXL20在颞叶癫痫大鼠的海马和大脑皮层表达,显示FBXL20主要表达在海马与皮层的神经元中,在对照组中呈较强阳性表达,而癫痫组中阳性表达较弱,在没有加入FBXL20抗体的阴性对照组中,没有观察到阳性表达的细胞。癫痫组中FBXL20的平均光密度值明显低于对照组(P <0.05),即动物模型中FBXL20表达水平较对照组显著降低(图 2、表 1)。
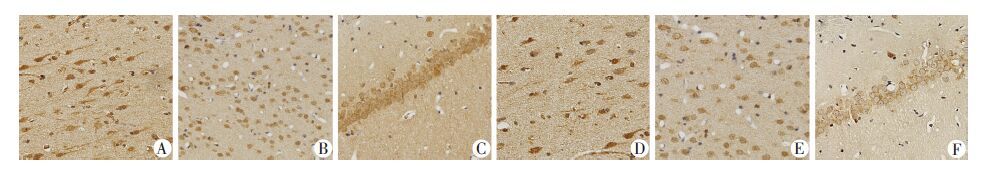
|
| A:对照组人脑皮质;B:对照组大鼠皮质(2个月);C:对照组大鼠海马(2个月);D:癫痫组患者皮质;E:癫痫组大鼠皮质(2个月);F:癫痫组大鼠海马(2个月) 图 2 免疫组化观察癫痫患者和动物模型大脑皮质、海马中FBXL20的表达 (×400) |
| 组别 | 患者皮质 | 大鼠皮质 | 大鼠海马 |
| 对照组 | 1.57±0.14(10) | 1.23±0.11(9) | 1.17±0.05(9) |
| 癫痫组 | 0.83±0.03a(25) | 0.81±0.06a(28) | 0.62±0.16a(28) |
| 括号内数据为对应例数;a:P <0.05,与对照组比较 | |||
2.4 Western blot检测癫痫患者和动物模型中FBXL20、RIM1蛋白的表达
Western blot检测FBXL20、RIM1的表达水平,用GAPDH作为内参,结果显示在(44~48)×103检测到FBXL20,在189×103检测到RIM1。检测结果用内参GAPDH标准化后显示,FBXL20在癫痫患者及大鼠模型中的表达水平较对照组明显降低(P <0.05);而RIM1较对照组则明显升高(P <0.05,图 3、表 2)。
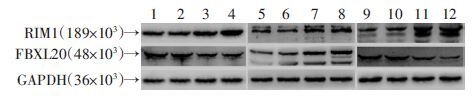
|
| 1、2:对照组患者;3、4:癫痫组患者;5、6:对照组动物皮质;7、8:癫痫组动物皮质;9、10:对照组动物海马;11、12:癫痫组动物海马 图 3 Western blot检测各组FBXL20、RIM1蛋白的表达变化 |
| 蛋白 | 组别 | 人脑皮质 | 大鼠皮质 | 大鼠海马 |
| FBXL20 | 对照组 | 1.39±0.32(10) | 2.1±0.37(9) | 1.41±0.56(9) |
| 癫痫组 | 0.41±0.13a(25) | 0.6±0.16a(28) | 0.31±0.09a(28) | |
| RIM1 | 对照组 | 0.47±0.11(10) | 0.62±0.33(9) | 1.01±0.21(9) |
| 癫痫组 | 1.21±0.35a(25) | 1.8±0.27a(28) | 1.57±0.19a(28) | |
| 括号内数据为对应例数;a:P <0.05,与对照组比较 | ||||
3 讨论
突触重塑是癫痫发病机制的重要理论之一,它是神经元选择性增强或者减弱突触的功能以应对外界刺激的过程,常通过改变突触相关受体的数量和神经递质的释放量实现[16-17]。神经递质的释放与突触囊泡释放密切相关,受多种囊泡相关蛋白调控。
RIM1即突触膜胞外分泌调节蛋白1,相对分子质量189×103,主要分布于突触前膜活性区域,参与突触囊泡释放的激活[18-19]。Xanthos等[20]研究发现RIM1活性及表达的异常可导致突触的异常重塑。FBXL20是一种广泛表达于中枢神经系统神经元兴奋性突触前膜的E3泛素连接酶,可与RIM1的C2B区结合,为RIM1贴上泛素化“标签”导致其降解[21]。
本研究以颞叶癫痫患者及锂-匹鲁卡品癫痫大鼠动物模型为研究对象,检测癫痫脑组织中FBXL20、RIM1的表达情况。免疫荧光双标结果显示,FBXL20与神经元标记物——MAP2具有共定位关系,但不与星形胶质细胞的标记物——GFAP共表达,与Takagi等[22]的研究结果一致。同时可见神经元轴突处荧光明显,而轴突是形成突触连接的重要部位,提示FBXL20可能在神经元突触连接处发挥生理作用。
进而本研究检测了癫痫患者和动物模型中FBXL20的表达水平。免疫印迹和免疫组化均发现,癫痫患者大脑皮质中FBXL20的表达量明显降低,匹鲁卡品大鼠模型脑组织中发现相同变化趋势,提示FBXL20异常表达与癫痫发生关系密切。Yao等[23]通过Cre/loxp基因敲除技术抑制小鼠脑部FBXL20的表达后,发现中枢神经元兴奋性突触后电位(mEPSC)显著增强,伴随有小鼠夜间活动增多,躁狂行为增加。这说明FBXL20可能影响了mEPSC的变化,进而导致异常的突触重塑。
在神经元突触前膜中,FBXL20主要作用是调节RIM1的代谢,影响囊泡释放。因此本研究检测了RIM1的表达变化,发现在癫痫患者及动物模型脑组织中,其表达水平较对照组明显升高。而Yao等[10]在小鼠脑组织中敲除FBXL20后也发现,RIM1半衰期延长,具有生理活性的RIM1显著升高,进而NMDA受体介导的兴奋性突触后电位(mEPSC)频率升高;当重新导入FBXL20后,RIM1的水平下降,mEPSC频率得以恢复;若同时敲除RIM1,mEPSC的相关改变则被逆转。这些研究均提示FBXL20可以通过调节RIM1的代谢,进而诱导异常突触重塑。
从本研究的结果来看,FBXL20主要表达于神经元,并且在癫痫患者和动物模型中其表达明显异常,并伴随有RIM1相应的表达变化。因此我们推测:FBXL20表达降低,使得RIM1泛素化降解减少,导致有生理活性的RIM1蓄积。蓄积的RIM1通过影响突触前膜钙离子浓度,使得NMDA受体介导的mEPSC频率和强度增加,导致突触重塑,进而参与癫痫的发生。
本研究检测了颞叶癫痫患者及大鼠模型中FBXL20的表达水平,发现FBXL20在癫痫中表达降低,并提出“FBXL20的降低可能导致了癫痫相关的突触重塑,从而引发癫痫”这一新的思路,下一步我们将在动物模型中探索其具体的分子机制。
| [1] | Leach J P, Abassi H. Modern management of epilepsy[J]. Clin Med (Lond),2013, 13 (1) : 84 –86. |
| [2] | Dulac O, Milh M, Holmes G L. Brain maturation and epilepsy[J]. Handb Clin Neurol,2013, 111 : 441 –446. DOI:10.1016/B978-0-444-52891-9.00047-6 |
| [3] | Cousin M A, Robinson P J. Mechanisms of synaptic vesicle recycling illuminated by fluorescent dyes[J]. J Neurochem,1999, 73 (6) : 2227 –2239. |
| [4] | Martin B S, Huntsman M M. Pathological plasticity in fragile X syndrome[J]. Neural Plast,2012, 2012 : 275630 . DOI:10.1155/2012/275630 |
| [5] | Holderith N, Lorincz A, Katona G, et al. Release probability of hippocampal glutamatergic terminals scales with the size of the active zone[J]. Nat Neurosci,2012, 15 (7) : 988 –997. DOI:10.1038/nn.3137 |
| [6] | Frank C A. How voltage-gated calcium channels gate forms of homeostatic synaptic plasticity[J]. Front Cell Neurosci,2014, 8 : 40 . DOI:10.3389/fncel.2014.00040 |
| [7] | Upreti C, Otero R, Partida C, et al. Altered neurotransmitter release, vesicle recycling and presynaptic structure in the pilocarpine model of temporal lobe epilepsy[J]. Brain,2012, 135 (Pt 3) : 869 –885. DOI:10.1093/brain/awr341 |
| [8] | Janz R, Goda Y, Geppert M, et al. SV2A and SV2B function as redundant Ca2+ regulators in neurotransmitter release[J]. Neuron,1999, 24 (4) : 1003 –1016. |
| [9] | Nowack A, Malarkey E B, Yao J, et al. Levetiracetam reverses synaptic deficits produced by overexpression of SV2A[J]. PLoS One,2011, 6 (12) : e29560 . DOI:10.1371/journal.pone.0029560 |
| [10] | Yao I, Takagi H, Ageta H, et al. SCRAPPER-dependent ubiquitination of active zone protein RIM1 regulates synaptic vesicle release[J]. Cell,2007, 130 (5) : 943 –957. DOI:10.1016/j.cell.2007.06.052 |
| [11] | Girach F, Craig T J, Rocca D L, et al. RIM1α SUMOylation is required for fast synaptic vesicle exocytosis[J]. Cell Rep,2013, 5 (5) : 1294 –1301. DOI:10.1016/j.celrep.2013.10.039 |
| [12] | Pitsch J, Opitz T, Borm V, et al. The presynaptic active zone protein RIM1α controls epileptogenesis following status epilepticus[J]. J Neurosci,2012, 32 (36) : 12384 –12395. DOI:10.1523/JNEUROSCI.0223-12.2012 |
| [13] | Xu X, Yang X, Xiong Y, et al. Increased expression of receptor for activated C kinase 1 in temporal lobe epilepsy[J]. J Neurochem,2015, 133 (1) : 134 –143. DOI:10.1111/jnc.13052 |
| [14] | 詹傲, 石全红, 张超, 等. Fascin-1在颞叶癫痫大鼠中表达的变化[J]. 第三军医大学学报,2014, 36 (15) : 1587 –1591. DOI:10.16016/j.1000-5404.2014.15.023 |
| [15] | Covolan L, Mello L E. Temporal profile of neuronal injury following pilocarpine or kainic acid-induced status epilepticus[J]. Epilepsy Res,2000, 39 (2) : 133 –152. |
| [16] | 吴彬, 孙红斌. 海马苔藓纤维出芽与癫痫[J]. 实用医院临床杂志,2012, 9 (1) : 133 –135. DOI:10.3969/j.issn.1672-6170.2012.01.051. |
| [17] | Dobie F, Craig A M. A fight for neurotransmission: SCRAPPER trashes RIM[J]. Cell,2007, 130 (5) : 775 –777. DOI:10.1016/j.cell.2007.08.020 |
| [18] | Han Y, Kaeser P S, Sudhof T C, et al. RIM determines Ca2+ channel density and vesicle docking at the presynaptic active zone[J]. Neuron,2011, 69 (2) : 304 –316. DOI:10.1016/j.neuron.2010.12.014 |
| [19] | Kiyonaka S, Wakamori M, Miki T, et al. RIM1 confers sustained activity and neurotransmitter vesicle anchoring to presynaptic Ca2+ channels[J]. Nat Neurosci,2007, 10 (6) : 691 –701. DOI:10.1038/nn1904 |
| [20] | Xanthos D N, Sandkuhler J. Neurogenic neuroinflammation: inflammatory CNS reactions in response to neuronal activity[J]. Nat Rev Neurosci,2014, 15 (1) : 43 –53. DOI:10.1038/nrn3617 |
| [21] | Setou M, Yao I. SCRAPPER: an F-box protein that regulates synaptic vesicle release via RIM1 degradation[J]. Tanpakushitsu Kakusan Koso,2008, 53 (1) : 36 –43. |
| [22] | Takagi H, Setou M, Ito S, et al. SCRAPPER regulates the thresholds of long-term potentiation/depression, the bidirectional synaptic plasticity in hippocampal CA3-CA1 synapses[J]. Neural Plast,2012, 2012 : 352829 . DOI:10.1155/2012/352829 |
| [23] | Yao I, Takao K, Miyakawa T, et al. Synaptic E3 ligase SCRAPPER in contextual fear conditioning: extensive behavioral phenotyping of Scrapper heterozygote and overexpressing mutant mice[J]. PLoS One,2011, 6 (2) : e17317 . DOI:10.1371/journal.pone.0017317 |



