精子发生受许多睾丸特异性基因表达的调控。与精子发生相关的基因出现缺失、突变或表达异常都可能会导致男性不育[1-2]。在鼠和人之间,许多精子形成过程的特异性基因具有高度保守性,因而从基因敲除小鼠所获得的重要生物学信息很可能适合应用于人类不育的病因学诊断和治疗。纤维鞘钙结合酪氨酸磷酸化调节蛋白(calcium-binding and tyrosine phosphorylation-regulated protein, CABYR)结合蛋白(fibrous sheath CABYR-binding protein,FSCB)是在精子成熟过程中特异性表达并最终定位于精子鞭毛纤维鞘上的一种蛋白[3]。该蛋白与纤维鞘的主要结构蛋白AKAP4的表达时相性高度相似,具有与CABYR蛋白和钙结合能力,而且在体外可被蛋白激酶A磷酸化[4-6]。研究[7]证实,FSCB、CABYR蛋白可通过直接或间接相互作用结合装配于纤维鞘的支架蛋白AKAPs上,形成巨分子蛋白复合物,共同发挥纤维鞘的生理功能。因此,推断FSCB蛋白可能是一种参与精子鞭毛运动,与精子获能和超活化作用有关的重要蛋白[3]。本研究通过fscb敲除小鼠模型,探讨fscb基因缺失对雄性小鼠生殖功能的影响及FSCB蛋白在精子中的生物学功能,以期寻求全新的通过阻断精子纤维鞘蛋白FSCB生理功能进行避孕的药物新靶点。
1 材料与方法 1.1 实验动物野生型C57BL/6J(WT)、杂合子Fscb+/-(Het)和纯合子Fscb-/-(KO)成年雄鼠各9只及野生型C57BL/6J雌鼠84只,雄鼠8~9周龄,雌鼠8~l0周龄,性成熟,体质量25 g左右,均为前期通过CRISPR/Cas9(clustered regularly interspaced short palindromic repeats,CRISPRs)/(CRISPR-associated,Cas9)系统[8-11]靶向敲除C57BL/6J小鼠fscb基因,建立FSCB-/-动物模型,经繁育获得的实验用雄鼠[12]。本实验中涉及动物操作程序已经得到中国医学科学院医学实验动物研究所动物使用与管理委员会批准。
1.2 睾丸组织、精子涂片免疫荧光分析取野生型、杂合子和纯合子成年雄鼠各1只,脱颈法处死,无菌分离睾丸、附睾及输精管。睾丸组织常规固定、石蜡包埋,切片,在二甲苯中脱蜡和梯度乙醇中再水化后,清洗,抗原修复液修复,清洗,5% BSA+10%羊血清封闭,加入一抗(FSCB抗体,1∶400稀释,李彦锋教授美国配制[3]),组织切片4℃孵育过夜。清洗一抗,用异硫氰酸荧光素标记二抗(山羊抗豚鼠抗体,1∶400稀释,博奥生物有限公司)孵育,并加入核染试剂DAPI(1∶500),室温下染色1 h。洗去二抗和DAPI,50%甘油封片。显微镜下观察并拍照。附睾收集精子进行涂片。将精子浓度稀释为1×106/mL,置于HTF输卵管非获能培养液(ART-1006迪诺易达科技有限公司)中。根据文献[13]方法取20μL含2×104个精子,加样于多聚赖氨酸包被的玻片上,于40℃下风干,甲醇固定10 min,风干。同上方法染色后显微镜下观察并拍照。观察FSCB在睾丸组织、精子上的表达。
1.3 精子计数、活率、运动参数及形态分析取野生型、杂合子和纯合子成年雄鼠各2只,脱颈法处死,收集一侧附睾精子于1 000μL HTF输卵管获能培养液(ART-1020,迪诺易达科技有限公司)中,37℃5% CO2中进行体外获能培养90 min,应用计算机辅助精液分析(computer assisted sperm analysis, CASA)系统分析精子数量、活率及精子的运动情况,包括平均路径运动速度(VAP)、平均曲线运动速度速率(VCL)、平均直线运动速度(VSL)、精子平均头部侧摆幅值(ALH)、精子平均鞭打频率(BCF)、运动的直线性(LIN)、运动的摆动性(WOB)、运动的前向性(STR)等。每组重复4次,取平均值比较差异有无统计学意义。
1.4 体外授精能力检测 1.4.1 精卵混合取野生型、杂合子和纯合子成年雄鼠各1只,脱颈法处死后收集附睾精子于HTF输卵管获能培养液(ART-1020,迪诺易达科技有限公司)中,37℃5% CO2中获能培养90 min。将已经进行超排卵的45只野生雌鼠脱颈法处死,迅速采集卵细胞并将其移入受精皿矿物油封闭的HTF输卵管非获能培养液(ART-1006迪诺易达科技有限公司)中。每个受精皿放1只雌鼠的卵团,使用拉制的Pasteur吸管进行机械吹打使其分散,每个受精皿内含约20个卵细胞,每组准备15个受精皿。将获能精子加入受精皿中,使精子终密度为1×106 /mL,精卵混合后,放入37℃5% CO2培养箱中培养。其中12个用于精子与透明带结合实验。另外3个用于透明带完整卵细胞的授精能力定性分析。
1.4.2 精子与透明带结合的评价精卵混合培养0.5、1、3、5 h时,野生型、杂合子和纯合子各组随机取出3个培养皿,将各组培养皿中受精卵细胞团在HTF输卵管非获能培养液(ART-1006迪诺易达科技有限公司)中洗涤5次,去除过量精子,倒置显微镜(×100)下观察计数与透明带结合的精子数量。
1.4.3 透明带完整卵细胞的授精定性分析各组剩下的3个精卵混合培养皿在37℃5% CO2中孵育培养过夜。次日显微镜下统计受精卵数量。有2卵裂细胞记做授精,单细胞和异形卵记为未授精。
1.4.4 精子与无透明带卵细胞的结合评价同1.4.1方法将超排卵9只野生型C57BL/6J雌鼠脱颈处死取出卵细胞团,10μg/mL糜蛋白酶消化并在HTF液中洗涤5次,去除其透明带。卵细胞在37℃5% CO2下恢复3 h,1μmol/L Hoechst dye 33342预处理10 min,在HTF液中洗涤6次,将卵细胞移入矿物油覆盖的50μL/滴培养皿中,15枚/滴,每组3个培养皿。每1液滴中加入5μL预调整浓度的获能精子,使其终浓度为2.5×104/mL,37℃5% CO2培养箱培养40 min,洗涤4次,200×显微镜下观察计数与每一个卵细胞结合的精子个数,取平均值进行比较。
1.5 交配实验取野生型、杂合子、纯合子雄鼠各5只,分别与30只野生型C57BL/6J成年雌鼠按1∶2比例合笼交配。雌鼠每天检栓,检测2~3个发情周期,共12 d。雌鼠见栓后取出,置于另外的笼标记饲养观察。见栓15 d时对其中每组各5只小鼠,共计15只雌鼠进行解剖,查看胎儿数量并拍照;剩余每组5只雌鼠自然生仔,记录产仔数量,对比子代成年雄鼠生殖腺有无差别。如果在检测周期内雌鼠没有见栓,记录未见栓。各组对应见栓雌鼠,先保证自然出生,剩余见栓小鼠再安排取胚胎。
1.6 统计学处理采用SPSS 17.0统计软件,正态分布的计量资料以x+s表示,组间均数采用两独立样本t检验,计数资料组间比较采用χ2检验。P < 0.05为差异有统计学意义。
2 结果 2.1 各组睾丸组织及精子中FSCB蛋白表达的免疫荧光分析野生型雄鼠睾丸曲细精管近管腔区域的晚期精子细胞和精子内可见显著的FSCB蛋白绿色荧光染色,呈花环状;野生型雄鼠精子中可见精子尾部FSCB蛋白的显著荧光染色。杂合子雄鼠睾丸曲细精管及精子内FSCB蛋白表达的荧光强度与野生型相比明显减弱;纯合子雄鼠睾丸曲细精管内及精子中均未见FSCB蛋白的阳性荧光染色(图 1),表明fscb基因敲除雄鼠睾丸组织及精子中出现FSCB蛋白表达缺失,符合预期结果。

|
| 白色箭头:蓝色为精子头部核染色;红色箭头:精子鞭毛 图 1 雄鼠睾丸组织和精子涂片免疫荧光观察(DAPI染色×40) |
2.2 精子计数、运动参数及形态分析
野生型、杂合子和纯合子精子在获能培养90 min后,各组精子数、精子活动能力和运动参数差异均无统计学意义(P > 0.05,表 1)。
| 组别 | 精子浓度(1×106/mL) | 向前运动精子(%) | 非向前运动精子(%) | 不动精子(%) | 平均曲线运动速度速率(%) | 平均直线运动速度(%) | 平均路径运动速度(%) | 精子平均头部侧摆幅值(%) | 精子平均鞭打频率(%) | 运动的直线性(%) | 运动的摆动性(%) | 运动的前向性(%) |
| C57BL/6J | 92.39±19.24 | 13.10±4.35 | 16.88±5.40 | 70.02±8.93 | 16.85±3.02 | 7.48±1.55 | 10.39±2.04 | 3.70±1.10 | 10.01±0.68 | 43.75±5.94 | 63.59±1.97 | 67.79±6.74 |
| Fscb+/- | 73.73±14.90 | 17.74±8.64 | 21.39±4.47 | 60.87±12.33 | 22.69±5.52 | 10.20±2.52 | 13.81±3.25 | 4.46±1.12 | 9.23±0.92 | 43.47±6.05 | 62.88±4.71 | 66.27±5.15 |
| Fscb-/- | 90.43±20.65 | 21.87±10.46 | 30.66±10.71 | 47.39±20.84 | 25.33±6.22 | 11.10±2.59 | 14.89±3.38 | 6.05±2.57 | 9.09±0.86 | 40.44±3.21 | 60.34±2.52 | 65.50±4.67 |
2.3 体外授精能力检测 2.3.1 精子与透明带结合的评价
镜下观察精子与卵细胞透明带结合个数,各组不同时间点平均结合个数比较差异无统计学意义(P > 0.05,表 2)。
| 组别 | 0.5 h | 1 h | 3 h | 5 h |
| C57BL/6J | 2.55±0.51 | 4.50±0.66 | 5.08±1.38 | 8.55±0.33 |
| Fscb+/- | 2.82±0.32 | 5.37±0.34 | 4.73±0.25 | 8.15±1.34 |
| Fscb-/- | 1.95±0.56 | 5.65±0.34 | 5.65±0.77 | 7.82±0.59 |
2.3.2 透明带完整卵细胞的授精定性分析
精子与卵细胞培养到次日,受精卵发育形成合子。镜下观察各组卵细胞的受精率,野生型为(81.81±2.25)%(P=0.598)、杂合子为(83.48±4.55)%(P=0.742)、纯合子为(84.62±3.26)%(P=0.286),各组间比较差异无统计学意义。
2.3.3 精子与无透明带卵细胞的结合评价精子与无透明带卵细胞培养40 min后,镜下观察各组每个卵子结合的精子数,野生型为(8.55±0.33)个(P=0.327)、杂合子为(9.20±0.94)个(P=0.098)、纯合子为(7.82±0.59)个(P=0.134),各组间比较均无明显差异。
2.4 生育能力分析将基因敲除的成年雄鼠与野生型成年雌鼠合笼,大部分会在第2天早上见阴道栓。纯合子、杂合子雄鼠骑跨行为与野生型组表现一致。野生型、杂合子和纯合子对应雌鼠的受孕率、解剖每胎平均数和每窝平均自然产仔数比较差异均无统计学意义(P > 0.05,表 3)。各组雌鼠怀孕15 d后解剖其胚胎,其胚胎大小、形态等均无明显差异(图 2)。各组成年子代雄鼠的生殖腺进行观察比较,显示亦无明显差别(图 3)。
| 组别 | 母鼠受孕率 (%) |
每胎平均胚胎数 (只) |
每窝平均生仔数 (只) |
| C57BL/6J | 90 | 7.00±1.41 | 6.00±2.00 |
| Fsbc+/- | 100 | 7.33±1.53 | 6.75±1.71 |
| Fscb-/- | 100 | 7.20±1.48 | 7.80±1.30 |
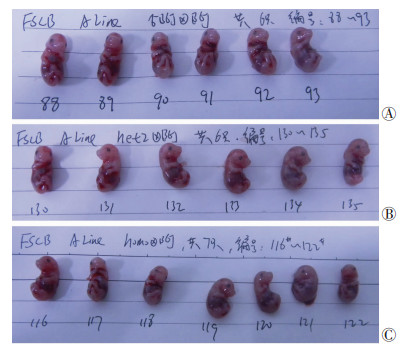
|
| A:野生型C57BL/6J雄鼠与野生型雌鼠交配获得的胚胎;B:杂合子Fsbc+/-雄鼠与野生雌鼠交配获得的胚胎;C:纯合子Fscb-/-雄鼠与野生型雌鼠交配获得的胚胎 图 2 雌鼠怀孕15 d胚胎大体观察 |
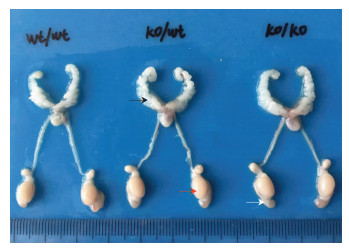
|
| 自然生产的子代野生型(WT)、杂合子(KO/WT)、纯合子(KO/KO)成年雄鼠精囊(黑色箭头)、睾丸(红色箭头)、附睾(白色箭头)等生殖腺发育均未发现明显差异 图 3 自然生产各组成年雄鼠睾丸、附睾及精囊大体观察 |
3 讨论
鼠fscb基因定位于第12条染色体的12C1区段,具有睾丸/精子特异性[3]。免疫荧光及免疫电镜研究显示FSCB阳性染色首先出现在长精细胞胞浆内,并随精子的形成向鞭毛迁移并最终定位于精子鞭毛纤维鞘的纵形柱状体和环状肋板表面[14],其定位与AKAP4的表达极其相似。研究[15]敲除AKAP4基因小鼠发现:Akap4-/-纯合子雄鼠产生的精子数量正常,但存在纤维鞘形成缺陷,表现为缩短的柱状体和稀薄的环状肋板,同时精子丧失前向运动表现为不育。本研究免疫荧光分析,发现野生型雄鼠睾丸曲细精管近管腔区域的晚期精细胞内可见花环状的免疫荧光,FSCB蛋白正常表达,与前期研究[14]结果一致;杂合子雄鼠睾丸曲细精管中的荧光强度明显低于野生型,表明杂合子雄鼠睾丸组织内的FSCB蛋白表达显著降低;而在fscb基因敲除的纯合子雄鼠睾丸组织中未见阳性染色,即FSCB蛋白表达缺失;精子免疫荧光分析也得到类似结果,表明本研究所获得的fscb基因敲除纯合子雄鼠实现了目的蛋白的表达缺失。
通常正常鼠精子经体外获能后,可发生超活化作用,表现为鞭毛的大幅度摆动,产生不对称的环形或8字形运动[16]。本研究检测fscb基因敲除雄鼠精子获能后的活率和运动参数,发现纯合子雄鼠精子各运动参数与野生型相比均未见明显改变,说明fscb基因敲除对雄鼠精子的超活化作用、精子活率和运动均无明显影响。
本研究利用体外受精实验对精子的授精能力进行了评价。在体外受精研究中,精子浓度是影响实验结果的重要因素[17-18]。在体内,由于精子需要穿过颗粒细胞层、透明带才与卵细胞膜融合,不会出现多精受精[18];在体外受精实验中,卵细胞透明带的去除,使大量精子可直接与卵细胞接触,且极易出现多精受精,所以只有在相同的适当的精子浓度情况下才准确反映实验结果。研究[19-20]显示,当精子浓度低于1×104/mL时,精-卵结合和融合的比率均极低,不利于观察和比较,而当精子浓度高于5×105/mL时,多精受精的比例大大增加,结合的精子数量较多,在镜下准确计数极为困难。故本研究选用2.5×l04/mL精子浓度下进行精卵结合实验。本研究镜下观察未出现计数困难等不利情况,精子与透明带结合不同时间点个数差异均无统计学意义(P > 0.05), 野生型、杂合子和纯合子受精率、与无透明带卵细胞结合的平均精子个数各组比较差异均无统计学意义(P > 0.05)。说明敲除fscb基因后对雄鼠精子体外受精能力不造成明显影响。
本研究进一步对纯合子雄鼠的生育能力进行了观察,结果显示敲除fscb基因后的雄鼠和野生型相比,有正常的交配能力,对应各组雌鼠怀孕率、雌鼠受孕后每胎胚胎平均数及每窝自然产仔平均数,组间差异均无统计学意义(P > 0.05);各组胚胎形态及大小也均无明显差别;各组子代成年雄鼠生殖腺的解剖观察和比较也未发现显著差别。表明敲除fscb基因后对雄鼠生育能力不造成明显影响。
目前,基因敲除技术是研究基因功能的主流技术之一,通过靶向敲除目的基因获得基因型改变的动物模型[21-22],研究目的基因的功能及探索相关疾病的发病机制。随着生物技术的发展,通过基因敲除小鼠研究发现很多基因缺失后导致精子功能丧失,引起雄性小鼠不育。但并不是所有的相关特异性基因敲除后均会引起精子生成障碍,导致男性不育。如Liu等[23]对Znf230基因敲除,未引起精子生成障碍,生育力也未发现明显异常。我们对fscb基因敲除后成年雄鼠精子活率及运动参数分析、体外受精评价和雄鼠生育能力检测、子代生殖腺发育情况观察等均未发现明显的差别。尽管前期研究[3]已经证实FSCB蛋白在精子的形成后期表达并迁移于精子尾部纤维鞘上,在获能过程中发生磷酸化作用,并具有钙结合能力,同时该蛋白能与CABYR蛋白结合形成巨分子复合物,但该基因敲除研究的相关结果提示FSCB在精子中的功能可能并非不可取代,那么,该蛋白的功能是否可以被纤维鞘上某些其他蛋白弥补或者替代?FSCB蛋白与CABYR结合的复合物在精子中的生物学功能是怎样的?这些问题需要我们进行深入探索。
| [1] | Miyamoto T, Minase G, Okabe K, et al. Male infertility and its genetic causes[J]. J Obstet Gynaecol Res,2015, 41 (10) : 1501 –1505. DOI:10.1111/jog.12765 |
| [2] | Hotaling J, Carrell D T. Clinical genetic testing for male factor infertility: current applications and future directions[J]. Andrology,2014, 2 (3) : 339 –350. DOI:10.1111/j.2047-2927.2014.00200.x |
| [3] | Li Y F, He W, Jha K N, et al. FSCB, a novel protein kinase A-phosphorylated calcium-binding protein, is a CABYR-binding partner involved in late steps of fibrous sheath biogenesis[J]. J Biol Chem,2007, 282 (47) : 34104 –34119. |
| [4] | Tseng Y T, Hsia J Y, Chen C Y, et al. Expression of the sperm fibrous sheath protein CABYR in human cancers and identification ofα-enolase as an interacting partner of CABYR-a[J]. Oncol Rep,2011, 25 (4) : 1169 –1175. DOI:10.3892/or.2011.1165 |
| [5] | Li Y F, He W, Mandal A, et al. CABYR binds to AKAP3 and Ropporin in the human sperm fibrous sheath[J]. Asian J Androl,2011, 13 (2) : 266 –274. DOI:10.1038/aja.2010.149 |
| [6] | Xu K, Yang L, Zhao D, et al. AKAP3 synthesis is mediated by RNA binding proteins and PKA signaling during mouse spermiogenesis[J]. Biol Reprod,2014, 90 (6) : 119 . DOI:10.1095/biolreprod.113.116111 |
| [7] | Li Y F, He W, Kim Y H, et al. CABYR isoforms expressed in late steps of spermiogenesis bind with AKAPs and ropporin in mouse sperm fibrous sheath[J]. Reprod Biol Endocrinol,2010, 8 : 101 . DOI:10.1186/1477-7827-8-101 |
| [8] | Wiedenheft B, Sternberg S H, Doudna J A. RNA-guided genetic silencing systems in bacteria and archaea[J]. Nature,2012, 482 (7385) : 331 –338. DOI:10.1038/nature10886 |
| [9] | Mojica F J, Diez-Villasenor C, Soria E, et al. Biological significance of a family of regularly spaced repeats in the genomes of Archaea, Bacteria and mitochondria[J]. Mol Microbiol,2000, 36 (1) : 244 –246. |
| [10] | Terns M P, Terns R M. CRISPR-based adaptive immune systems[J]. Curr Opin Microbiol,2011, 14 (3) : 321 –327. DOI:10.1016/j.mib.2011.03.005 |
| [11] | Bhaya D, Davison M, Barrangou R. CRISPR-Cas systems in bacteria and archaea: versatile small RNAs for adaptive defense and regulation[J]. Annu Rev Genet,2011, 45 : 273 –297. DOI:10.1146/annurev-genet-110410-132430 |
| [12] | 周庭友, 孙中义, 张勇, 等. 鼠fscb基因靶向敲除载体的构建及动物模型的建立[J]. 第三军医大学学报,2015, 37 (15) : 1527 –1533. DOI:10.16016/j.1000-5404.201503197 |
| [13] | Visconti P E, Bailey J L, Moore G D, et al. Capacitation of mouse spermatozoa. I. Correlation between the capacitation state and protein tyrosine phosphorylation[J]. Development,1995, 121 (4) : 1129 –1137. |
| [14] | 李彦锋, 何畏, 张军, 等. FscB蛋白在鼠精子发生过程中的动态表达和迁移研究[J]. 重庆医科大学学报,2009, 34 (9) : 1171 –1175. DOI:10.13406/j.cnki.cyxb.2009.09.007 |
| [15] | Brown P R, Miki K, Harper D B, et al. A-kinase anchoring protein 4 binding proteins in the fibrous sheath of the sperm flagellum[J]. Biol Reprod,2003, 68 (6) : 2241 –2248. |
| [16] | Turner R M. Moving to the beat: a review of mammalian sperm motility regulation[J]. Reprod Fertil Dev,2006, 18 (1/2) : 25 –38. |
| [17] | Abou-Haila A, Bendahmane M, Tulsiani D R. Significance of egg's zona pellucida glycoproteins in sperm-egg interaction and fertilization[J]. Minerva Ginecol,2014, 66 (4) : 409 –419. |
| [18] | Clark G F. Molecular models for mouse sperm-oocyte binding[J]. Glycobiology,2011, 21 (1) : 3 –5. |
| [19] | 李彦锋, 靳风烁, 江军, 等. 精子表面蛋白受精素β在精卵结合和融合中的作用研究[J]. 中国男科学杂志,2001, 15 (4) : 225 –228. DOI:10.3969/j.issn.1008-0848.2001.04.003 |
| [20] | 李彦锋, 靳风烁, 江军, 等. 精子膜蛋白Cyritestin单抗对鼠精卵结合和融合的抑制作用及其意义[J]. 第三军医大学学报,2001, 23 (7) : 833 –835. DOI:10.3321/j.issn:1000-5404.2001.07.027 |
| [21] | Baltes N J, Voytas D F. Enabling plant synthetic biology through genome engineering[J]. Trends Biotechnol,2015, 33 (2) : 120 –131. DOI:10.1016/j.tibtech.2014.11.008 |
| [22] | Osakabe Y, Osakabe K. Genome editing with engineered nucleases in plants[J]. Plant Cell Physiol,2015, 56 (3) : 389 –400. DOI:10.1093/pcp/pcu170 |
| [23] | Liu Y, Tao D, Lu Y, et al. Targeted disruption of the mouse testis-enriched gene Znf230 does not affect spermatogenesis or fertility[J]. Genet Mol Biol,2014, 37 (4) : 708 –715. DOI:10.1590/S1415-47572014005000013 |



