2. 100101北京,解放军306医院妇产科
2. Department of Obstetrics and Gynecology, No. 306 Hospital of PLA, Beijing, 100101, China
子痫前期(preeclampsia,PE)是严重威胁母婴健康的产科并发症,其发病原因尚不明确。近年来研究发现胎盘源性不良因子释放所致的血管内皮的损伤和免疫功能失调是PE发病的终末通路和关键环节[1]。蜕膜与滋养细胞氧浓度的变化直接影响妊娠早期胚胎着床时子宫内膜的侵袭,使胎盘绒毛发育不良、螺旋动脉重塑障碍,引起小血管痉挛、滋养细胞损伤,导致多种细胞因子、合体滋养细胞微泡等的过度释放,进而引起血管内皮细胞功能障碍和广泛的炎症反应,最终引发PE[2]。
合体滋养细胞胞外体(syncytiotrophoblast exosome,STBEX)是胎盘合体滋养细胞在不同因素作用下释放的一种微泡,近期已成为病理妊娠研究的热点。Rab11蛋白表达于胎盘组织中,在细胞内微泡转运、释放过程中发挥重要的介导作用[3]。目前,Rab11蛋白与STBEX在PE发病机制中的作用尚不清楚。本研究旨在初步探究缺氧时合体滋养细胞中Rab11蛋白的表达及其与STBEX的关系,为研究PE的发病机制提供新的实验室证据和线索。
1 材料与方法 1.1 主要试剂人胎盘绒毛膜癌滋养细胞系BeWo细胞(第三军医大学基础医学部生化教研室保存);Forskolin(美国Sigma公司);鼠抗HIF-1α单克隆抗体(美国Becton,Dickinson and Company);兔抗Rab11蛋白多克隆抗体(美国Abcam公司);兔抗E-cadherin单克隆抗体(武汉博士德); FITC标记山羊抗兔抗体(美国Pierce公司);缺氧培养装置(上海源叶生物科技有限公司)。
1.2 细胞培养、融合晚孕期胎盘合体滋养细胞是由滋养细胞融合而成的一种多核细胞,目前已公认BeWo代替早期胎盘细胞滋养细胞,用Forskolin融合后来模拟晚孕胎盘合体滋养细胞模型[4]。BeWo细胞在37 ℃、5%CO2孵育箱中培养,将细胞以6×106/cm2种入6孔培养板,培养48 h后,加入终浓度为50 μmol/L Forskolin,对照组加入等量DMSO,用于诱导融合。
1.3 缺氧实验及分组将BeWo细胞分为4组(n=24),①BeWo常氧组: BeWo细胞在普通培养基、常氧条件下培养;②BeWo低氧组:BeWo细胞在普通培养基、低氧条件下培养(92%N2、 5%CO2、3%O2);③融合BeWo常氧组:BeWo细胞以Forskolin合体化刺激48 h后,常氧条件下培养;④融合BeWo低氧组:BeWo细胞以Forskolin合体化刺激48 h后,低氧条件下培养(92% N2、5%CO2、3%O2)。收集细胞上清液及细胞用于下游实验。每组均重复3次。
1.4 实验方法 1.4.1 免疫荧光法鉴定融合BeWo细胞现已证实,融合BeWo细胞模拟晚孕胎盘合体滋养细胞后,细胞间黏附蛋白E-cadherin明显减少[4]。采用免疫荧光法鉴定融合BeWo细胞。BeWo细胞按上述方法培养,加入Forskolin(终浓度50 μmol/L)和DMSO(对照组)刺激48 h后取出,行免疫荧光。主要步骤:4%多聚甲醛固定、封闭、兔抗E-cadherin单克隆抗体(1:100) 4 ℃过夜、FITC标记山羊抗兔二抗体(1:200)37 ℃孵育1 h、DAPIN染核、封片。在荧光显微镜下观察照相。
1.4.2 STBEX的制备及鉴定收集细胞上清液,300×g离心10 min,去除较大细胞,2 000×g离心10 min,去除较小的沉淀细胞,4 ℃下 10 000×g超速离心60 min,以去除细胞碎片以及颗粒蛋白等,再于 4 ℃ 下 100 000×g超速离心60 min,将沉淀溶于PBS中,洗涤1次,最后于4 ℃下 100 000×g超速离心60 min,收集沉淀一部分于-80 ℃冻存备用[5]。另外 一部分用于鉴定,将STBEX稀释30倍后备用,用滴液法制片,用细吸管吸取稀释后的STBEX混悬液滴于400目铜网膜上,待样品干燥后用透射电子显微镜观察。
1.4.3 STBEX的蛋白浓度测定BCA蛋白浓度测定试剂盒测各组STBEX蛋白水平,严格按照说明书操作。
1.4.4 Western blot检测HIF-1α、Rab11蛋白的表达提取总蛋白并测定蛋白浓度,上样、转膜后室温封 闭2 h,分别与HIF-1α(1:500)、Rab11(1:500)、GAPDH (1:500) 抗体4 ℃孵育过夜。复温后加入荧光二抗(1:15 000)室温避光孵育1.5 h。洗膜后扫描条带。
1.5 统计学处理采用SPSS 17.0统计软件,数据以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验;检验水准α=0.05。
2 结果 2.1 透射电镜下观察STBEX的形态在透射电镜下观察到STBEX为一种囊泡状结构,直径在100 nm左右(图 1)。
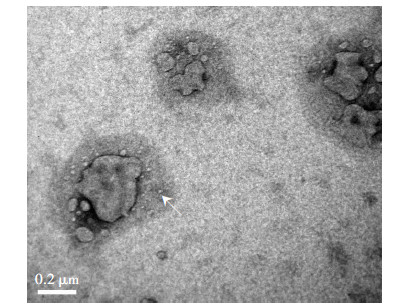 |
| ↑:示单个STBEX 图 1 透射电镜下观察STBEX的形态变化 |
与融合BeWo常氧组比较,融合BeWo低氧组上清液中STBEX的蛋白浓度升高,差异具有统计学意义(P < 0.05);与BeWo常氧组比较,BeWo低氧组上清液中STBEX蛋白浓度升高,差异具有统计学意义(P < 0.05,图 2)
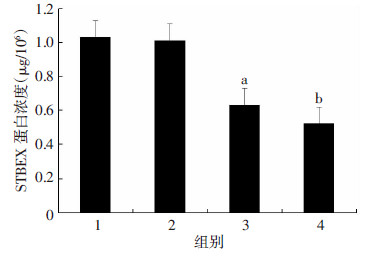 |
| 1:融合BeWo低氧组;2:BeWo低氧组;3:融合BeWo常氧组; 4: BeWo常氧组 a:P < 0.05,与融合BeWo低氧组比较;b: P < 0.05,与BeWo低氧组比较 图 2 各组细胞上清液中STBEX的蛋白浓度 (n=24,x±s) |
与对照组BeWo细胞中相比,Forskolin组绿色荧光斑点数量明显减少(图 3)。
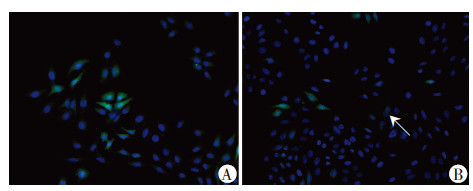 |
| A:未融合BeWo细胞组;B:Forskolin处理组 ↑:示融合的细胞核 图 3 免疫荧光检测各组细胞中E-cadherin表达 (荧光显微镜 ×400) |
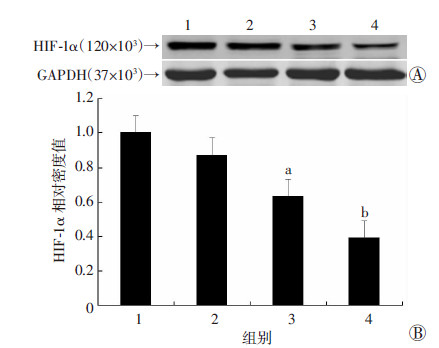
与融合BeWo常氧组比较,融合BeWo低氧组中HIF-1α蛋白表达升高,差异具有统计学意义(P < 0.05);与BeWo 常氧组比较,BeWo低氧组中HIF-1α蛋白表达升高,差异具有统计学意义(P < 0.05,图 4)。
 |
|
1:融合BeWo低氧组;2:BeWo低氧组;3:融合BeWo常氧组; 4:BeWo常氧组 A:Western blot 检测结果;B:半定量分析(n=24,x±s)a: P < 0.05,与融合BeWo低氧组比较;b: P < 0.05,与BeWo 低氧组比较 图 4 Western blot检测缺氧处理前后各组HIF-1α的表达 |
与融合BeWo常氧组比较,融合BeWo低氧组中Rab11蛋白表达升高,差异具有统计学意义(P < 0.05);与BeWo常氧组比较,BeWo低氧组中Rab11蛋白表达升高,差异具有统计学意义(P < 0.05,图 5)。
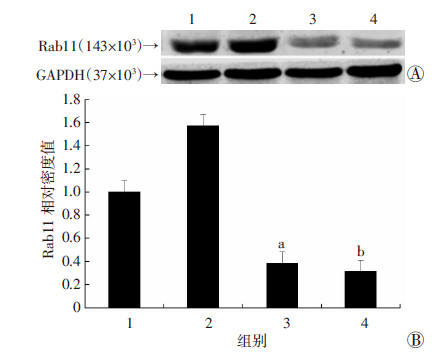 |
|
1:融合BeWo低氧组;2:BeWo低氧组;3:融合BeWo常氧组; 4:BeWo常氧组 A:Western blot 检测结果;B:半定量分析(n=24,x±s)a:P < 0.05,与融合BeWo低氧组比较;b: P < 0.05,与BeWo 低氧组比较 图 5 Western blot 检测缺氧处理前后各组Rab11的表达 |
PE的发病机制一直是产科业内讨论的中心,探讨其发病机制,为其治疗提供新的思路和实验室证据,对降低PE时孕产妇的死亡非常重要。目前可以用来实验的人类滋养细胞来源的细胞系大部分来源于恶性葡萄胎或者绒毛膜癌的转化细胞[6],例如Jar、Jeg-3、BeWo、HTR-8等细胞。这些细胞在滋养细胞的功能研究中发挥了重要的作用。吴维光等[7]研究证实BeWo细胞可作为一种滋养细胞模型用于低氧与滋养细胞功 能方面的研究。本实验采用来源于人类胎盘绒毛膜癌的滋养细胞系BeWo细胞作为研究对象,体外模拟妊娠期滋养细胞的变化,为临床病理妊娠的过程提供参考。
妊娠期是一个复杂多变的生理过程,孕早期子宫蜕膜处于生理性低氧状态,有利于胚胎的植入与着床,HIF-1α是 细胞对缺氧反应的调节因子,通过调整20多 种基因改善氧张力,并调节抗血管生成因子、一氧化氮合酶等使滋养细胞适应低氧的状态[8]。缺氧条件下,HIF-1α升高。
合体滋养细胞胞外体(STBEX)是胎盘合体滋养细胞在凋亡、激活等条件下细胞内的多泡体与细胞膜融合释放的一种纳米级囊泡,直径为40~100 nm[9]。STBEX表面携带各种蛋白质、mRNA、miRNA,参与细胞间的信息传递,在维持正常妊娠的过程中发挥着重要的作用[10]。但在病理妊娠时STBEX做为胎盘源性不良因子中的一种,可以损伤血管内皮细胞,刺激血管痉挛,引起血压升高[11];也可以剂量依赖性的方式激活外周血单核细胞[12],使其分泌IL-1β、IL-6、Serpin-E1、粒细胞集落刺激因子和TNF-α等促炎性反应细胞因子和趋化因子,造成严重的系统性炎症反应[13]。STBEX还可以被外周血和淋巴器官中的树突状细胞捕获,引起T细胞的增殖而促进免疫反应[14];其表面的HLA-G5、B7-H1和 B7-H3等免疫分子可以活化抗原提呈细胞,调节 Th1/Th2 免疫平衡[15]。有研究发现PE患者外周血中,STBEX的水平高于正常妊娠妇女[16]。在体外缺氧实验条件下,滋养细胞释放STBEX的数量明显升高[9]。本研究,发现融合BeWo细胞低氧组和未融合BeWo细胞低氧组中STBEX的蛋白浓度高于融合BeWo细胞常氧组与未融合BeWo细胞常氧组。说明缺氧可能是STBEX释放的重要影响因素之一,而这一释放过程的具体机制也成为研究PE发病的关键。
Rab11蛋白是Ypt/Rab家族的亚科,属于小G蛋白ras超家族成员,表达Rab GTPases酶系,主要定位于具有膜的结构中,包括各种囊泡、细胞多泡体和具有膜的细胞器,参与真核生物囊泡的释放和分泌。Rab11蛋白存在于胎盘组织中,通过调节胎盘滋养层细胞的分化和融合,影响胎盘的发育和功能[17]。对缺氧极为敏感的细胞中Rab11蛋白可以与细胞微管骨架交联定向引导囊泡的释放和运动[18]。本研究中,发现未融合 BeWo细胞和融合BeWo细胞在缺氧条件下Rab11蛋白含量升高及STBEX的水平升高(P < 0.05)。 实验提示缺氧条件下Rab11蛋白通过调节胎盘滋养细胞异常分化,导致胎盘发育不良和功能障碍,进而引起STBEX的过度释放,由此引起内皮细胞功能障碍,血管痉挛,胎盘组织局部缺血缺氧,最终导致PE的发生。但Rab11蛋白上调机制极其下游导致STBEX分泌增加的机制,尚需进一步研究。综上所述,若能探明Rab11蛋白在STBEX过度分泌中的相关机制,可能为PE的病因研究提供新的实验室证据。我们设想可能通过预防STBEX的过度释放减少PE的发生,降低孕产妇及胎儿的死亡。
| [1] | Redman C W, Sargent I L, Staff A C. IFPA Senior Award Lecture: making sense of pre-eclampsia—two placental causes of preeclampsia?[J]. Placenta, 2014, 35(Suppl): S20-S25. DOI: 10.1016/j.placenta.2013.12.008 |
| [2] | van-Patot M C, Ebensperger G, Gassmann M, et al. The hypoxic placenta[J]. High Alt Med Biol, 2012, 13(3): 176- 184. DOI: 10.1089/ham.2012.1046 |
| [3] | Villarroel-Campos D, Gastaldi L, Conde C, et al. Rab-mediated trafficking role in neurite formation[J]. J Neurochem, 2014, 129(2): 240-248. DOI: 10.1111/jnc.12676 |
| [4] | Ishikawa A, Omata W, Ackerman W E 4th, et al. Cell fusion mediates dramatic alterations in the actin cytoskeleton, focal adhesions, and E-cadherin in trophoblastic cells[J]. Cytoskeleton (Hoboken), 2014, 71(4): 241-256. DOI: 10.1002/cm.21165 |
| [5] | Qin J, Xu Q. Functions and application of exosomes[J]. Acta Pol Pharm, 2014, 71(4): 537-543. |
| [6] | 夏俊霞, 乔福元, 吉琼梅, 等. 低氧对BeWo细胞骨桥蛋白表达的影响[J]. 华中科技大学学报: 医学版, 2014, 43(1): 48-52. DOI: 10.3870/j.issn.1672-0741.2014.01.010 |
| [7] | 吴维光, 陈亚琼, 王玉萍, 等. 不同缺氧方法诱导BeWo细胞缺氧诱导因子1α表达的实验研究[J]. 武警医学院学报, 2005, 14(2): 86-89. DOI: 10.3969/j.issn.1008-5041.2005.02.002. |
| [8] | 王云, 李力. 低氧诱导因子-1与妊高征发病的研究进展[J]. 国外医学: 妇幼保健分册, 2004, 15(5): 292-293. DOI: 10.3969/j.issn.1673-5293.2004.05.015 |
| [9] | Salomon C, Kobayashi M, Ashman K, et al. Hypoxia-induced changes in the bioactivity of cytotrophoblast-derived exosomes[J]. PLoS One, 2013, 8(11): e79636. DOI: 10.1371/journal.pone.0079636 |
| [10] | Mincheva-Nilsson L, Baranov V. The role of placental exosomes in reproduction[J]. Am J Reprod Immunol, 2010, 63(6): 520-533. DOI: 10.1111/j.1600-0897.2010.00822.x |
| [11] | Chen L M, Liu B, Zhao H B, et al. IL-6, TNFalpha and TGFbeta promote nonapoptotic trophoblast deportation and subsequently causes endothelial cell activation[J]. Placenta, 2010, 31(1): 75-80. DOI: 10.1016/j.placenta.2009.11.005 |
| [12] | Stenqvist A C, Nagaeva O, Baranov V, et al. Exosomes secreted by human placenta carry functional Fas ligand and TRAIL molecules and convey apoptosis in activated immune cells, suggesting exosome-mediated immune privilege of the fetus[J]. J Immunol, 2013, 191(11): 5515-5523. DOI: 10.4049/jimmunol.1301885 |
| [13] | Atay S, Gercel-Taylor C, Suttles J, et al. Trophoblast-derived exosomes mediate monocyte recruitment and differentiation[J]. Am J Reprod Immunol, 2011, 65(1): 65-77. DOI: 10.1111/j.1600-0897.2010.00880.x |
| [14] | Bastos-Amador P, Perez-Cabezas B, Izquierdo-Useros N, et al. Capture of cell-derived microvesicles (exosomes and apoptotic bodies) by human plasmacytoid dendritic cells[J]. J Leukoc Biol, 2012, 91(5): 751-758. DOI: 10.1189/jlb.0111054 |
| [15] | Kshirsagar S K, Alam S M, Jasti S, et al. Immunomodulatory molecules are released from the first trimester and term placenta via exosomes[J]. Placenta, 2012, 33(12): 982-990. DOI: 10.1016/j.placenta.2012.10.005 |
| [16] | Salomon C, Yee S W, Mitchell M D, et al. The possible role of extravillous trophoblast-derived exosomes on the uterine spiral arterial remodeling under both normal and pathological conditions[J]. Biomed Res Int, 2014, 2014: 693157. DOI: 10.1155/2014/693157 |
| [17] | Gonzalez I M, Ackerman W E 4th, Vandre D D, et al. Exocyst complex protein expression in the human placenta[J]. Placenta, 2014, 35(7): 442-449. DOI: 10.1016/j.placenta.2014.04.015 |
| [18] | Koles K, Nunnari J, Korkut C, et al. Mechanism of evenness interrupted (Evi)-exosome release at synaptic boutons[J]. J Biol Chem, 2012, 287(20): 16820-16834. DOI: 10.1074/jbc.M112.342667 |



