GATA结合蛋白4(GATA-binding protein 4,GATA4)是正常心脏发育必不可少的转录因子之一,缺失GATA4的小鼠胚胎会因为不能形成线性心管而在发育至9 d时死亡[1-2]。此外,在心肌肥厚的过程中GATA4也发挥了重要的作用。在主动脉缩窄的心肌肥厚模型中,单拷贝缺失GATA4的小鼠与对照小鼠相比会发生更加严重的离心性肥厚和心衰,并伴随着心肌细胞凋亡和纤维化的发生[3]。血管紧张素 Ⅱ(angiotensin Ⅱ,AngⅡ)、 异丙肾上腺素等肥厚相关性刺激会激活GATA4上游MAPK-ERK以及MAPK-p38信号通路,通过增加GATA4 磷酸化促进其进入细胞核,同时增加其DNA结合能力,从而诱导心脏特异的GATA4下游基因(如ANP、BNP等)的表达[4-5]。鉴于GATA4在心脏中的关键作用,深入研究其调控机制有利于更加全面地了解心脏的发育过程以及心脏相关疾病的发病机制。
Sirt4是Ⅲ类组蛋白去乙酰化酶sirtuins家族成员之一,通过其去乙酰酶活性和ADP-核糖基转移酶活性参与调节多个生物学过程。Sirt4能够去乙酰化丙二酰基辅酶A脱羧酶(malonyl-CoA decarboxylase,MCD),下调MCD活性影响脂质代谢[6]。此外,Sirt4可以在线粒体中通过ADP-核糖基化作用降低谷氨酸脱氢酶的活性,进而调节胰岛素分泌和肿瘤的发生[7-8]。研究发现Sirt4在心脏中有相对比较高的表达[7],但其在心肌细胞中的作用尚不清楚。本研究拟利用AngⅡ刺激大鼠原代心肌细胞建立体外心肌肥厚模型,并采用免疫荧光、双荧光素酶报告基因等技术研究Sirt4对GATA4的调节作用,以期初步探索Sirt4在心肌细胞中的功能,尝试为临床上治疗心肌肥厚提供新的思路。
1 材料与方法 1.1 实验材料及仪器SPF级新生(1~3 d)Sprague-Dawley (SD)大鼠由重庆医科大学实验动物中心提供。293T细胞由本实验室留存。DMEM细胞培养基、OPTI-MEM、胎牛血清、TRIzol、荧光二抗(Invitrogen公司);AngⅡ (Sigma公司); Hoechst 33342(碧云天公司);VigoFect 、Dual-Luciferase Reporter Assay System (Vigorous公司);细胞核提取试剂盒(Thermo公司)。Anti-Sirt4 抗体、anti-GATA4抗体(Santa Cruz Biotechnology)、anti-GAPDH抗体(Image science公司)、anti-H3抗体(Abcam公司)、anti-p-GATA4抗体(Sigma公司);random primer、dNTP、 RNA酶抑制剂、SYBR Green real-time PCR Mix(TaKaRa公司);逆转录缓冲液、逆转录酶(New England BioLabs)。激光共聚焦显微镜(Leica公司);电泳仪、转膜仪、凝胶成像系统(Bio-Rad公司);Real-Time PCR 仪(ABI公司);多功能酶标仪(Turner Biosystems)。
1.2 实验方法 1.2.1 腺病毒载体构建设计并合成针对人Sirt4全长的PCR引物(上游: 5′-CGCGGATCCATGAAGATGAGCTTTGCGTTGACTT-3′;下游:5′-CCGCTCGAGTTGCATGGGTCTATCAAAGGCAGC-3′),扩增Sirt4全长片段并连入pAdTrack载体中,测序鉴定含有正确目标序列的克隆(即pAdTrack-Sirt4)。同时,合成针对大鼠Sirt4的siRNA序列(上游:5′-GATCCGGTGAACCCA-GACAAGGTTTTCAAGAGAAACCTTGTCTGGGTTCACC-TTTTTTACGCGTG-3′;下游:5′-AATTCACGCGTAAA-AAAGGTGAACCCAGACAAGGTTTCTCTTGAAAACCTT-GTCTGGGTTCACCG-3′),退火后连入pAdTrack载体中,测序鉴定含有正确目标序列的克隆(即pAdTrack-ShSirt4)。取100 ng 经PmeⅠ酶切后线性化的上述质粒分别与400 ng pAd-easy质粒共同转化BJ5183,筛选出阳性克隆并进行扩大培养以及质粒提取。用PacⅠ处理重组阳性质粒,乙醇沉淀后重悬于20 μL无菌水中,转染293A细胞,收集病毒。
1.2.2 细胞培养及处理采用胰蛋白酶消化法分离乳大鼠原代心肌细胞。每次取30~40只新生SD大鼠心脏,剪碎后加入0.1% 胰蛋白酶置于37 ℃水浴中消化。消化完成后1 200 r/min 室温离心10 min,用含10%胎牛血清的DMEM培养基重悬沉淀,过滤细胞悬液于平皿中,并置于37 ℃、5%CO2培养箱中培养。1.5~2 h后用含10%胎牛血清的DMEM培养基轻轻吹打细胞,将上清吸出,根据实验需要接种于不同孔板,并放置于37 ℃恒温培养箱中培养。48 h后,加入相应腺病毒,感染6 h后更换不含血清的DMEM培养基,24 h后加入生理盐水或AngⅡ(1 μmol/L)继续培养48 h即可。
复苏冻存的293T细胞株,加入含10%胎牛血清的DMEM培养基,放置于37 ℃、5%CO2恒温培养箱中进行培养,当细胞贴壁生长至80%~90% 时用0.25% 胰蛋白酶进行消化并传代。
1.2.3 免疫荧光染色显示GATA4核转运将培养于24孔板中的大鼠原代心肌细胞分为3组。第1组细胞为空白对照组;第2组细胞感染Ad-U6对照腺病毒后用AngⅡ(1 μmol/L)处理48 h;第3组细胞感染干扰Sirt4表达的腺病毒(Ad-shSirt4)后用AngⅡ(1 μmol/L)处理48 h。完成处理后弃去培养基,4%多聚甲醛室温固定15 min。弃去多聚甲醛,用含0.5% TritonX-100的PBS孵育10 min,再用3% BSA室温孵育1 h。弃去BSA后anti-GATA4抗体(1 ∶100)4 ℃孵育过夜。去除一抗,PBS漂洗3遍后加入稀释荧光二抗,室温孵育1 h,再用Hoechst复染5 min,抗淬灭剂封片,利用激光共聚焦显微镜观察并拍摄。
1.2.4 Western blot检测相关蛋白表达根据实验需要提取各组大鼠原代心肌细胞总蛋白或用细胞核提取试剂盒分离细胞核蛋白以及胞浆蛋白,用BCA试剂盒进行蛋白定量,调整蛋白浓度。随后将变性的蛋白上样,进行SDS-PAGE。电泳完成后转膜2 h,再用5%脱脂牛奶室温封闭1 h。封闭完成后弃去封闭液,一抗4 ℃孵育过夜,然后用辣根过氧化物酶HRP标记的二抗室温孵育1.5~2 h。随后利用ECL化学发光显色,并进行X线片曝光,洗片显影。
1.2.5 Real-time PCR检测GATA4基因表达向培养于6孔板的大鼠原代心肌细胞中加入1 mL TRIzol,提取总RNA。取2 μg RNA,12.25 μL DEPC水,1 μL random primer,4 μL dNTP于EP管中,在PCR仪中完成程序(70 ℃,5 min)后快速置于冰上,加入2 μL 逆转录缓冲液,0.5 μL RNA酶抑制剂,0.25 μL逆转 录酶,运行PCR程序,将RNA逆转录成cDNA。以1 μL cDNA为模板,加入10 μL SYBR Green Real-time PCR Mix,8 μL DEPC水,1 μL引物(GATA4: 上游:5′-TCAAACCAGAAAACGGAAGC-3′,下游:5′-GCATCTC-TTCACTGCTGCTG-3′;GAPDH:上游:5′-TGTTCCTACCCCCAATGTATCCG-3′,下游:5′-TGCTTCACCACCTTCTTGATGTCAT-3′),完成Real-time PCR。
1.2.6 双荧光素酶报告基因检测将接种于24孔板中的293T细胞分为3组,每组3个复孔,当细胞生长至60%~70% 时进行转染。第1组转ANP或BNP启动子区报告载体0.25 μg、内参质粒CMV 2 ng、pcDNA4 2 μg;第2组转ANP或BNP启动子区报告载体0.25 μg、内参质粒CMV 2 ng、pcDNA4 和GATA4各1 μg; 第3组转ANP或BNP启动子区报告载体0.25 μg、 内参质粒CMV 2 ng、GATA4 和Sirt4各1 μg。将每组质粒加入到500 μL OPTI-MEM中,混匀后室温放置。同时取4 μL VigoFect加入到500 μL OPTI-MEM中,混匀后室温放置5 min。然后将稀释的VigoFect加入到含质粒的OPTI-MEM中,混匀后室温放置15 min,将所得的转染工作液逐滴加入细胞培养液中,轻轻混匀,再把细胞放置于37 ℃、5%CO2恒温培养箱中培养。48 h后,按照说明书操作步骤进行双荧光素酶报告基因检测。
1.3 统计学分析采用Graph Pad Prism 6.0统计软件,计量结果用平均数(mean)±标准误(sem)表示,单因素两组间比较用t检验,多因素或多组别用单向或双向方差分析,并用Bonferroni post hoc test 方法对两组间或者因素间差异进行进一步分析。
2 结果 2.1 腺病毒过表达及干扰效率在大鼠原代心肌细胞中分别感染表达Sirt4的腺病毒(Ad-Sirt4)、干扰Sirt4表达的腺病毒(Ad-shSirt4)以及各自的对照腺病毒(Ad-GFP、Ad-U6)。Western blot 结果显示:Ad-Sirt4可以在大鼠原代心肌细胞中有效表达Sirt4蛋白(图 1A),而Ad-shSirt4可以显著降低Sirt4的表达(图 1B)。

|
| A: Sirt4过表达 1:Ad-GFP组;2:Ad-Sirt4组;B:Sirt4干扰 1:Ad-U6组;2: Ad-shSirt4组 图 1 Western blot检测各组心肌细胞中Sirt 4的表达 |
2.2 Sirt4对GATA4表达的影响
为了考察Sirt4是否存在调节GATA4的作用,本研究在正常大鼠原代心肌细胞以及药物处理下的心肌细胞中检测了Sirt4对GATA4 表达的影响。结果显示:与Ad-GFP组比较,Ad-Sirt4组中GATA4的蛋白和mRNA水平均没有明显改变(P>0.05,图 2A、B)。此外,Ad-shSirt4组与Ad-U6组中GATA4的蛋白和mRNA 水平也没有显著差异(P>0.05,图 2C、D),表明在心肌细胞中Sirt4不会影响GATA4的表达。
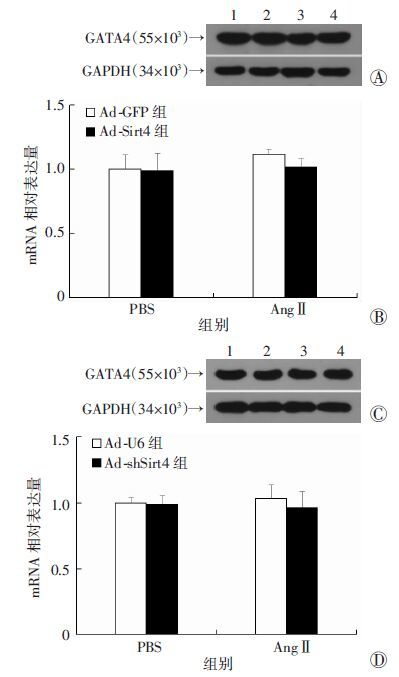
|
| A: Sirt4过表达后GATA4的蛋白水平 1、2:分别为PBS+ Ad-GFP、PBS+Ad-Sirt4组;3、4:分别为AngⅡ+Ad-GFP、AngⅡ+Ad-Sirt4组;B:Sirt4过表达后GATA4的mRNA水平; C: Sirt4干扰后GATA4的蛋白水平 1、2:分别为PBS+Ad-U6、PBS+Ad-shSirt4组;3、4:分别为AngⅡ+Ad-U6、AngⅡ+ Ad-shSirt4组;D: Sirt4干扰后GATA4的mRNA水平 图 2 Western blot和Real-time PCR分别检测各组心肌细胞中GATA4 蛋白和mRNA水平 |
2.3 Sirt4增加AngⅡ刺激下GATA4的磷酸化水平
为了进一步探索Sirt4与GATA4的关系,分别在Ad-Sirt4和Ad-shSirt4感染的原代心肌细胞中检测了GATA4的磷酸化水平。在Ad-GFP感染的大鼠原代心肌细胞中,AngⅡ刺激30、60 min后促进了GATA4的磷酸化;与Ad-GFP组相比,Sirt4过表达组中GATA4的磷酸化水平显著增加(图 3A)。相反,在Ad-shSirt4感染的心肌细胞中,GATA4的磷酸化水平与对照组相比明显降低(图 3B)。这些结果显示:Sirt4在大鼠原代心肌细胞中促进AngⅡ诱导的GATA4磷酸化。
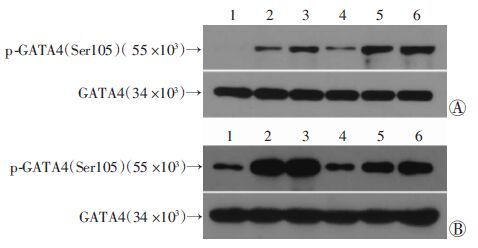
|
| A: Sirt4过表达 1~3:分别为AngⅡ+Ad-GFP组0、30、60 min;4~6:分别为AngⅡ+Ad-Sirt4组 0、30、60 min;B:Sirt4 干扰 1~3:分别为AngⅡ+Ad-U6组0、30、60 min;4~6:分别为AngⅡ+Ad-shSirt4组 0、30、60 min 图 3 Western blot检测各组心肌细胞中GATA4磷酸化水平 |
2.4 干扰Sirt4表达抑制AngⅡ诱导的GATA4入核
由于GATA4的磷酸化会促进其核转运,本研究检测了Sirt4对GATA4入核的影响。在未经处理的空白对照组心肌细胞中,GATA4定位于细胞核和细胞质中,而在AngⅡ处理之后,Ad-U6组中GATA4蛋白主要分布在细胞核中。值得注意的是在下调Sirt4表达的心肌细胞中,AngⅡ刺激下GATA4蛋白在细胞核和细胞质中都有明显的分布(图 4)。这些结果表明:在心肌细胞中干扰Sirt4的表达能够有效抑制AngⅡ引起的GATA4在细胞核中的聚集。

|
| A:免疫荧光检测(×1 000);B:Western blot 检测 GAPDH代表胞浆蛋白;H3代表核蛋白;1、2分别为相关蛋白在AngⅡ+Ad-U6组细胞质、细胞核中的表达;3、4分别为相关蛋白在AngⅡ+Ad-shSirt4组细胞质、细胞核中的表达 图 4 各组心肌细胞中GATA4在细胞核和细胞质中的分布 |
2.5 Sirt4增加GATA4的转录激活能力
进一步检测Sirt4对GATA4下游分子ANP、BNP启动子活性的影响。在293T细胞中过表达GATA4可以显著增加ANP和BNP的报告基因活性(P<0.01)。与共转染pcDNA4和GATA4的细胞相比,共转染GATA4和Sirt4的细胞中ANP、BNP的启动子活性显著增强(P<0.01,图 5)。双荧光素酶报告基因的结果表明:过表达Sirt4可以明显增加GATA4的转录激活能力。
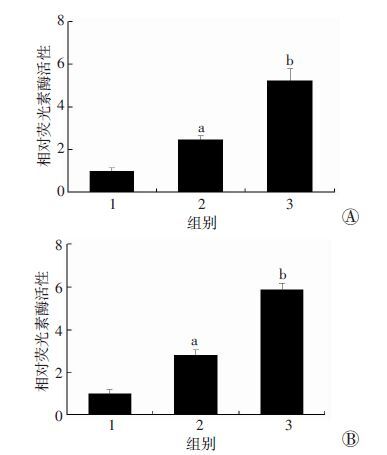
|
| 1:转染pcDNA4组;2:转染pcDNA4+GATA4组;3:转染GATA4+Sirt4组;a:P<0.01,与转染pcDNA4组比较;b:P<0.01,与转染pcDNA4+GATA4组比较 图 5 双荧光素酶报告基因检测各组293T细胞中GATA4下游分子的启动子活性 |
3 讨论
本研究构建了过表达Sirt4以及干扰Sirt4表达的腺病毒,并将其成功感染大鼠原代心肌细胞。此外,我们发现不管是在正常心肌细胞还是AngⅡ处理的心肌细胞中,Sirt4都不会改变GATA4的蛋白和mRNA表达水平。但是在AngⅡ刺激的大鼠原代心肌细胞中,Sirt4过表达可以显著增加GATA4的磷酸化水平,而下调Sirt4表达则会降低GATA4的磷酸化。除此之外,降低Sirt4表达能够明显抑制AngⅡ刺激下GATA4的核转运,并且Sirt4还能显著增加GATA4下游靶基因ANP和BNP的启动子活性。因此,上述证据表明Sirt4可以在心肌细胞中增强AngⅡ对GATA4的激活作用。
Sirt4是sirtuins家族成员之一,定位于线粒体基质。在线粒体中,Sirt4可以通过其去乙酰化酶活性或ADP核糖基转移酶活性影响底物的翻译后修饰水平调节脂质代谢和胰岛素分泌[6-7]。此外,Laurent等[9]发现Sirt4可以在肝脏细胞中抑制PPARα活性;Chen等[10]发现在人肺微血管内皮细胞中Sirt4可以抑制香烟烟雾提取物对NFκB的激活效应。因此,Sirt4不仅能在线粒体中发挥作用,还具有影响细胞核中转录因子活性的能力。本研究发现在大鼠原代心肌细胞中Sirt4能够明显促进AngⅡ对GATA4的激活作用,进一步证实了Sirt4可以对线粒体外的蛋白产生影响。
在发育的心脏组织中,GATA4是最早表达的转录因子之一,调控心肌细胞的存活、增殖和分化[11-12]。此外,GATA4也直接参与了心肌肥厚的调节。在肥厚性刺激(如AngⅡ、内皮素等)的作用下,GATA4磷酸化水平增加并且DNA结合能力和转录活性也增加,继而活化多种心肌肥厚相关基因(如ANP、BNP)[12]。GATA4磷酸化是最早发现、也是最常见的一种翻译后修饰类型,并且GATA4具有多个磷酸化位点。本研究结果显示:在大鼠原代心肌细胞中,AngⅡ可以诱导GATA4 Ser-105位点的磷酸化,并且Sirt4可以显著促进AngⅡ的这一效应。Ser-105是影响GATA4活性至关重要的一个磷酸化位点。研究发现Ser-105对于GATA4介导的转录激活作用是必需的,该位点突变会减少GATA4的DNA结合能力,并且Ser-105的磷酸化可以增加GATA4在细胞中的稳定性[13-14]。在心肌细胞中,肥厚因子与细胞膜上的受体结合,激活下游MAPK-ERK以及MAPK-P38信号通路,ERK和P38随后可以磷酸化Ser-105位点从而激活GATA4[13, 15]。因此,我们推测Sirt4可能通过激活MAPK-ERK或MAPK-P38信号通路增加GATA4的磷酸化水平。
Sirt4是在各个组织中广泛表达的一种线粒体蛋白,并且高表达于心脏、肾脏、肝脏和大脑中[7]。值得注意的是,Sirt4敲除鼠生长发育正常,并没有发现明显的组织缺陷[7]。因此,Sirt4并不是心脏及其他组织发育过程中必不可少的分子,但是也不能排除Sirt4可能在胚胎发育时发挥作用,其作用也许能够被其他分子所代偿。而与其他sirtuins家族成员相比,在成年个体中关于Sirt4功能的研究也相对较少,尤其是其在心脏组织中的功能。Liu等[16]发现Sirt4在H9c2细胞中抑制低氧诱导的凋亡,这一作用可能有助于治疗缺血性心脏疾病。本研究采用了大鼠原代心肌细胞,通过AngⅡ处理在体外建立了心肌肥厚模型,结果显示Sirt4可以在AngⅡ刺激下促进GATA4的激活以及心肌肥厚标志性分子ANP、BNP的转录活性,提示Sirt4很有可能在心肌肥厚的过程中发挥作用,为临床上开发新的治疗靶点提供了思路。
| [1] | Kuo C T, Morrisey E E, Anandappa R, et al. GATA4 transcription factor is required for ventral morphogenesis and heart tube formation[J]. Genes Dev,1997, 11 (8) : 1048 –1060. DOI:10.1101/gad.11.8.1048 |
| [2] | Molkentin J D, Lin Q, Duncan S A, et al. Requirement of the transcription factor GATA4 for heart tube formation and ventral morphogenesis[J]. Genes Dev,1997, 11 (8) : 1061 –1072. DOI:10.1101/gad.11.8.1061 |
| [3] | Bisping E, Ikeda S, Kong S W, et al. Gata4 is required for maintenance of postnatal cardiac function and protection from pressure overload-induced heart failure[J]. Proc Natl Acad Sci U S A,2006, 103 (39) : 14471 –14476. DOI:10.1073/pnas.0602543103 |
| [4] | Liang Q, Molkentin J D. Divergent signaling pathways converge on GATA4 to regulate cardiac hypertrophic gene expression[J]. J Mol Cell Cardiol,2002, 34 (6) : 611 –616. DOI:10.1006/jmcc.2002.2011 |
| [5] | Hautala N, Tokola H, Luodonpaa M, et al. Pressure overload increases GATA4 binding activity via endothelin-1[J]. Circulation,2001, 103 (5) : 730 –735. DOI:10.1161/01.CIR.103.5.730 |
| [6] | Laurent G, German N J, Saha A K, et al. SIRT4 coordinates the balance between lipid synthesis and catabolism by repressing malonyl CoA decarboxylase[J]. Mol Cell,2013, 50 (5) : 686 –698. DOI:10.1016/j.molcel.2013.05.012 |
| [7] | Haigis M C, Mostoslavsky R, Haigis K M, et al. SIRT4 inhibits glutamate dehydrogenase and opposes the effects of calorie restriction in pancreatic beta cells[J]. Cell,2006, 126 (5) : 941 –954. DOI:10.1016/j.cell.2006.06.057 |
| [8] | Jeong S M, Xiao C, Finley L W, et al. SIRT4 has tumor-suppressive activity and regulates the cellular metabolic response to DNA damage by inhibiting mitochondrial glutamine metabolism[J]. Cancer cell,2013, 23 (4) : 450 –463. DOI:10.1016/j.ccr.2013.02.024 |
| [9] | Laurent G, de-Boer V C, Finley L W, et al. SIRT4 represses peroxisome proliferator-activated receptor alpha activity to suppress hepatic fat oxidation[J]. Mol Cell Biol,2013, 33 (22) : 4552 –4561. DOI:10.1128/MCB.00087-13 |
| [10] | Chen Y, Wang H, Luo G, et al. SIRT4 inhibits cigarette smoke extracts-induced mononuclear cell adhesion to human pulmonary microvascular endothelial cells via regulating NF-kappaB activity[J]. Toxicol Lett,2014, 226 (3) : 320 –327. DOI:10.1016/j.toxlet.2014.02.022 |
| [11] | Heikinheimo M, Scandrett J M, Wilson D B. Localization of transcription factor GATA-4 to regions of the mouse embryo involved in cardiac development[J]. Dev Biol,1994, 164 (2) : 361 –373. DOI:10.1006/dbio.1994.1206 |
| [12] | Pikkarainen S, Tokola H, Kerkela R, et al. GATA transcription factors in the developing and adult heart[J]. Cardiovasc Res,2004, 63 (2) : 196 –207. DOI:10.1016/j.cardiores.2004.03.025 |
| [13] | Liang Q, Wiese R J, Bueno O F, et al. The transcription factor GATA4 is activated by extracellular signal-regulated kinase 1- and 2-mediated phosphorylation of serine 105 in cardiomyocytes[J]. Mol Cell Biol,2001, 21 (21) : 7460 –7469. DOI:10.1128/MCB.21.21.7460-7469.2001 |
| [14] | Suzuki Y J. Stress-induced activation of GATA-4 in cardiac muscle cells[J]. Free Radic Biol Med,2003, 34 (12) : 1589 –1598. DOI:10.1016/S0891-5849(03)00208-9 |
| [15] | Charron F, Tsimiklis G, Arcand M, et al. Tissue-specific GATA factors are transcriptional effectors of the small GTPase RhoA[J]. Genes Dev,2001, 15 (20) : 2702 –2719. DOI:10.1101/gad.915701 |
| [16] | Liu B, Che W, Xue J, et al. SIRT4 prevents hypoxia-induced apoptosis in H9c2 cardiomyoblast cells[J]. Cell Physiol Biochem,2013, 32 (3) : 655 –662. DOI:10.1159/000354469" |



