2. 401120重庆,重庆润泽医药有限公司 ;
3. 611731成都,四川省食品药品检测院
2. Chongqing Runze Pharmaceutical Co., Ltd., Chongqing, 401120 ;
3. Sichuan Institute for Food and Drug Control, Chengdu, Sichuan Province, 611731, China
临床上各种原因造成的骨缺损限制了牙科种植术的适应范围,同时也影响了种植体的后期稳定性,各种骨修复材料的应用成为解决该问题的有效办法。钽作为一种新型骨植入材料,可克服目前临床应用较为广泛的钛存在的弹性模量高及易生理腐蚀等弱点,多孔钽材料在骨科的临床应用效果已取得了实验证实[1-2]。前期实验已证实多孔钽颗粒具有骨诱导和塑形作用,其对骨缺损的修复取得了较好的效果[3]。然而,在骨缺损的修复过程中,骨生长因子的缺乏或活性不足都可以直接影响骨修复的效果[4]。骨整合和骨诱导也因此成为骨组织工程的研究热点。bFGF具有强大的促细胞增殖和促血管生成能力,是体内最重要的成骨生长因子之一[5],研究发现其他多孔材料在负载bFGF后修复骨缺损可缩短愈合时间[6],但bFGF与多孔钽颗粒联合应用修复骨缺损尚少见报道。为探究bFGF对多孔钽颗粒修复骨缺损过程中成骨的影响,进一步提高多孔钽颗粒修复骨缺损的速度,本实验将bFGF与多孔钽颗粒联合应用修复犬颌骨缺损,观察骨缺损修复情况,为生长因子联合多孔钽修复骨缺损的临床应用提供依据。
1 材料与方法 1.1 实验动物、试剂和仪器实验动物:成年雄性Beagle犬6只(四川省食品药品检测院提供),随机编为1~6号,动物定时喂食,自由饮水。
实验材料及试剂:多孔钽颗粒(润泽医药公司,孔径100 μm,孔隙率70%),bFGF冻干粉(美国PerproTech),0.5% 硫酸阿托品注射液,5%戊巴比妥钠,陆眠 宁Ⅱ,头孢类注射液,荧光四环素(成都华夏试剂公司)。
实验仪器:牙科种植机(Implantoloy system RZ11-YZ),X线片机(Sirona,德国),硬组织切磨系统(EXAKT,德国),激光共聚焦显微镜,倒置相差显微镜(Olympus,日本)。
1.2 实验方法 1.2.1 bFGF与多孔钽颗粒的复合bFGF冻干粉用生理盐水配制为100 ng/mL的溶液,将已消毒的多孔钽颗粒和配置好的bFGF溶液混合放入无菌离心管中,于振荡器上4 ℃过夜,冷冻干燥备用。
1.2.2 骨缺损模型的建立及修复5%戊巴比妥钠(0.5 mL/kg)和陆眠宁Ⅱ(0.07 mL/kg)麻醉动物后,拔除下颌双侧第1~4前磨牙,待拔牙创自然愈合后,常规麻醉实验动物,分层切开组织,暴露缺牙区下颌骨,用牙科种植机在缺牙区建立柱状骨缺损模型,直径4 mm,深7 mm骨缺损,各缺损间隔5 mm,单侧建立3个骨缺损。共36个。单侧骨缺损分别为多孔钽颗粒修复组(实验组A)、bFGF+多孔钽颗粒修复组(实验组B)、未填充修复材料组(对照组),可吸收线缝合牙龈,术后连续3 d肌注头孢,0.5 g/d,预防感染。
1.2.3 荧光四环素示踪标记动物于处死前10 d按50 mg/kg肌肉注射荧光四环素行示踪标记。
1.2.4 标本截取、X线拍摄及新生骨的评价分别于修复术后4、8、12周处死2只实验犬,截取下颌骨标本,每组各获得4个样本。10%甲醛固定48 h,X线观察各组植入物与周围骨质情况。
1.2.5 硬组织切片的制备及组织学观察标本转入75%乙醇固定,EXAKT组织切磨系统制取不脱钙 甲基苯烯酸甲酯包埋骨组织切片,最终厚度为15~20 μm,激光共聚焦显微镜荧光检测(激发波长488 nm,检测波长493~630 nm),Image Pro Plus图像分析软件计算标记时间点内形成新骨占植入区总面积的百分比值,每个标本随机选取4个视野,计算平均值行统计学分析。甲苯胺蓝染色观察缺损区骨形成及矿化情况。
1.3 统计学方法采用SPSS 16.0统计分析软件,计量资料以x±s表示,同一时间点各组间采用配对资料t检验。同组不同时间点行单因素方差分析及LSD-t检验,检验水准α=0.05。
2 结果 2.1 大体观察实验犬均存活,拔牙及修复术后缺牙区均无红肿、渗出等感染现象。实验组A术后4周钽颗粒与周围骨质结合良好,交界面可见少量骨痂,8周后钽颗粒与周围骨质更为紧密,骨痂进一步成熟,12周后可见交界处骨质与周围正常骨质无明显界限。实验组B术后4周骨缺损区表面软组织包裹完整,钽颗粒与原生骨之间结合紧密,交界面可见大量骨痂,8周及12周 大体观察与实验组A无显著差异。对照组术后4周,骨缺损处可见少量新生的肉芽组织,8周后可见少量成熟骨痂,12周后骨缺损表面被粗糙不平整的骨质覆盖。
2.2 X线观察高亮度阻射区为多孔钽颗粒植入区域,各时间点可见实验组多孔钽颗粒充满骨缺损区域,金属颗粒周围新生骨与周围正常骨质连续性随时间推移逐渐增强,交界处无骨吸收现象。对照组4周骨缺损区域仍可见大面积低密度透射区,8周后透射区有所减少,形成网状的纤维样结构,12周后骨缺损区密度较8周有所增高,但密度仍低于周围正常骨质(图 1),实验组A和实验组B植入材料骨界面无显著差异。
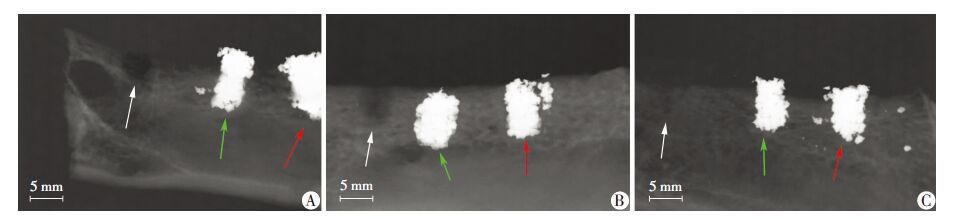
|
| A:4周;B:8周;C:12周;实验组A(红色箭头示)和实验组B(绿色箭头示)多孔钽颗粒与周围骨质结合良好,对照组(白色箭头示)随时间推移骨缺损区逐渐减少 图 1 X线观察各组术后不同时间骨缺损修复情况 |
2.3 甲苯胺蓝组织学染色观察
实验组A:光镜下见多孔钽颗粒为黑色,术后4周钽颗粒周围出现新生骨细胞;8周钽颗粒周围出现相互连通的网状编织骨;12周骨质进一步矿化,但可见少量脂肪样空泡结构(图 2)。
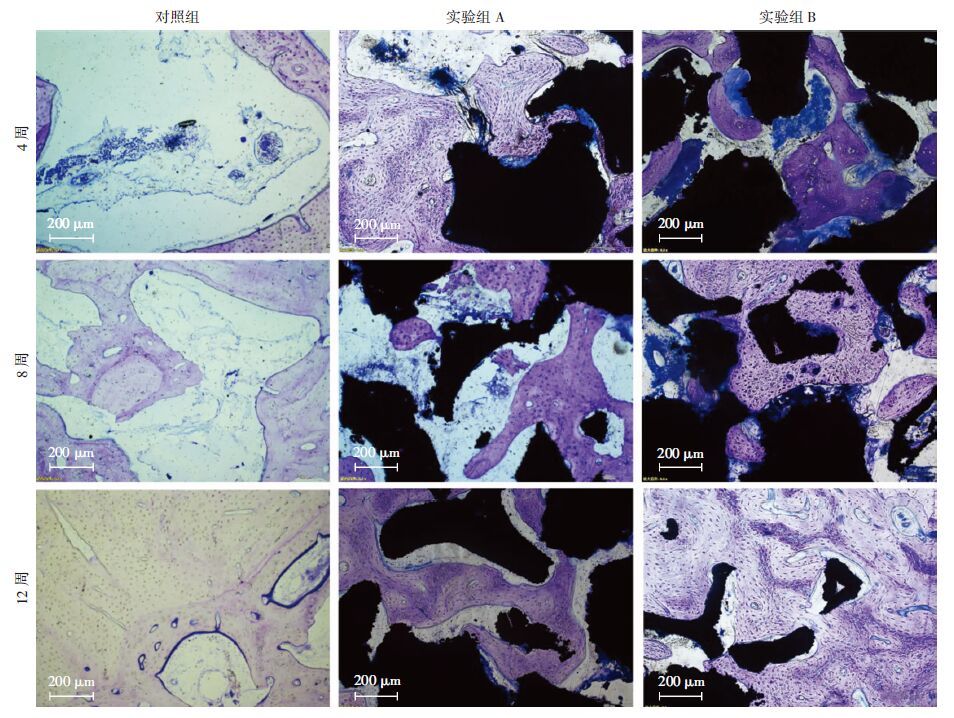
|
| 图 2 甲苯胺蓝染色观察各组术后不同时间骨缺损区域修复情况 (倒置相差显微镜×100) |
实验组B:术后4周可见多孔钽颗粒周围出现不规则排列的蓝染成骨细胞,同时可见大量条索样纤维组织;8周后多孔钽颗粒内部出现浅蓝色类骨质及深蓝色新生骨,多孔钽颗粒周围骨质进一步矿化,颗粒之 间可见成熟板层骨和哈弗士管系统;术后12周可见少量散在新生骨质,多孔钽颗粒之间充满连续的蓝紫色成熟骨质,多孔钽颗粒与原生宿主骨间结合紧密(图 2)。
对照组:术后4周后可见少量软骨细胞,网状排列的纤维结构;8周后骨缺损区域出现少量孔隙状编织骨,尚未见成熟的板层骨结构;12周后可见被脂肪空泡结构充满的未修复区域(图 2)。
2.4 四环素荧光标记新生骨面积分析镜下骨小梁显示绿色荧光,新生骨为高亮荧光。新骨形成始于多孔钽颗粒周围,逐渐连通于各多孔钽颗粒之间,8周后多孔钽颗粒内部出现强荧光团块(图 3),对照组骨小梁密度较低,且可见大面积空白缺损区。实验组A和实验组B多孔钽颗粒周围可见绿色骨小梁,材料内部均可见高亮荧光团块,骨组织已长入颗粒内部,实验组B高亮荧光面积较实验组A较少,但骨小梁较实验组A致密。
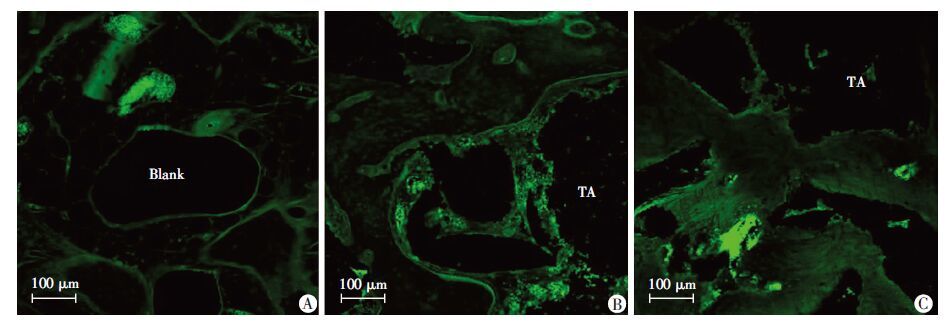
|
| A:对照组;B:实验组A;C:实验组B TA:多孔钽颗粒;Blank:骨缺损区域 图 3 激光共聚焦显微镜观察植入术后8周四环素荧光标记显示新骨形成情况 |
标记时间内成骨面积百分比结果见表 1,各实验组术后4周和8周标记点新生骨面积百分比均显著大于对照组(P <0.05),12周则差异无统计学意义(P>0.05)。术后4周实验组B新生骨面积大于实验组A,差异有统计学意义(P <0.05),8周后则实验组A成骨量大于实验组B,差异有统计学意义(P <0.05),术后12周,2组成骨量近似(P>0.05)。
| 组别 | 4周 | 8周 | 12周 |
| 实验组A | 18.08±1.28ab | 21.11±1.82ab | 11.59±2.90 |
| 实验组B | 23.13±2.12a | 18.32±1.29a | 11.50±2.26 |
| 对照组 | 12.50±1.97 | 14.15±1.90 | 10.50±2.00 |
| a:P <0.05,与对照组比较;b:P <0.05,与实验组B比较 | |||
同组不同时间点相比较:实验组B 4周末成骨量最多,8周末逐渐减少,12周末显著下降。实验组A及对照组8周末新生骨量最多,12周后显著下降。
3 讨论钽金属作为一种新型植入材料,较钛具有更高的惰性,即使在强酸环境中,其表面形成的氧化膜也可维持较好的抗腐蚀性能[7],保证术后骨结合的长期稳定性,提高植入成功率。研究发现,将不同金属涂层的植入物植入兔胫骨,12周多孔钽涂层的植入物表面在骨量和骨生长速度上显现了更多的优势,说明多孔钽在体内具有较强的骨诱导作用[8]。 本实验X线片示3个月后,空白组骨缺损无法自身修复,应用植入材料修复具有意义。四环素荧光标记数据分析结果显示,植入术后4周和8周各实验组成骨量均大于对照组(P <0.05),进一步验证了多孔钽颗粒在体内良好的组织相容性和骨诱导作用。多孔钽已经成功应用于骨科临床[9-10],国外已出现了表面经多孔钽处理的牙科种植体,多孔钽在临床的应用将更加广泛。多孔钽内部相互连通的空隙结构使其弹性模量更接近人体骨组织,一方面可有效降低骨-植入物界面的应力屏蔽效应,同时内部粗糙的孔隙结构有利于成骨细胞的吸附,为骨生成提供良好的支架,加速血管化的形成[11]。随着钽植入物的广泛应用,钽颗粒可实现与钽植入物和宿主骨的良好结合。
骨缺损修复过程中各种生长因子的参与起着至关重要的作用,bFGF是一种作用广泛的细胞因子,既可促进骨细胞和类骨细胞的有丝分裂,也可调控细胞外基质的分泌,同时也是体内重要的血管生成因子[12]。Kotev-Emeth等[13]发现在体外培养骨髓间充质干细胞(BMSCs)的过程中加入bFGF,细胞的增殖能力和传代次数都有所增加。Qu等[14]将bFGF与载体复合物植入兔胫骨缺损,结果显示加入了bFGF的实验组新骨生成量显著高于对照组。唐列云等[15]将bFGF直接注射于兔桡骨端骨缺损处,发现外源性bFGF能促进成纤维细胞的增殖和成熟,促进成骨细胞的增殖,从而使新骨的形成增加,加快骨缺损的修复速度。本实验结果显示加入了bFGF的实验组B前4周成骨量增加,提示bFGF增强了多孔钽颗粒的成骨能力,8周后成骨活动减弱,bFGF作为一种多肽类物质,局部应用于体内的半衰期较短,降解较快[16],多孔钽内部的空隙及粗糙表面利于生长因子的贴附,对bFGF起到了一定的控释作用,使生长因子发挥更大效应。实验组 B前4周成骨量最多,之后开始成骨量有所减少,第12周 显著下降,这与bFGF主要是在骨缺损修复的血肿形成机化阶段和原始骨痂形成阶段发挥作用相一致[17],bFGF在成骨前期促进软骨生成,加速软骨矿化,从而缩短了骨愈合时间。
将bFGF负载于多孔钽颗粒应用修复颌骨缺损,既为骨组织的生长提供了具有较好力学性能的支架,也解决了其不可提供成骨因子的缺陷。本实验结果表明,bFGF的应用可增强多孔钽颗粒的骨诱导能力,缩短骨愈合时间,为多孔钽颗粒联合骨生长因子的临床 应用提供依据。本实验不足:样本量较少,未分析bFGF 对多孔钽颗粒促进成骨的剂量效应,骨生成过程中并非单一生长因子作用,需进一步探讨bFGF和其他参与骨修复过程的生长因子的相互影响。
| [1] | Frigg A, Dougall H, Boyd S, et al. Can porous tantalum be used to achieve ankle and subtalar arthrodesis?: a pilot study[J]. Clin Orthop Relat Res,2010, 468 (1) : 209 –216. DOI:10.1007/s11999-009-0948-x |
| [2] | Zhang Y, Li L, Shi Z J, et al. Porous tantalum rod implant is an effective and safe choice for early-stage femoral head necrosis: a meta-analysis of clinical trials[J]. Eur J Orthop Surg Traumatol,2013, 23 (2) : 211 –217. DOI:10.1007/s00590-012-0962-7 |
| [3] | 钟建鑫, 节云峰, 罗金英, 等. 多孔钽颗粒在下颌骨缺损修复中的作用[J]. 第三军医大学学报,2015, 37 (12) : 1277 –1280. DOI:10.16016/j.1000-5404.201502120 |
| [4] | 柯希煌, 练克俭, 翟文亮. 骨生长因子对骨形成的协同作用研究进展[J]. 中国矫形外科杂志,2005, 13 (20) : 1582 –1583. |
| [5] | Omata K, Matsuno T, Asano K, et al. Enhanced bone regeneration by gelatin-beta-tricalcium phosphate composites enabling controlled release of bFGF[J]. J Tissue Eng Regen Med,2014, 8 (8) : 604 –611. DOI:10.1002/term.1553 |
| [6] | Honnami M, Choi S, Liu I L, et al. Bone regeneration by the combined use of tetrapod-shaped calcium phosphate granules with basic fibroblast growth factor-binding ion complex gel in canine segmental radial defects[J]. J Vet Med Sci,2014, 76 (7) : 955 –961. DOI:10.1292/jvms.14-0027 |
| [7] | Nagayasu T, Imamura K, Nakanishi K. Adsorption characteristics of various organic substances on the surfaces of tantalum, titanium, and zirconium[J]. J Colloid Interface Sci,2005, 286 (2) : 462 –470. DOI:10.1016/j.jcis.2005.01.023 |
| [8] | Tang Z, Xie Y, Yang F, et al. Porous tantalum coatings prepared by vacuum plasma spraying enhance bmscs osteogenic differentiation and bone regeneration in vitro and in vivo[J]. PLoS One,2013, 8 (6) : e66263 . DOI:10.1371/journal.pone.0066263 |
| [9] | Hayakawa K, Date H, Tsujimura S, et al. Mid-term results of total knee arthroplasty with a porous tantalum monoblock tibial component[J]. Knee,2014, 21 (1) : 199 –203. DOI:10.1016/j.knee.2013.06.004 |
| [10] | Lachiewicz P F, Bolognesi M P, Henderson R A, et al. Can tantalum cones provide fixation in complex revision knee arthroplasty?[J]. Clin Orthop Relat Res,2012, 470 (1) : 199 –204. DOI:10.1007/s11999-011-1888-9 |
| [11] | Dabrowski B, Swieszkowski W, Godlinski D, et al. Highly porous titanium scaffolds for orthopaedic applications[J]. J Biomed Mater Res B Appl Biomater,2010, 95 (1) : 53 –61. DOI:10.1002/jbm.b.31682 |
| [12] | Su J, Xu H, Sun J, et al. Dual delivery of BMP-2 and bFGF from a new nano-composite scaffold, loaded with vascular stents for large-size mandibular defect regeneration[J]. Int J Mol Sci,2013, 14 (6) : 12714 –12728. DOI:10.3390/ijms140612714 |
| [13] | Kotev-Emeth S, Pitaru S, Pri-Chen S, et al. Establishment of a rat long-term culture expressing the osteogenic phenotype: dependence on dexamethasone and FGF-2[J]. Connect Tissue Res,2002, 43 (4) : 606 –612. |
| [14] | Qu D, Li J, Li Y, et al. Angiogenesis and osteogenesis enhanced by bFGF ex vivo gene therapy for bone tissue engineering in reconstruction of calvarial defects[J]. J Biomed Mater Res A,2011, 96 (3) : 543 –551. DOI:10.1002/jbm.a.33009 |
| [15] | 唐列云, 何爱咏. 局部注射碱性成纤维细胞生长因子对骨缺损修复的影响[J]. 广西医学,2010, 32 (1) : 28 –31. |
| [16] | Shimizu A, Tajima S, Tobita M, et al. Effect of control-released basic fibroblast growth factor incorporated in beta-tricalcium phosphate for murine cranial model[J]. Plast Reconstr Surg Glob Open,2014, 2 (3) : e126 . DOI:10.1097/GOX.0000000000000063 |
| [17] | He X Y, Chen Z Z, Cai Y Q, et al. Expression of cytokines in rat brain with focal cerebral ischemia after grafting with bone marrow stromal cells and endothelial progenitor cells[J]. Cytotherapy,2011, 13 (1) : 46 –53. DOI:10.3109/14653249.2010.510505 |



